はじめに
ミトコンドリアは好気呼吸におけるATP産生の場として重要な細胞小器官です。ミトコンドリアではATP産生に伴い、反応性の高い活性酸素種 (ROS)が酸化還元反応により生成されます。生成されたROSは通常、superoxide dismutase (SOD)等の抗酸化酵素により消去され細胞内で酸化ストレスが起こらないよう制御されています。しかしながら、発生量が多くなり抗酸化酵素による制御ができなくなるとDNAやタンパク質に対し酸化剤として作用することで様々な疾病や老化を引き起こす要因となります。
mtSOX Deep Redはミトコンドリアに集積し、スーパーオキシド選択的に酸化され発蛍光する色素であるため、ミトコンドリアのスーパーオキシドを検出することが可能です。
内容
| mtSOX Deep Red | 100 nmol×1 |
保存条件
0-5°Cにて保存してください。
必要なもの(キット以外)
- 蛍光検出器 (蛍光顕微鏡、蛍光プレートリーダーもしくはフローサイトメーター)
- インキュベーター(37℃)
- マイクロピペット(100–1000 μl, 0.5–10 μl)
- コニカルチューブ
- Hanks' Balanced Salt Solution (HBSS)
- Dimethyl sulfoxide (DMSO)
使用上のご注意
- キット中の試薬は使用前に室温に戻してからご使用下さい。
- 輸送中の振動等により、内容物がスクリューキャップマイクロチューブ壁面やキャップ裏面に付着している場合がありますので、開封前に内容物を底面に落としてからご使用ください。
- 検出器毎の推奨測定波長は表1を参照してください。
表1 検出器別の推奨測定波長
| 検出器 | 蛍光プレートリーダー | 蛍光顕微鏡 | フローサイトメーター |
| 測定波長 | Ex: 535–565 nm Em: 660–690 nm |
(共焦点レーザー顕微鏡) ・Ex/Em: 561/640–700 nm (単染色の場合) ・Ex/Em: 633/640–700 nm (*赤色蛍光色素と多重染色の場合) (落射型蛍光顕微鏡) ・ TxRedフィルター |
APCフィルター |
- mtSOX Deep Redと赤色蛍光色素を多重染色する場合は蛍光波長の漏れ込みを防ぐため、mSOX Deep Redを633 nmで励起してください。
溶液調製
10 mmol/l mtSOX Deep Red DMSO stock solutionの調製
mtSOX Deep Red 100 nmolを含むチューブに10 μlのDMSOを加えピペッティングにより溶解する。
- mtSOX Deep Redはチューブにフィルム状で付着しており、目視では確認しづらい状態となっております。調製後は-20℃で保存して下さい。調製後1か月間安定です。
mtSOX Deep Red working solutionの調製
mtSOX Deep Red 10 mmol/l DMSO stock solutionを培養培地もしくはHBSSで1000倍希釈し、10 μmol/l working solutionを調製する。
- working solutionは保存できません。調製したその日の内にご使用ください。 容器ごとの必要量は表2を参照してください。
表2 容器別 mtSOX Deep Red working solutionの推奨使用量
| 容器 | 35-mmdish | ibidi 8-well plate | 96-well black plate (clear bottom) |
Sample tube (Flow Cytometor) |
| 必要量 | 2 ml/dish | 200 μl/well | 100 μl/well | 0.5 ml/sample |
操作
- 表3を参考に細胞をディッシュまたはプレートに播種し、5% CO2存在下、37℃設定のインキュベーター内で一晩培養する。
表3 検出器別 細胞播種容器
検出器 蛍光プレートリーダー 蛍光顕微鏡 フローサイトメーター 容器 96-well black plate (clear bottom) 96-well black plate (clear bottom)
ibidi 8-well plate
35 mm dish6-well plate - 培地を取り除き、培養培地を用いて細胞を洗浄する。
- 上澄みを除去し、調製したmtSOX Deep Red working solutionを添加し、インキュベーター(37℃, 5% CO2存在下)で30分間インキュベートする。
- working solutionを除去し、HBSSを用いて細胞を2回洗浄する。
- 上清除去後、薬剤等で処理して検出器で蛍光を測定する。
- 操作5.の薬剤処理時間は実験系により最適化して下さい。細胞から色素が漏れ出る可能性がありますので必要なければ薬剤処理後は洗浄操作なしで測定して下さい。
実験例1
Antimycin処理したHeLa細胞のミトコンドリアスーパーオキシド検出
- 96 well Black plateもしくは6 well plateにHeLa細胞 (1×105 cells/ml, MEM, 10% fetal bovine serum,1% penicillin-streptomycin)を播種し、インキュベーター内 (37℃、5% CO2存在下)で一晩培養した。
- 培地を取り除きHBSSで細胞を2回洗浄した。
- 上清を取り除き10 μmol/l濃度のAntimycinを含んだmtSOX Deep Red working solutionを添加し、インキュベーター内 (37℃、 5% CO2存在下)で30分間インキュベートした。
- 各検出器で測定した。
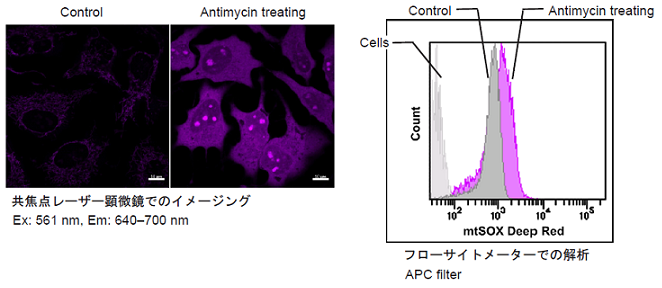
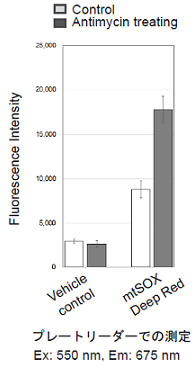
図1 各検出器によるHeLa細胞のミトコンドリアスーパーオキシドの検出
実験例2
Antimycin処理したHeLa細胞のミトコンドリア量、ミトコンドリア膜電位、ミトコンドリアスーパーオキシドの同時解析
- ibidi 8 well plateにHeLa細胞 (3×104 cells/ml, DMEM, 10% fetal bovine serum, 1% penicillin-streptomycin)を播種し、インキュベーター内 (37°C、5%CO2存在下)で一晩培養した。
- 培地を取り除き、HBSSで細胞を2回洗浄した。
- Hoechst33342, MitoTrackerTM Green FM, Tetramethylrhodamine ethyl ester (TMRE)を混合したworking solutionを添加し、インキュベーター内 (37°C、5% CO2存在下)で30分間インキュベートした (Hoechst33342: 1μg/ml, MitoTrackerTM Green FM: 100 nmol/l, TMRE: 150 nmol/l)。
- working solutionを取り除きHBSSで細胞を2回洗浄した。
- 上清を取り除き10 μmol/l濃度のAntimycinを含んだmtSOX Deep Red working solutionを添加し、インキュベーター内 (37°C、5%CO2存在下)で30分間インキュベートした。
- 共焦点レーザー顕微鏡で細胞を観察した。
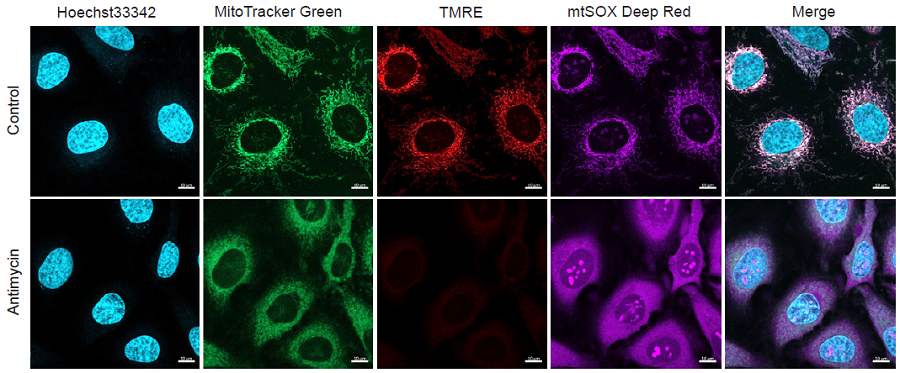
図2 蛍光顕微鏡によるAntimycin処理したHeLa細胞の観察
|
検出器: 共焦点レーザー顕微鏡 |
補足情報
-
mtSOX Deep Redの励起蛍光スペクトル
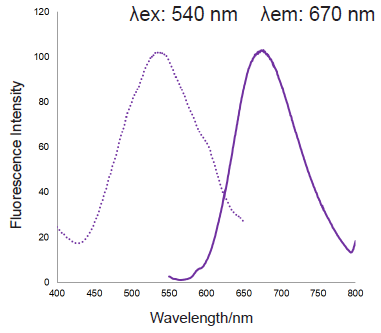
図3 mtSOX Deep Redの励起蛍光スペクトル
-
mtSOX Deep RedのROSに対する選択性
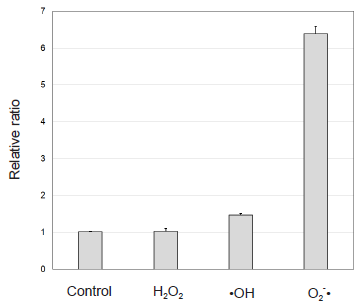
図4 mtSOX Deep RedのROSに対する選択性
mtSOX Deep Redと他社製品のミトコンドリアスーパーオキシドに対する感度差の比較
-
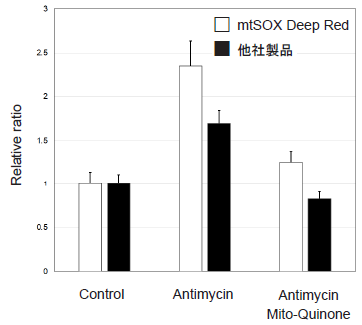
図5 ミトコンドリアスーパーオキシドに対する感度差の比較
よくある質問/参考文献
MT14: mtSOX Deep Red - Mitochondrial Superoxide Detection
Revised Feb., 19, 2024


 を押して省略できます。
を押して省略できます。

