はじめに
マロンジアルデヒド(MDA)は、脂質過酸化物の分解物として生成される化合物であり、細胞や組織サンプル中の脂質過酸化の指標として酸化ストレスやフェロトーシスなど様々な分野で測定されています。MDA Assay Kitは、マロンジアルデヒド(MDA)を測定することができるキットです。加水分解により生じたMDAとチオバルビツール酸(TBA)の反応により生成したTBA付加体の吸光度または蛍光強度を測定することにより、サンプル中のMDAを測定することができます。また、本キットは、抗酸化剤(Antioxidant)を同梱しており、反応によって生じるサンプル中の不要な酸化を防ぐことよりMDA量を測定することが可能です。
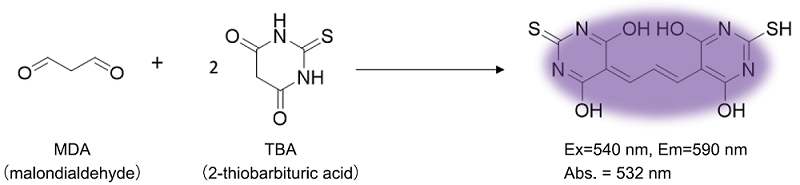
図1 MDA Assay Kitの測定原理
キット内容
| Lysis Buffer | 6.5 ml×1 |
| Dilution Buffer | 10 ml×1 |
| Standard (1 mmol/l) (青キャップ) | 200 μl×1 |
| Substrate (赤キャップ) | 58 mg×1 |
| Antioxidant (緑キャップ) | 200 μl×1 |
保存条件
-20 ℃で保存して下さい。
必要なもの (キット以外)
- マイクロプレートリーダー(蛍光法: Ex. 540 nm/Em. 590 nm, 吸光法: Abs. 532 nm)
- 96 穴マイクロプレート(蛍光法: ブラックプレート, 吸光法: 透明プレート)
- 100–1000 μl、20–200 μl、1–10 μlマイクロピペット
- PBS、DMSO
- コニカルチューブ
- マイクロチューブ
- ボルテックスミキサー
- ヒートブロックまたは水浴(95℃)
- 氷浴
- ホモジナイザー(組織サンプルのみ)
使用上のご注意
- キットの中の試薬は室温に戻してからご使用ください。
- Lysis Bufferの内容物が析出している場合があります。その際は、40–50℃で加温溶解してご使用下さい。
- 正確な測定値を得るために1つの測定試料につき複数(n=3)のウェルを使用して下さい。
- 測定試料は、検量線の範囲内に入るMDA濃度になるように調製し測定して下さい。
- 本キット1setで標準サンプル8点と24サンプルの測定が可能です (n=3で測定する場合)。
測定方法の選択
細胞サンプルを測定する場合は、蛍光法で測定して下さい。
組織サンプルを測定する場合は、下記表を参考に測定法を選択してください。
| サンプル種 | 測定方法 | 測定可能MDA濃度 | 必要サンプル量 |
| 培養細胞 | 蛍光法 | 1–10 μmol/l | 1–3×107 cells |
| 組織 | 蛍光法 | 1–10 μmol/l | 10–30 mg |
| 吸光法 | 10–50 μmol/l | 20–50 mg |
- 組織サンプルを測定する場合は吸光法で測定する方が少量のサンプル使用量で測定可能です。
吸光法で感度が足りない場合は蛍光法で測定して下さい。
溶液調製
Substrate stock solutionの調製
Substrate (赤キャップ)にDMSO 400 μlを加え、超音波を照射し溶解する。
- Substrate stock solutionは冷凍保存(-20℃)して下さい(2ヶ月間安定)。
Antioxidant PBS solutionの調製
- マイクロチューブにPBSを加える。
- 操作(1)のマイクロチューブにAntioxidantを加え混合し、懸濁状態とする。
- 操作(2)から溶液が白濁し懸濁状態となりますが、後の加温操作で溶解するためそのままご使用下さい。
- Antioxidant PBS solutionは、表1を参照に調製して下さい。
- 調製後のAntioxidant PBS solutionは保存できません。その日のうちにお使い下さい。
表1 Antioxidant PBS solutionの調製例
-
蛍光法 8サンプル分 16サンプル分 24サンプル分 PBS 990 μl 1980 μl 2970 μl Antioxidant 10 μl 20 μl 30 μ
-
吸光法 8サンプル分 16サンプル分 24サンプル分 PBS 4950 μl 8910 μl 14850 μl Antioxidant 50 μl 90 μl 150 μl
Working solutionの調製
- コニカルチューブにDilution Bufferを加える。
- 操作(1)のコニカルチューブにSubstrate stock solution を加え混合する。
- Working solutionは、表2を参照に調製して下さい。
- 調製後のWorking solutionは保存できません。その日のうちにお使い下さい。
表2 Working solutionの調製例
| スタンダード (8サンプル) |
8サンプル分 | 16サンプル分 | 24サンプル分 | |
| Dilution Buffer | 2500 μl | 2500 μl | 4800 μl | 7200 μl |
| Substrate | 90 μl | 90 μl | 172 μl | 260 μl |
操作
蛍光法
1. MDA standard solutionの調製
- Standard (1 mmol/l) 10 μlを超純水 990 μlで希釈し、10 μmol/l MDA standard solutionを調製する。
- 操作1.で調製した10 μmol/l MDA standard solution 100 μlを超純水 100 μlで順次2倍希釈し、標準液(5, 2.5, 1.25, 0.625, 0.313, 0.156, 0 μmol/l)とする(図2参照)。
- 調製した10 μmol/lのMDA standard solution 100 μlを新しいマイクロチューブに入れる。
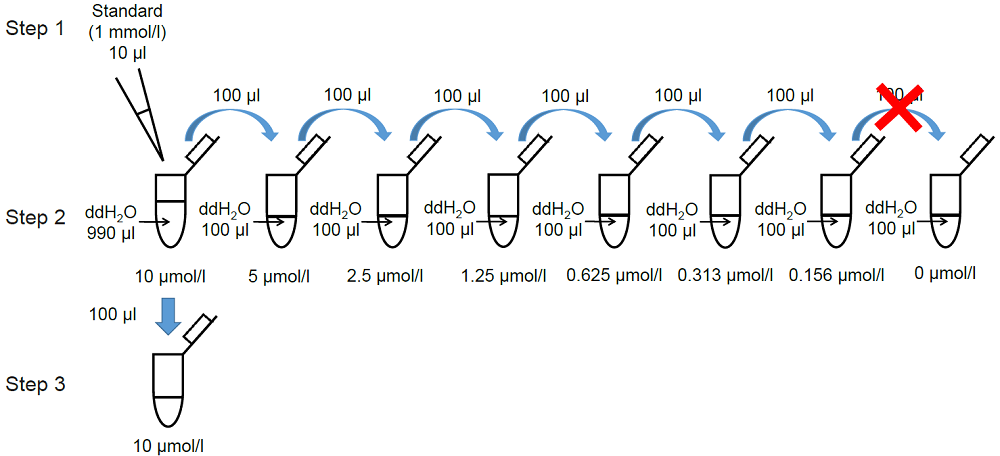
図2 MDA standard solutionの調製方法
2. 測定用サンプルの調製
-細胞サンプル-
- 細胞(1–3 ×107 cells)を1.5 mlマイクロチューブに準備する。
- 使用する細胞種や薬剤などによって必要細胞数が異なる場合があります。推奨細胞数を目安に最適な細胞数をご検討下さい。
- 300×gで5分間遠心し、上清を除去する。
- PBS 1 mlを加え、ピペッティングにより懸濁後、300×g で5分間遠心し、上清を除去する。
- Antioxidant PBS solution 100 μlを加え、ピペッティングにより懸濁する。
-組織サンプル-
- 組織10–30 mgを1.5 mlマイクロチューブに準備する。
- 血液成分が測定に影響を与えるため、必ず灌流処理を行った組織サンプルを使用して下さい。
- 使用する組織によって必要量が異なる場合があります。20 mg前後を目安にご検討ください。
- Antioxidant PBS solution 300 μlを加え、氷浴上でホモジナイズする。
- 操作2.で調製した溶液をマイクロチューブに移し、10000×gで5分間遠心する。
- 上清100 μlを新しいマイクロチューブに移す。
3. 測定
- サンプルもしくはMDA standard solutionが入ったマイクロチューブにLysis Buffer 100 μlを加えボルテックスミキサーで混合した後、常温で5分間静置する。
- 溶液の粘性が高くなるため、ピペッティングでは混合できません。ボルテックスミキサーで混合して下さい。
- タンパク質定量にてMDA量の補正を行う場合は、溶液の粘性が高くなっているためシリンジに25G程度の細い針を付け、サンプル溶液をシリンジでスムーズに出し入れができるまで(20-30回)混合した溶液をタンパク質定量用のサンプルとして下さい。タンパク質定量を行う場合は、BCA法での測定を推奨します。
- Working solution 250 μlを各マイクロチューブに加え、ボルテックスミキサーで混合する。
- 95℃で15分間インキュベートする。
- 氷浴上で5分間冷却する。
- 10000×gで10分間遠心し、上清 100 μlを96穴マイクロプレート(ブラック)の各ウェルに入れる。
- 遠心後も上清中に浮遊物が残っている場合は、上清を0.2 μmのフィルターに通したものをサンプルとして使用して下さい。
- 蛍光プレートリーダーを用いて蛍光強度を測定する (Ex: 540 nm, Em: 590 nm)。
- 測定試料中のMDA濃度を検量線より求める。
-
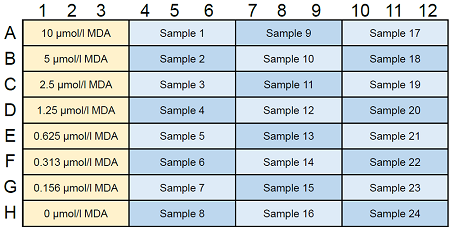
図3 MDA standard solutionとサンプルのプレートレイアウト例(n=3)
-
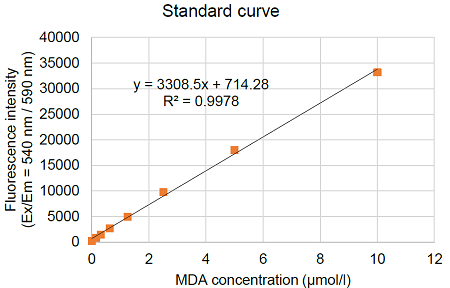
図4 MDA検量線の例
吸光度法
1. MDA standard solutionの調製
- Standard (1 mmol/l) 50 μlを超純水 950 μlで希釈し、50 μmol/l MDA standard solutionを調製する。
- 操作1.で調製した50 μmol/l MDA standard solution 200 μlを超純水 200 μlで順次2倍希釈し、標準液(25,12.5, 6.25, 3.125, 1.563, 0.781, 0 μmol/l)とする(図5参照)。
- 調製した50 μmol/lのMDA standard solution 200 μlを新しいマイクロチューブに入れる。
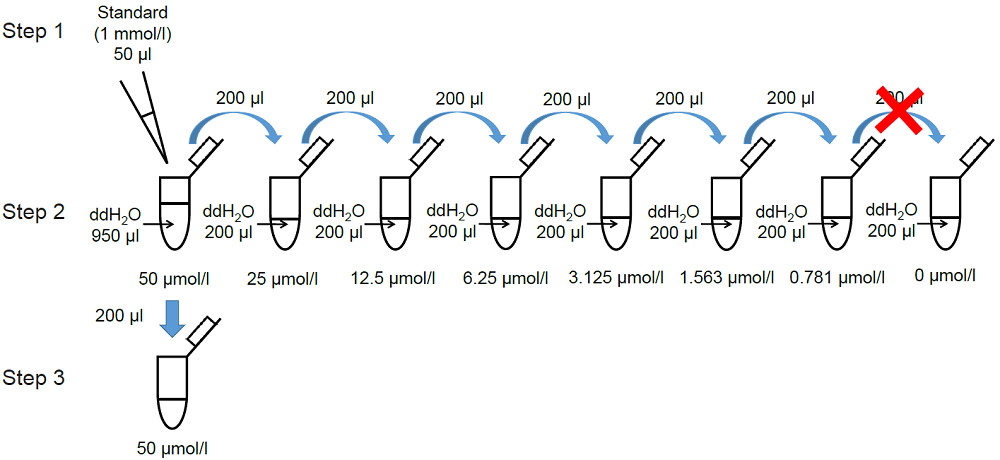
図5 MDA standard solutionの調製方法
2. 測定用サンプルの調製
-組織サンプル-
- 組織20–50 mgを1.5 mlマイクロチューブに準備する。
- 血液成分が測定に影響を与えるため、必ず灌流処理を行った組織サンプルを使用して下さい。
- 使用する組織によって必要量が異なる場合があります。30 mg前後を目安にご検討ください。
- Antioxidant PBS solution 500 μlを加え、氷浴上でホモジナイズする。
- 操作(2)で調製した溶液をマイクロチューブに移し、10000×gで5分間遠心する。
- 上清200 μlを新しいマイクロチューブに移す。
3. 測定
- サンプルもしくはMDA standard solutionが入ったマイクロチューブにLysis Buffer 200 μlを加えボルテックスミキサーで混合した後、常温で5分間静置する。
- 溶液の粘性が高くなるため、ピペッティングでは混合できません。ボルテックスミキサーで混合して下さい。
- タンパク質定量にてMDA量の補正を行う場合は、溶液の粘性が高くなっているためシリンジに25G程度の細い針を付け、サンプル溶液をシリンジでスムーズに出し入れができるまで(20-30回)混合した溶液をタンパク質定量のサンプルとして下さい。タンパク質定量を行う場合は、BCA法での測定を推奨します。
- Working solution 300 μlを各マイクロチューブに加え、ボルテックスミキサーで混合する。
- 95℃で15分間インキュベートする。
- 氷浴上で5分間冷却する。
- 10000×gで10分間遠心し、上清 200 μlを96穴マイクロプレート(透明)の各ウェルに入れる。
- 遠心後も上清中に浮遊物が残っている場合は、上清を0.2 μmのフィルターに通したものをサンプルとして使用して下さい。
- プレートリーダーを用いて532 nmの吸光度を測定する。
- 測定試料中のMDA濃度を検量線より求める。
-
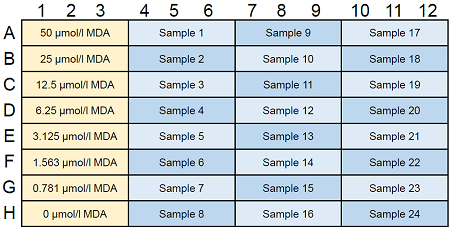
図6 MDA standard solutionとサンプルのプレートレイアウト例(n=3)
-
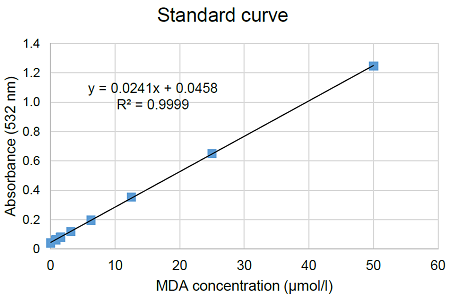
図7 MDA検量線の
実験例1
Erastin処理によりフェロトーシスを誘導したHepG2細胞内のMDA濃度変化の評価
- HepG2細胞(1×107cells/dish)を15 cm dishに播種し、インキュベーター(37℃、5%CO2存在下)で一晩培養した。
- 培地を吸引除去し、DMEM培地で希釈した100 μmol/l Erastin溶液20 mlを加え、インキュベーター(37℃、5%CO2存在下)で3時間インキュベートした。
- 培地を吸引除去し、PBS 5 mlで1回洗浄した。
- トリプシン処理により細胞を剥がした後、DMEM培地でコニカルチューブに回収した。
- Erastin処理あり、なしのHepG2細胞(1×107 cells/tube)をそれぞれ5 mlマイクロチューブに準備した。
- 300×gで5分間遠心し、上清を除去した。
- PBS 1 mlを加え、ピペッティングにより懸濁し1.5 mlマイクロチューブに全量移した。
- 300×gで5分間遠心し、上清を除去した。
- Antioxidant PBS solution 100 μlを加え、ピペッティングにより懸濁した。
- MDA standard solutionを調製した(蛍光法:MDA standard solutionの調製参照)。
- 調製した測定試料およびMDA standard solutionが入ったマイクロチューブにLysis Buffer 100 μlずつ加え、ボルテックスミキサーで混合した。
- 常温で5分間静置した。
- 調製したWorking solution 250 μlを各チューブに加え、ボルテックスミキサーで混合した。
- 95℃に加温したヒートブロックで15分間加温した。
- 氷浴で5分間冷却した。
- 10000×gで10分間遠心した。
- 上清 100 μlずつを96穴マイクロプレート(ブラック)に入れた。
- 蛍光プレートリーダーを用いて蛍光強度を測定し(Ex:540 nm, Em: 590 nm)、測定試料中MDA濃度を検量線より求めた。求めた測定試料中MDA濃度をBCA法によって定量したタンパク質量で補正した。
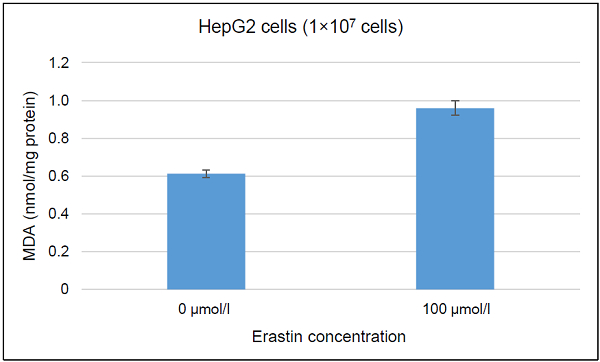
図8 Erastin処理によりフェロトーシスを誘導したHepG2細胞内のMDA濃度の変化
実験例2
KK-Ayマウス肝臓中のMDA濃度の測定
- 組織30 mgにAntioxidant PBS solution 500 μlを加え、氷浴上でホモジナイズした。
- 操作(1)で調製した溶液をマイクロチューブに移し、10000×gで5分間遠心した。
- 上清200 μlを新しいマイクロチューブに移した。
- MDA standard solutionを調製した(吸光法:MDA standard solutionの調製参照)。
- 調製した測定試料およびMDA standard solutionが入ったマイクロチューブにLysis Buffer 200 μlずつを加え、ボルテックスミキサーで混合した。
- 常温で5分間静置した。
- 調製したWorking solution 300 μlを各チューブに加え、ボルテックスミキサーで混合した。
- 95℃に加温したヒートブロックで15分間加温した。
- 氷浴で5分間冷却した。
- 10000×gで10分間遠心した。
- 上清 200 μlずつを96穴マイクロプレート(透明)に入れた。
- プレートリーダーを用いて532 nmの吸光度を測定し、測定試料中MDA濃度を検量線より求めた。
表3 KK-Ayマウス肝臓中のMDA濃度
| MDA濃度(µmol/l) | |
| KK-Ay マウス肝臓 (30 mg) |
21.15 |
よくある質問/参考文献
M496: MDA Assay Kit
Revised Dec., 12, 2023


 を押して省略できます。
を押して省略できます。