はじめに
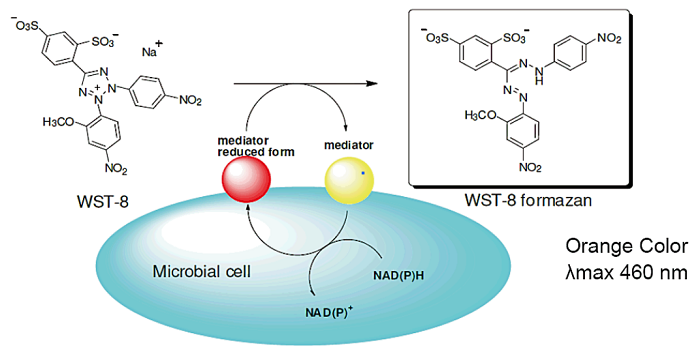
NADH(NADPH)はエネルギー代謝活動に関与する補酵素であり、生命体の活動をつかさどっています。Microbial Viability Assay Kit-WSTはこの補酵素の還元能を利用する事で、微生物の代謝活性を比色検出します。還元発色試薬WST-8はmediatorを介し有色のformazanへと還元されます。吸光度と生成するformazan量との間には比例関係が見られるため、吸光度を測定することで微生物の代謝活性を求めることができます。本キットには測定に必要な試薬が全て含まれており、簡便にかつ短時間に測定することができます。
キット内容
| 100 tests | 500 tests | |
| WST solution | 1 ml x 1 | 1 ml x 5 |
| Electron Mediator reagent (DMSO solution) | 0.1 ml x 1 | 0.5 ml x 1 |
保存条件
0–5 ℃にて保存してください。
必要なもの (キット以外)
- 96 穴マイクロプレート
- インキュベーター
- マイクロピペット(10 μl, 200 μl)及びマルチチャンネルピペット(200 μl)
- 1.5 ml チューブ
使用上のご注意
- 還元剤が存在するとWST-8 が還元され、バックグラウンドが上昇することがあります。還元能のある薬剤を用いる場合は、薬剤自身による発色の有無を確認してください。
- 気泡は測定値のバラツキの原因となりますので、ご注意ください。
- 発色に要する時間は微生物種や代謝活性に依存します。
- 微生物によっては発色後、退色することがあります。
Viability Assay
発色試薬の調製
WST solutionとElectron mediator reagent を 9 : 1 の比率で1.5 mLチューブで混合する。
発色試薬は0–5 ℃で保存して下さい。調製後、1ヶ月は安定です。
- 96穴プレートの1 wellあたり10 μlの発色試薬が必要です。検体数に応じ分注量を決定して下さい。
- グラム陽性菌または真菌の場合、Electron mediator reagentをDMSOまたは滅菌水にて8倍希釈したもので検出試薬を調製して下さい。グラム陰性菌はそのままの濃度でご使用頂けます。なお、一部のグラム陰性菌(腸炎ビブリオ)で良好な発色が得られない場合がございますので、その場合はグラム陽性菌及び真菌用の検出試薬濃度でお試し下さい。
生存率測定
- 96穴マイクロプレートの各ウェルに菌懸濁液190 μlを播種する。
- 発色試薬を各ウェルに10 μlずつ添加する。
- インキュベーター内で培養する。
- マイクロプレートリーダーで450 nmの吸光度を測定する。
- 微生物を含まない培地をブランクとする。
以下の微生物には、本キットでの使用実績があります。
真菌 :
Candida utilis, Saccharomyces cerevisiae, Zygosaccharomyces rouxii, Candida albicans, Candida krusei, Candida parapsilosis
グラム陽性菌 :
Bacillus cereus, Bacillus subtilis, Corynebacterium glutamicum, Enterococcus faecalis, Lactobacillus casei, Listeria monocytogenes, Micrococcus luteus, Staphylococcus aureus,Staphylococcus epidermidis
グラム陰性菌 :
Acetobacter sp., Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Pseudomonas aeruginosa, Salmonella enteritidis, Salmonella typhimurium, Serratia marcescens, Vibrio parahaemolyticus, Yersinia enterocolitica
薬剤感受性試験
グラム陰性菌
- 微生物を最適な培地で培養する。
- 培養した菌懸濁液を滅菌生理食塩水でOD550 が約 0.125 (0.5 McFarland相当)となるように希釈し、さらに滅菌生理食塩水で10 倍希釈し接種用菌液とする(約107 CFU/ml)。
- WST solutionとElectron mediator reagent を9 : 1の比率で1.5 mlチューブで混合し、発色試薬を調製する。(発色試薬は調製後4 ℃保存して下さい。1ヶ月間は安定です。)
- Ca 及び Mg イオン濃度調整済み Mueller-Hinton broth を用いて抗生物質 (被検物質) の 2 倍希釈系列を調製する。(例えば、64, 32, 16, 8, 4, 2, 1, 0.5, 0.25, 0.12, 0.06 μg/mL)
- 96 well プレートへ抗生物質含有 Mueller-Hinton broth 180 μl/ well を分注する。
- 各wellへ接種用菌液 10 μlを分注する(約105 CFU/well)。
- 微生物に最適な温度で 6 時間インキュベーションする。
- 発色試薬10 μl/wellを添加し、更に2 時間インキュベーション*する。
- 発色に要する時間は、微生物種や代謝活性に依存します。
- マイクロプレートリーダーを用い 450 nmの吸光度を測定する。
グラム陽性菌, 酵母及び発色の悪い微生物(腸炎ビブリオなど)
Electron mediator reagent をDMSOもしくは滅菌水にて8 倍希釈して使用してください。
-
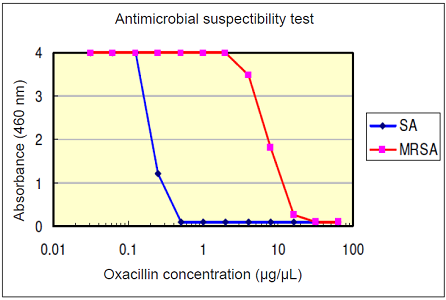
MIC (Oxacillin concentration μg/mL) Microbial Viability
Assay Kit-WSTMicrodilution
methodSA 0.5 0.5 MRSA 32 64 SA: Staphylococcus aureus subsp. aureus (NBRC12732),
MRSA: Methicillin-resistant Staphylococcus aureus subsp. aureus (FJCM8702)
参考文献
- T. Tsukatani, H. Suenaga, T. Higuchi, T. Akao, M. Ishiyama, T. Ezoe and K. Matsumoto, "Colorimetric cell proliferation assay for microorganisms in microtiter plate using water-soluble tetrazolium salt", J of Microbiol. Methods, 2008, 75, 109.
- T. Tsukatani, T. Higuchi, H. Suenaga, T. Akao, M. Ishiyama, T. Ezoe and K. Matsumoto, "Colorimetric microbial viability assay based on reduction of water-soluble tetrazolium salts for antimicrobial susceptibility testing and screening of antimicrobial substances", Anal. Biochem., 2009, 393, 117.
本キットは福岡県工業技術センター生物食品研究所との共同開発品です。
よくある質問/参考文献
M439: Microbial Viability Assay Kit-WST
Revised Aug., 31, 2023


 を押して省略できます。
を押して省略できます。