はじめに
グルコースは、生体のエネルギー源として最も重要な物質であり、主要なエネルギー代謝の指標の1つです。糖尿病や肥満研究における糖代謝の指標としてだけでなく、がん研究においても、細胞内代謝の変化を確認するための指標として、乳酸と一緒によく測定されています。最近の研究では、グルコース代謝と脂質代謝の両方に関与している酵素の働きを阻害することが、がん細胞の増殖抑制には効果的であるということが報告されています1)。
Glucose Assay Kit-WSTは、エネルギー代謝基質であるグルコースを定量することができるキットです。WSTホルマザンの発色を測定することで細胞培養液中のグルコースを定量するのに最適化されており、グルコース濃度 0.02 mmol/Lから測定することができます。また、96穴マイクロプレートに対応しているため、多検体測定が可能です。
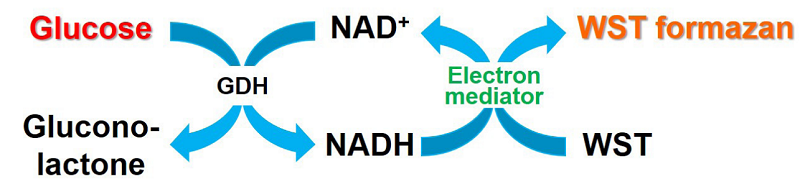 |
| 図1 Glucose Assay Kit-WSTの測定原理 |
キット内容
| 50 tests | 200 tests | |
| Dye Mixture | x 1 | x 1 |
| Glucose Standard (10 mmol/L) (赤キャップ) | 150 μL x 1 | 600 μL x 1 |
| Enzyme (緑キャップ) | x 1 | x 1 |
| Assay Buffer | 3.5 mL x 1 | 14 mL x 1 |
| Reconstitution Buffer (青キャップ) | 350 μL x 1 | 1.4 mL x 1 |
保存条件
0-5 oCで保存して下さい。
必要なもの (キット以外)
- プレートリーダー(450 nmの吸光フィルター)
- 96 穴マイクロプレート
- インキュベーター(37°C)
- 20-200 μLのマルチチャンネルピペット
- 100-1000 μL、20-200 μLマイクロピペット
- PBS
- 0.1% Triton水溶液 (必要に応じて)
- コニカルチューブ
使用上のご注意
- キットの中の試薬は、室温に戻してからご使用下さい。
- 輸送中の振動等により、内容物がスクリューキャップマイクロチューブ壁面やキャップ裏面に付着している場合がありますので、開封前に内容物を底面に落としてからご使用下さい。
- 正確な測定値を得るために、1つの測定試料につき複数(n=3以上)のウェルを使用下さい。
- Working solutionをサンプルに加えると直ちに発色が始まります。各ウェル間のタイムラグによる測定誤差を少なくするためにマルチチャンネルピペットをご使用下さい。
- 測定試料は、検量線範囲内に入るように希釈したものを数種類調製し、測定に用いて下さい。
- 本キットにはガラス製容器およびアルミ製シールキャップを使用しております。取扱いに際しては、保護手袋を着用いただくなど、ご注意下さい。
- 本品は細胞培養上清中のグルコースの定量に最適化されています。細胞内グルコース濃度を測定する場合、細胞溶解液の調製およびGlucose standard solutionの調製には0.1% Triton水溶液をご使用下さい(使用例は製品HPに掲載しています)。
溶液調製
Dye Mixture stock solutionの調製
Dye Mixtureのバイアル瓶にReconstitution Bufferを全量加えて溶解する。
- Dye Mixture stock solutionはReconstitution Bufferが入っていた瓶に移し、遮光下、冷蔵保存(0-5 oC)して下さい(2ヶ月間安定)。
Enzyme stock solutionの調製
EnzymeにPBSを加え、ピペッティングにより溶解する。
- Enzyme stock solution調製におけるPBS添加量は表1を参照して下さい。
- 内容物がチューブ底面から外れ、チューブ壁面やキャップ裏面に付着している場合があります。開封前に内容物を底面に落としてからご使用下さい。
- Enzyme stock solutionは氷浴上で使用し、溶解後は冷蔵保存(0-5 oC)して下さい(2カ月間安定)。
| 50 tests | 200 tests | |
| PBS添加量 | 65 µL | 260 µL |
Working solutionの調製
- コニカルチューブにDye Mixture stock solutionを加え、Assay Bufferで希釈する。
- 操作 1 で調製した溶液にEnzyme stock solutionを加える。
- Working solution調製における各溶液使用量は、表2を参照して下さい。
- Working solutionは光に不安定であるため、使用直前に調製し、調製後はアルミホイルで覆うなどして遮光して下さい。
また、調製後のWorking solutionは保存できません。その日のうちにお使い下さい。
| 24 well | 48 well | 96 well | |
| Dye Mixture stock solution | 150 μL | 300 μL | 600 μL |
| Assay Buffer | 1.35 mL | 2.7 mL | 5.4 mL |
| Enzyme stock solution | 27 μL | 54 μL | 108 μL |
操作
1. 測定用サンプルの調製
細胞培養上清測定試料を準備する(Sample)。
- 測定試料は、検量線範囲内(0-0.5 mmol/L)に入るように超純水で希釈したものを数種類調製してから測定して下さい。
- 測定試料は1ウェルあたり50 μL必要です。
2. Glucose standard solutionの調製
10 mmol/L Glucose Standard 50 μLを超純水950 μLで希釈し、0.5 mmol/L Glucose standard solutionを調製する。さらに順次2倍希釈していき、標準液(0.5, 0.25, 0.125, 0.0625, 0.0313, 0.0157, 0.00785, 0 mmol/L)とする(図2参照)。
- 細胞溶解溶液中のGlucose濃度を測定する場合、超純水の代わりに、0.1% Triton水溶液をGlucose standard solutionの調製にご使用下さい。
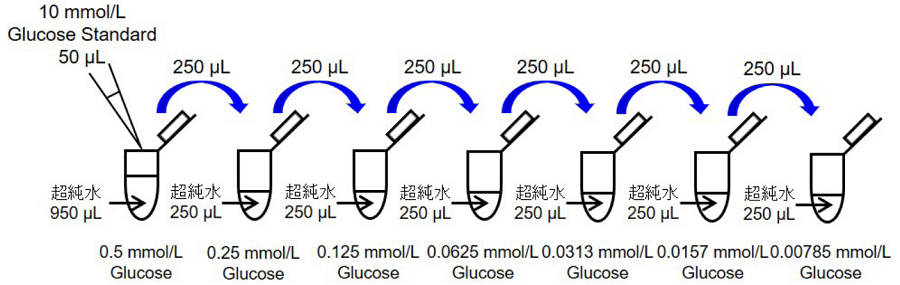
図2 Glucose standard solutionの調製方法
3. 測定
- Glucose standard solutionおよびSampleを50 μLずつ、各ウェルに入れる(図3参照)。
- 正確な測定値を得るために、1つの測定試料につき複数(n=3以上)のウェルをご使用下さい。
- Working solution 50 μLを各ウェルに入れる。
- Working solutionを加えると直ちに発色が始まります。各ウェル間のタイムラグを少なくするためにマルチチャンネルピペットをご使用下さい。
- 37 oCで30分間インキュベートする。
- インキュベートする際は、溶液の揮発を防ぐため、マイクロプレート用シール等をご使用下さい。
- プレートリーダーを用いて450 nmの吸光度を測定する。
- 測定試料(Sample)中のGlucose濃度を検量線より求める。
- これにより求められた値は、調製した測定試料溶液中のGlucose濃度です。希釈前の試料中に含まれるGlucose濃度は、得られた測定値と試料の希釈倍率より算出して下さい。
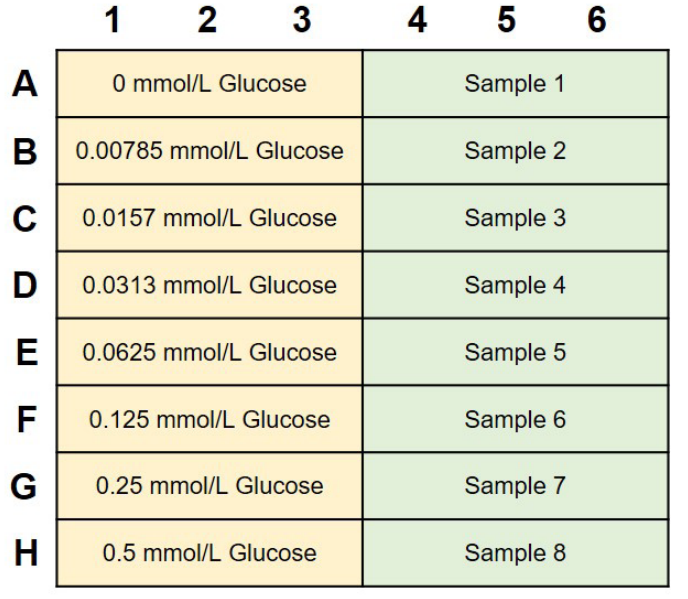
図3 Glucose standard solutionとサンプルの
プレートレイアウト例(n=3)
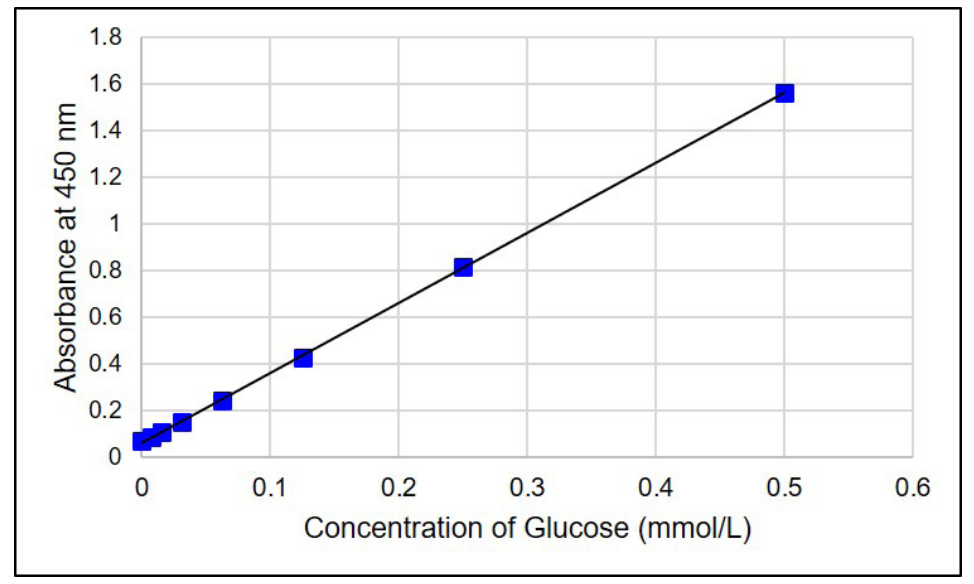
図4 Glucose検量線の例
実験例
Phloretinによるグルコース取り込み阻害評価
- 培地で目的の濃度に調製したPhloretin溶液に、Jurkat細胞(5×105 cells/mL、10% fetal bovine serum、1% penicillin-streptomycinを含むRPMI培地)を懸濁させた。
- 操作 1.の細胞懸濁液を6穴プレートに播種(1×106 cells/well)し、37 oC、5% CO2インキュベーターで一晩培養した。
- 細胞懸濁液をコニカルチューブに回収し、1,500 rpmで5分間遠心した。
- 1.5 mLマイクロチューブに細胞培養上清を100 μL取り、超純水で30倍希釈したものを調製した。
- Glucose standard solutionを調製し、標準液を調製した(Glucose standard solutionの調製参照)。
- 調製した測定試料およびGlucose standard solutionを50 μLずつ、96 穴マイクロプレートに入れた。
- 調製したWorking solution 50 μLを各ウェルに加えた。
- 37 oCで30分間インキュベートした。
- プレートリーダーを用いて450 nmの吸光度を測定し、測定試料中Glucose濃度を検量線より求めた。
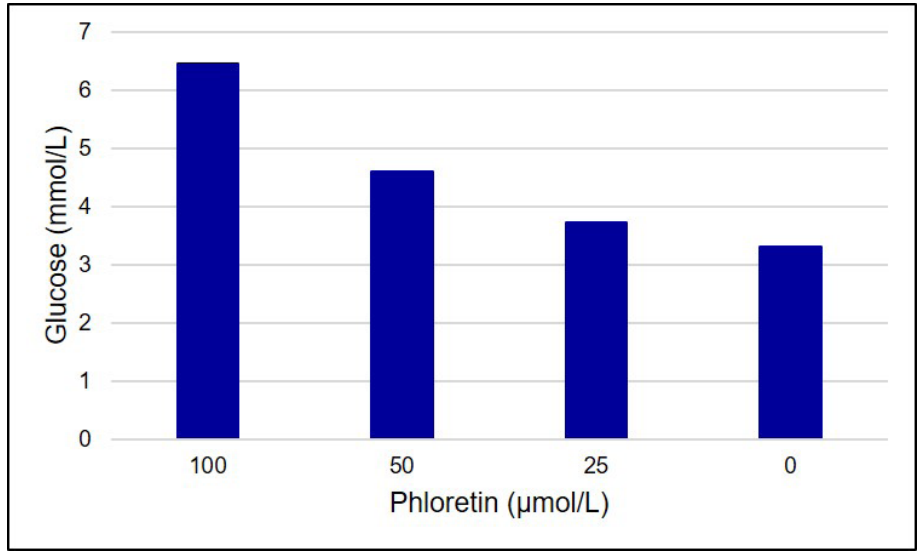
図5 Phloretinによるグルコース取り込み阻害評価
グルコーストランスポーター阻害剤であるPhloretin濃度に依存して、細胞培養上清中Glucose消費量が減少することを確認した。
参考文献
1) Xiaoping, Z. et al., J. Biol. Chem., 2018, 293, 6623-6634.
よくある質問/参考文献
G264: Glucose Assay Kit-WST
Revised Jan., 17, 2024


 を押して省略できます。
を押して省略できます。

