はじめに
細胞内の不要なタンパク質や細胞小器官は、再利用または代謝するための分解過程が存在し、オートファジーと呼ばれています。この過程において、二重膜で構成される隔離膜は次第に伸長し、不要物を覆いオートファゴソームを形成します。内容物は、オートファゴソームとリソソームが融合したオートリソソームの段階で消化酵素により分解を受けます。この細胞機能はパーキンソン病などの神経変性疾患、老化に関りがあることが分かってきているため、ドラッグスクリーニングに対応した簡単なオートファジー検出手法が求められます。
低分子蛍光化合物のDAPRedは、構造特性により形成過程のオートファゴソームに導入され二重膜の疎水環境に応答して蛍光発光します。低分子のため細胞への導入も容易であり、遺伝子導入などの必要はありません。オートリソソームの蛍光ライブセルイメージングには、別途発売しておりますDALGreen[D675]が使用可能です1)。
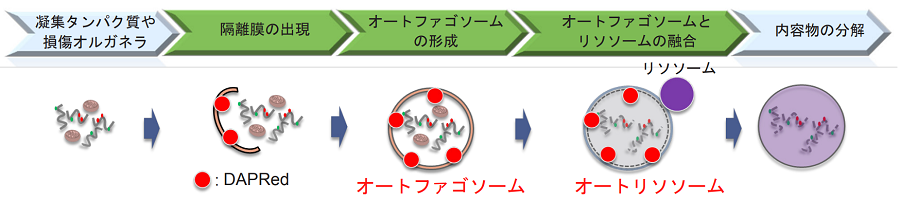
図1 DAPRedによるオートファジー検出
内容
| DAPRed - Autophagy Detection | 5 nmol x 1 |
保存条件
遮光、0-5℃にて保存してください。
必要なもの
- Dimethyl sulfoxide (DMSO)
- 培養培地
- HBSSまたはフェノールレッド不含培地
- Micropipettes
溶液調製
0.1 mmol/L DAPRed DMSO stock solutionの調製
DAPRed 5 nmolを含むチューブに50 μLのDMSOを加えピペッティングにより溶解する。
- 調製後は遮光、-20℃で保存してください。調製後1か月間安定です。
DAPRed working solutionの調製
最終濃度が0.1 μmol/LになるようにDAPRed DMSO stock solutionを培養培地で希釈する。
- 使用する細胞種によりDAPRed working solutionの最適濃度が異なります。最適条件をご検討ください。
操作

- 細胞をディッシュに播種し培養する。
- 培地を除去後、培養培地で1回洗浄する。
- 調製したDAPRed working solutionを添加し、37℃で30分間インキュベートする。
- 上澄みを除去後、培養培地で2回洗浄する。
- オートファジー誘導刺激剤を含む培地を加え37℃でインキュベートする。
- オートファジー誘導条件に応じてインキュベート時間を設定して下さい。
- 蛍光顕微鏡で観察する。
| 推奨フィルター | 励起波長(nm) | 蛍光波長(nm) |
| 蛍光顕微鏡 | 500–560 | 690–750 |
実験例
共焦点レーザー顕微鏡による観察
CELLview 10 ウェルスライドにHeLa細胞を播種し37℃、5% CO2インキュベーターにて一晩培養した。MEM培地(Thermo Fisher Scientific, 10% (v/v) fetal bovine serum、 2 mM L-glutamine、 1% nonessential amino acids、 100 units/mL penicillin、100 μg/mL streptomycin)で1回洗浄後、0.1 μmol/L DAPRed working solution 100 μLを添加し30分インキュベートした。MEM培地で2回洗浄後、MEM培地またはアミノ酸不含培地(和光純薬工業, 製品コード:048-33575)で6時間培養した。フェノールレッド不含培地に置換後、共焦点レーザー顕微鏡で観察した。
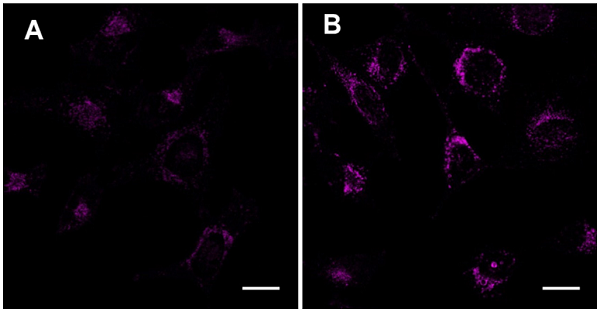 図2 DAPRed染色HeLa細胞の共焦点レーザー顕微鏡画像 |
検出波長: 561 nm (Ex) 600–700 nm (Em) スケールバー: 20 μm |
DAPRedで染色したHeLa細胞を、A) 栄養豊富な培地(MEM培地)で6時間培養した後の画像、B) アミノ酸不含培地で6時間培養した後の画像。
蛍光特性
DAPRedの励起、蛍光スペクトル
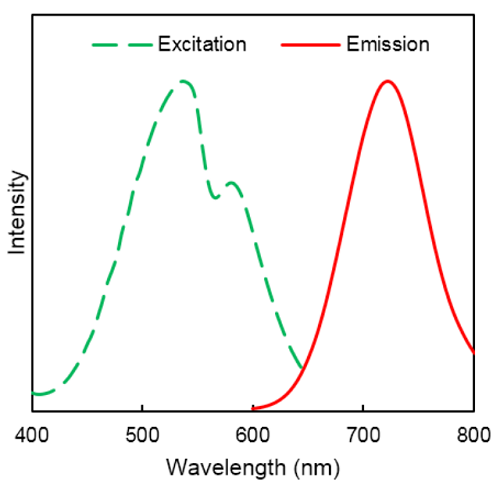 |
λex : 530 nm λem : 720 nm |
参考文献
- H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu,and Y. Ueno, ‘’Small fluorescent molecules for monitoring autophagic flux’’, FEBS Lett., 2018, 592, 559-567.
よくある質問/参考文献
D677: DAPRed - Autophagy Detection
Revised May., 22, 2023


 を押して省略できます。
を押して省略できます。

