はじめに
本説明書は、Cytotoxicity LDH Assay Kit-WSTを用いた抗体依存性細胞傷害測定用(Antibody-dependent cell-mediated cytotoxicity: ADCC)です。
本製品のキット内容やWorking Solutionの調製方法に関して、製品取扱い説明書も合わせてご覧ください。
正確な測定のために
細胞の種類によってLDH活性が異なるため、ターゲット細胞の種類を変える場合には、抗体依存性細胞傷害測定を行う前に図の順番に従ってターゲット細胞数の最適化を行ってください。
| ターゲット細胞数の最適化 |
 |
| 抗体依存性細胞障害測定 |
測定方法の選択
実験条件に応じて または
または を選択し、各測定方法の手順に従ってください。
を選択し、各測定方法の手順に従ってください。
ホモジニアス測定
ターゲット細胞数の最適化
- ターゲット細胞を培地で洗浄後、培地を用いて5×105 cells/ml のターゲット細胞懸濁液を調製する。
- 培地100 μlを96穴マイクロプレートの各ウェルに加える。
- 96穴マイクロプレートA行のウェル(高コントロール用:TMRおよび低コントロール用:TSRの各々3ウェル)に(1)のターゲット細胞懸濁液100 μl を加え、ピペッティングで混合する(2.5×104 cells/well)。A行のウェル中の細胞懸濁液100 μl をB行のウェルに移し、2倍希釈する。この操作を繰り返して2倍希釈系列を作成する。(図1)
-
TMR (Target Maximum Release, 高コントロール):
ターゲット細胞にLysis Bufferを加えて、全ての細胞から放出されるLDH活性を測定する。TSR (Target Spontaneous Release,低コントロール):
ターゲット細胞には培地以外加えず、細胞から自発的に放出されるLDH活性を測定する。CMB (Culture Medium Background,バックグラウンドコントロール):ターゲット細胞を含まない培地中の血清成分に由来するLDH活性を測定する。
-
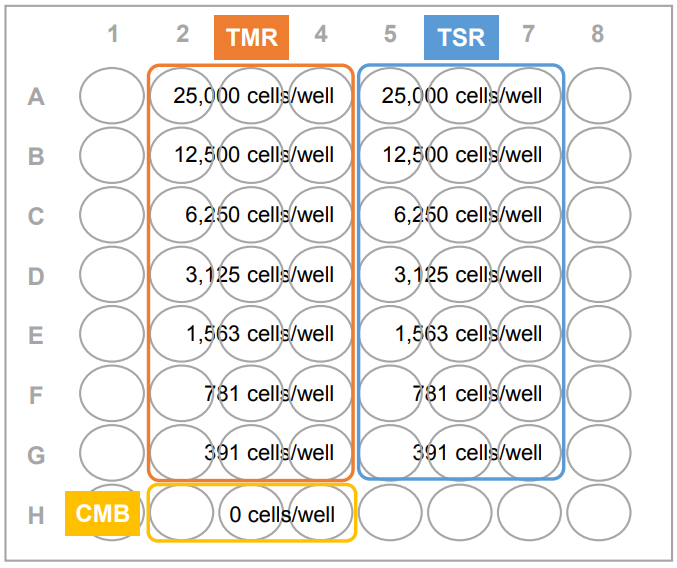
図1 プレート配置例
-
- 37 ℃のCO2インキュベーターで静置する。
- インキュベーション時間は実際の抗体依存性細胞傷害測定と同じ時間に合わせてください。
- 高コントロール(TMR)の各ウェルにLysis Buffer 10 μl を加える。
- 37 ℃のCO2インキュベーターで30分間静置する。
- 全てのウェルにWorking Solution 100 μl を加える。遮光下、室温で30分間呈色反応を行なう。
- ターゲット細胞の種類で呈色状況が異なるため、呈色の程度に応じて呈色反応時間を調整してください。
- 全てのウェルにStop Solution 50 μl を加える。
- プレートリーダーを用いて490 nm の吸光度を測定する。
- 以下の①~③のいずれかの条件を満たすようなウェル当たりのターゲット細胞数を設定する。
① TMRとTSRの吸光度の差が CMBの値の2倍以上
( OD値TMR - OD値TSR ) ≧ 2 × OD値CMB
② TMRとTSRの吸光度の差が最大
③ TMRの吸光度(OD値TMR )が 1.0以上3.0以下
抗体溶液の調製
測定に使用する抗体を培地で任意の倍率で希釈し、10種類の濃度の抗体溶液を作成する(抗体濃度= 0を含む)。
抗体依存性細胞傷害測定(ADCC)
プレート配置例(図2)と各ウェルの液量(表1)を参照してください。
ウェルの種類
|
(Experimental Release):各濃度の抗体溶液、エフェクター細胞およびターゲット細胞混合時に放出されるLDH | |
|
(Effector Spontaneous Release):エフェクター細胞が自発的に放出するLDH | |
|
(Target Spontaneous Release):ターゲット細胞が自発的に放出するLDH | |
|
(Target Maximum Release):ターゲット細胞にLysis Bufferを加え、全ての細胞から放出されるLDH | |
|
(Culture Medium Background):培地中に含まれるLDH | |
|
(Volume Correction Control):培地中にLysis Bufferを添加した時のLDH、体積補正に用いる |
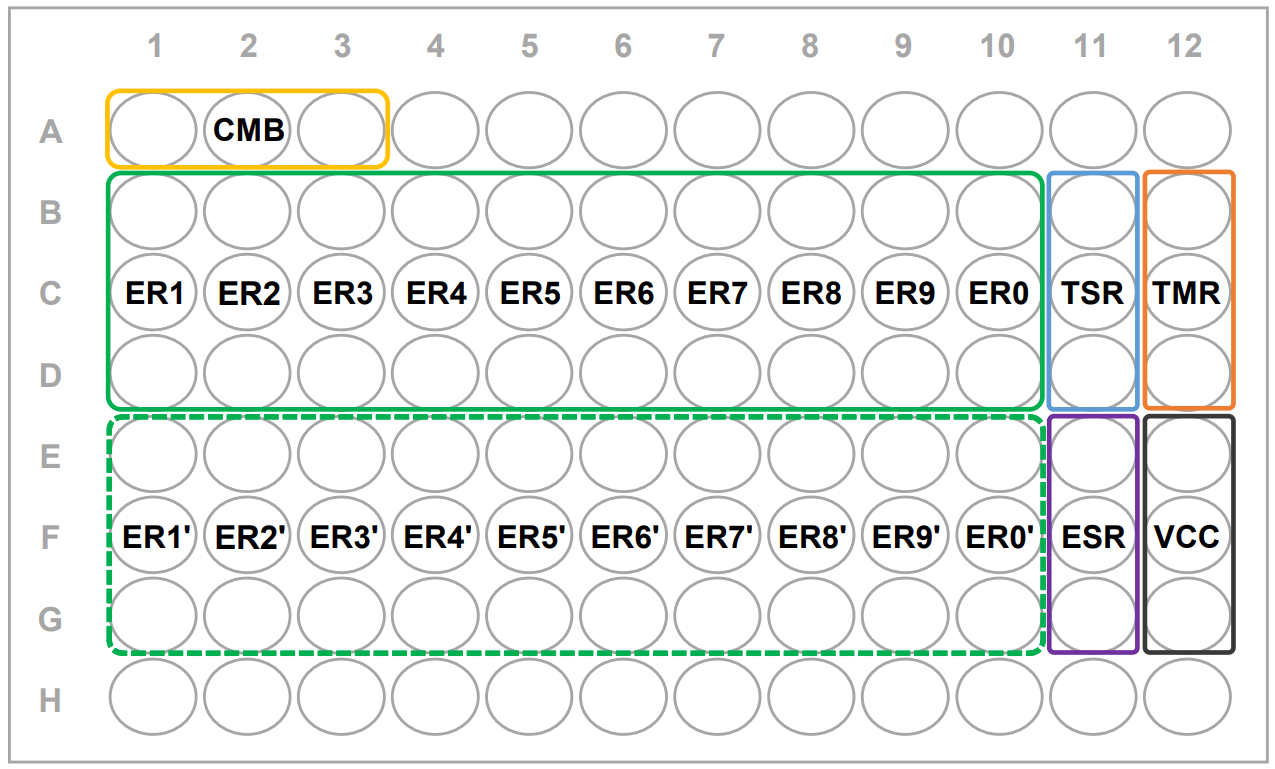
ER’のウェルは異なる種類の被検物質として使用することができます。
A及びH行にはCMB以外で使用するウェルにも培地を入れておくことをお勧めします。
図2 プレート配置例
| ER | ESR | TSR | TMR | CMB | VCC | |
| 被検物質(抗体溶液) | 25 µl | - | - | - | - | - |
| 培地 | - | 50 µl | 75 µl | 75 µl | 100 µl | 100 µl |
| エフェクター細胞懸濁液 | 50 µl | 50 µl | - | - | - | - |
| ターゲット細胞懸濁液 | 25 µl | - | 25 µl | 25 µl | - | - |
| Lysis Buffer | - | - | - | 10 µl | - | 10 µl |
測定手順
ERウェルに各希釈系列の抗体溶液を加える
↓
ER、TMR および TSRのウェルにターゲット細胞懸濁液を加える
↓
ER および ESRのウェルにエフェクター細胞懸濁液を加える
↓
ESR、TSR、TMR、CMB および VCCのウェルに培地を加える
↓
250 x g で4分間遠心する
↓
37 ℃のCO2インキュベーターで任意の時間静置する
↓
TMR および VCCのウェルにLysis Buffer を加える
↓
37 ℃のCO2インキュベーターで30分間静置する
↓
全てのウェルにWorking Solution 100 μl を加える
↓
遮光下、室温で30分間呈色反応する
↓
全てのウェルにStop Solution 50 μl を加える
↓
490 nmの吸光度を測定する
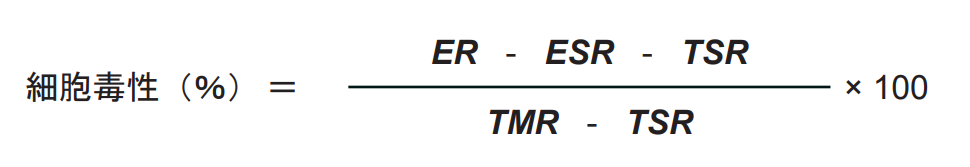
細胞傷害性の算出
- ER、ESR、TSRウェルの吸光度からCMBの吸光度の値を引く。
- TMRの吸光度からVCCの吸光度の値を引く。
- 以下の式を用いて各被検物質濃度における細胞毒性(%)を算出する。

測定例
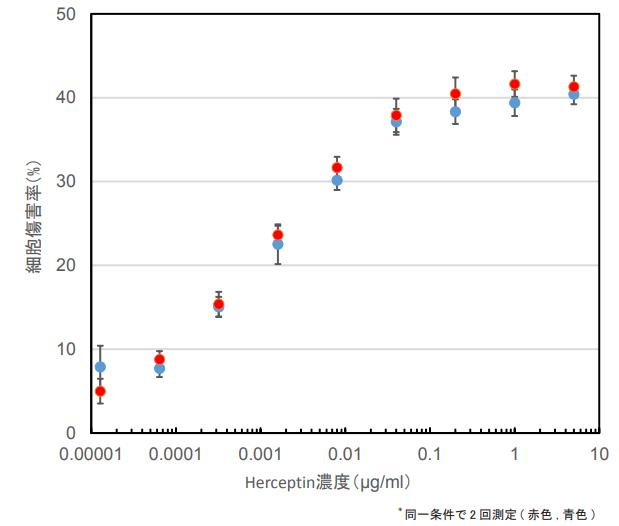
本キットを用いたHerceptinモノクロナール抗体による抗体依存性細胞傷害測定の実施例
ホモジニアス測定
| 被検物質: | Herceptin |
| ターゲット細胞(T細胞): | SK-BR-3 (1x104 cells/well) |
| エフェクター細胞(E細胞): | PBMC (1x105 cells/well) |
| 使用培地: | RPMI1640 (2% FBS, 1% Antibiotic-antimicotic) |
| E細胞およびT細胞比率: | 10:1 |
ノンホモジニアス測定
ターゲット細胞数の最適化
- ターゲット細胞を培地で洗浄後、培地を用いて5×105 cells/ml のターゲット細胞懸濁液を調製する。
- 培地100 μl を96穴マイクロプレートの各ウェルに加える。
- 96穴マイクロプレートA行のウェル(高コントロール用:TMRおよび低コントロール用:TSRの各々3ウェル)に(1)のターゲット細胞懸濁液100 μl を加え、ピペッティングで混合する(2.5×104 cells/well)。A行のウェル中の細胞懸濁液100 μl をB行のウェルに移し、2倍希釈する。この操作を繰り返して2倍希釈系列を作成する。(図3)
-
TMR (Target Maximum Release, 高コントロール):
ターゲット細胞にLysis Bufferを加えて、全ての細胞から放出されるLDH活性を測定する。TSR (Target Spontaneous Release,低コントロール):
ターゲット細胞には培地以外加えず、細胞から自発的に放出されるLDH活性を測定する。CMB (Culture Medium Background,バックグラウンドコントロール):ターゲット細胞を含まない培地中の血清成分に由来するLDH活性を測定する。
-

図3 プレート配置例
-
- 培地100 μl を全てのウェルに加える。
- 37 ℃のCO2インキュベーターで静置する。
- インキュベーション時間は実際の抗体依存性細胞傷害測定と同じ時間に合わせてください。
- 高コントロール(TMR)の各ウェルにLysis Buffer 20 μl を加える。
- 37 ℃のCO2インキュベーターで30分間静置する。
- 250 x g で4分間マイクロプレートを遠心する。
- 各ウェルから上清100 μl を注意深く取り、測定用96穴マイクロプレートに移す。
- 全てのウェルにWorking Solution 100 μl を加える。遮光下、室温で30分間呈色反応を行なう。
- ターゲット細胞の種類で呈色状況が異なるため、呈色の程度に応じて呈色反応時間を調整してください。
- 全てのウェルにStop Solution 50 μl を加える。
- プレートリーダーを用いて490 nm の吸光度を測定する。
- 以下の①~③のいずれかの条件を満たすようなウェル当たりのターゲット細胞数を設定する。
① TMRとTSRの吸光度の差が CMBの値の2倍以上
( OD値TMR - OD値TSR ) ≧ 2 × OD値CMB
② TMRとTSRの吸光度の差が最大
③ TMRの吸光度(OD値TMR )が 1.0以上3.0以下
抗体溶液の調製
測定に使用する抗体を培地で任意の倍率で希釈し、10種類の濃度の抗体溶液を作成する(抗体濃度= 0を含む)。
抗体依存性細胞傷害測定(ADCC)
プレート配置例(図4)と各ウェルの液量(表2)を参照してください。
ウェルの種類
|
(Experimental Release):各濃度の抗体溶液、エフェクター細胞およびターゲット細胞混合時に放出されるLDH | |
|
(Effector Spontaneous Release):エフェクター細胞が自発的に放出するLDH | |
|
(Target Spontaneous Release):ターゲット細胞が自発的に放出するLDH | |
|
(Target Maximum Release):ターゲット細胞にLysis Bufferを加え、全ての細胞から放出されるLDH | |
|
(Culture Medium Background):培地中に含まれるLDH | |
|
(Volume Correction Control):培地中にLysis Bufferを添加した時のLDH、体積補正に用いる |

ER’のウェルは異なる種類の被検物質として使用することができます。
A及びH行にはCMB以外で使用するウェルにも培地を入れておくことをお勧めします。
図4 プレート配置例
| ER | ESR | TSR | TMR | CMB | VCC | |
| 被検物質(抗体溶液) | 50 µl | - | - | - | - | - |
| 培地 | - | 100 µl | 150 µl | 150 µl | 200 µl | 200 µl |
| エフェクター細胞懸濁液 | 100 µl | 100 µl | - | - | - | - |
| ターゲット細胞懸濁液 | 50 µl | - | 50 µl | 50 µl | - | - |
| Lysis Buffer | - | - | - | 20 µl | - | 20 µl |
測定手順
ERウェルに各希釈系列の抗体溶液を加える
↓
ER、TMR および TSRのウェルにターゲット細胞懸濁液を加える
↓
ER および ESRのウェルにエフェクター細胞懸濁液を加える
↓
ESR、TSR、TMR、CMB および VCCのウェルに培地を加える
↓
250 x g で4分間遠心する
↓
37 ℃のCO2インキュベーターで任意の時間静置する
↓
TMR および VCCのウェルにLysis Buffer を加える
↓
37 ℃のCO2インキュベーターで30分間静置する
↓
250 x g で4分間遠心する
↓
各ウェルの上清100 μlを新しいマイクロプレートに移す
↓
全てのウェルにWorking Solution 100 μl を加える
↓
遮光下、室温で30分間呈色反応する
↓
全てのウェルにStop Solution 50 μl を加える
↓
490 nmの吸光度を測定する
細胞傷害性の算出
- ER、ESR、TSRウェルの吸光度からCMBの吸光度の値を引く。
- TMRの吸光度からVCCの吸光度の値を引く。
- 以下の式を用いて各被検物質濃度における細胞毒性(%)を算出する。


測定例
本キットを用いたHerceptinモノクロナール抗体による抗体依存性細胞傷害測定の実施例
ノンホモジニアス測定

| 被検物質: | Herceptin |
| ターゲット細胞(T細胞): | SK-BR-3 (1x104 cells/well) |
| エフェクター細胞(E細胞): | PBMC (1x105 cells/well) |
| 使用培地: | RPMI1640 (2% FBS, 1% Antibiotic-antimicotic) |
| E細胞およびT細胞比率: | 10:1 |
CK12_ADCC: Cytotoxicity LDH Assay Kit-WST
Revised Oct., 05, 2023


 を押して省略できます。
を押して省略できます。