はじめに
Cytotoxicity LDH Assay Kit-WST は、細胞から培地中に放出された乳酸脱水素酵素 (LDH) 活性を測定することにより細胞傷害を測定するキットです。LDH は細胞質に存在する酵素で、通常は細胞質に留まっていますが、細胞膜が傷害を受けると培地中に放出されます。放出された LDH は安定なため、死細胞または細胞膜に傷害を受けた細胞数を測る指標として広く測定されています。LDH は、NAD (ニコチンアミドアデニンジヌクレオチド) を補酵素として乳酸の脱水素化を触媒し、ピルビン酸と NADH を生成します。次に、生じた NADH は、電子メディエーターを介してテトラゾリウム塩 (無色) をホルマザン (橙色) に還元します。生成したホルマザンの量は、放出された LDH 活性に比例するため、傷害を受けた細胞数の指標となります。
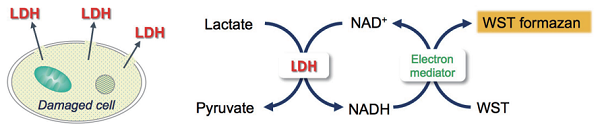
Cytotoxicity LDH Assay Kit-WST を用いた細胞毒性の測定原理
本キットは、生細胞と死細胞が混在する細胞培養液中に直接試薬を加えて細胞傷害を測定する方法 (ホモジニアスアッセイ) と培養上清を取り出して測定する方法 (ノンホモジニアスアッセイ) が可能です。また、試薬の安定性が高いため、調製した溶液は長期間保存でき、用時調製の必要がありません。
-
Homogeneous assay
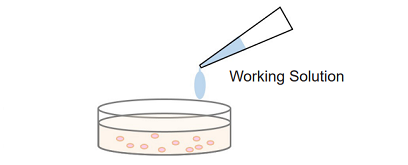
細胞培養液の入った各ウェルに直接 Working Solution を添加して発色反応および測定を行う。培養上清を測定用のプレートに移す操作は不要です。
-
Non-homogeneous assay
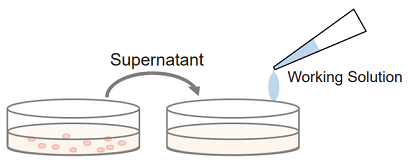
細胞培養液の上清を測定用のプレートに移して測定するため、測定に使用した細胞を生細胞測定(Cell Counting Kit-8 やMTT)や細胞染色など他の実験に使用できます。
キット内容
| 100 tests | 500 tests | 2000 tests | |
| Dye Mixture | × 1 | × 1 | × 4 |
| Assay Buffer | 11 ml × 1 | 55 ml× 1 | 55 ml× 4 |
| Lysis Buffer | 1.1 ml× 1 | 5.5 ml × 1 | 5.5 ml × 4 |
| Stop Solution | 5.5 ml× 1 | 27.5 ml × 1 | 27.5 ml × 4 |
保存条件
0~5℃にて保存してください。
必要なもの (キット以外)
- CO2 インキュベーター
- 20, 100-200 μl マルチチャンネルピペット
- プレートリーダー (490 nm の吸光フィルター)
- 細胞培養用マイクロプレート※1
- 測定用マイクロプレート (ノンホモジニアスアッセイのみ)※2
- 浮遊細胞を用いてノンホモジニアスアッセイを行う場合、丸底または V 底プレートを使用してください。
- ノンホモジニアスアッセイの場合、培養上清を使用するために必要です。
使用上のご注意
- 本キットにはガラス製容器およびアルミ製シールキャップを使用しております。取扱いに際しては、保護手袋などを着用いただくなど、ご注意ください。
- 細胞種毎で細胞内の LDH 量は異なります。初めて測定を行う際は、予備実験にて最適な細胞数をご確認ください。
予備実験について
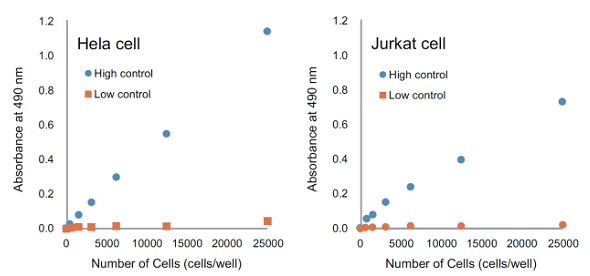
細胞内の LDH 量は細胞の種類によって異なるため、信頼性のある結果を得るために細胞毒性試験を行う前にウェル当りの最適な細胞数を決めてください。
| 予備実験 |
| 「初めて本品を使用する場合」や「細胞種を変えて測定する場合」は予備実験を行ってください。 細胞数を変えて「高コントロール」「低コントロール」「バックグラウンドコントロール」の吸光度を測定し、 下図の条件を参考に細胞毒性試験で使用するウェル当りの細胞数を決定します。
予備実験の手順は
|
| 細胞毒性試験 |
|
予備実験で最適化したウェル当りの細胞数を用いて細胞毒性試験を行います。
|
溶液調製
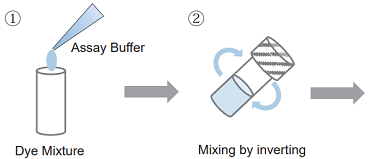
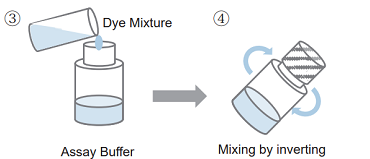
- 適量の Assay Buffer を Dye Mixture に加える。
100 tests : 1 ml の Assay Buffer を加える。 500 tests /2000 tests : 5 ml の Assay Buffer を加える。 - 転倒混和により内容物を混合する。
- 操作 2) で調製した溶液全量を Assay Buffer のボトルに移す。
- 転倒混和により内容物を混合する。
- Working Solution 調製後は遮光下、0~5 ℃で保存してください (6 ヶ月間安定)。
予備実験 - ホモジニアスアッセイ -
予備実験手順 - ホモジニアスアッセイ -
- 細胞を培地で洗浄し、培地を用いて 5×105 cells/ml の細胞懸濁液を調製する。
- 培地 100 μl を 96 穴マイクロプレートの各ウェルに加える。
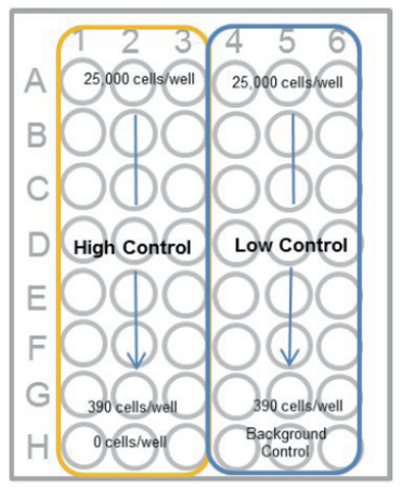
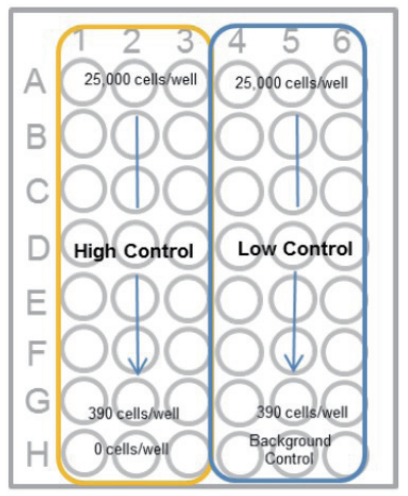
- マルチチャンネルピペットを用いて 2 倍希釈系列を調製する(下図)。 高コントロール、低コントロール及びバックグランドコントロール (培地のみ) を各々 3 ウェルずつ準備する。
-
<段階希釈の方法>
1. で調製した 5×105 cells/ml の細胞懸濁液 100 μl を細胞数が最大 となるウェルに加えてピペッティングする。その後、細胞数が半分 となった細胞懸濁液 100 μl を次のウェルに移して、同様にピペッ ティングにて混合する。以降、この操作を繰り返す。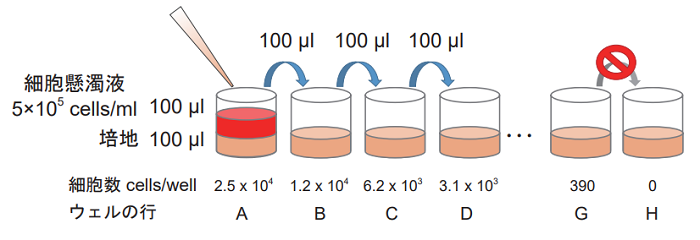
-
- 37 ℃の CO2 インキュベーターでインキュベーションする。
- インキュベーションは実際の細胞毒性試験と同じ時間に合わせる。
- 高コントロール用のウェルに Lysis Buffer 10 μl を加える。
- Lysis Buffer の添加量が少ないため、ウェルの側壁にチップの先端を当てて加えると良い。また、Lysis Buffer がウェル側壁に付着したままの場合は、プレート側面を軽く叩いて Lysis Buffer と培地を混合する。
- 37 ℃、30 分間 CO2 インキュベーター内でインキュベーションする。
- 全てのウェルに Working Solution 100 μl を加える。遮光下、室温で 30 分間呈色反応を行う。
- 全てのウェルに Stop Solution 50 μl を加える。
- プレートリーダーを用いて 490 nm の吸光度を測定する。
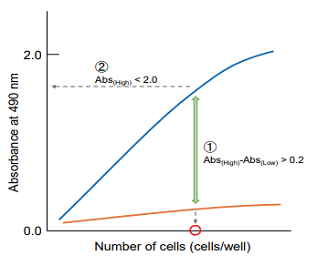
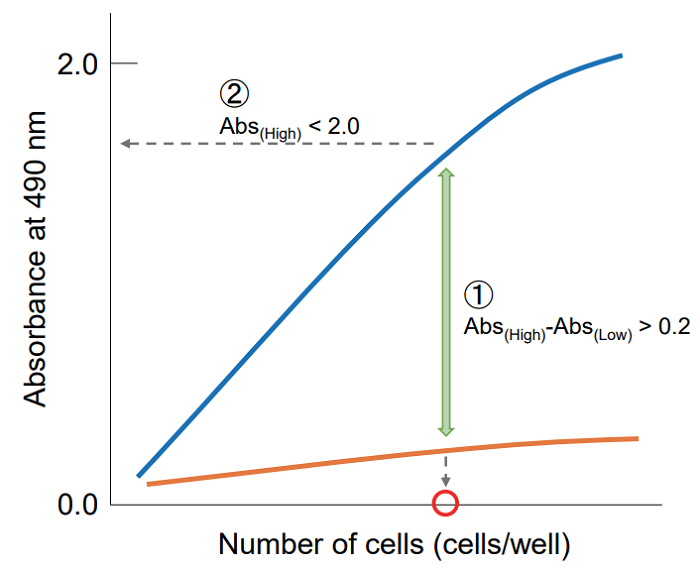
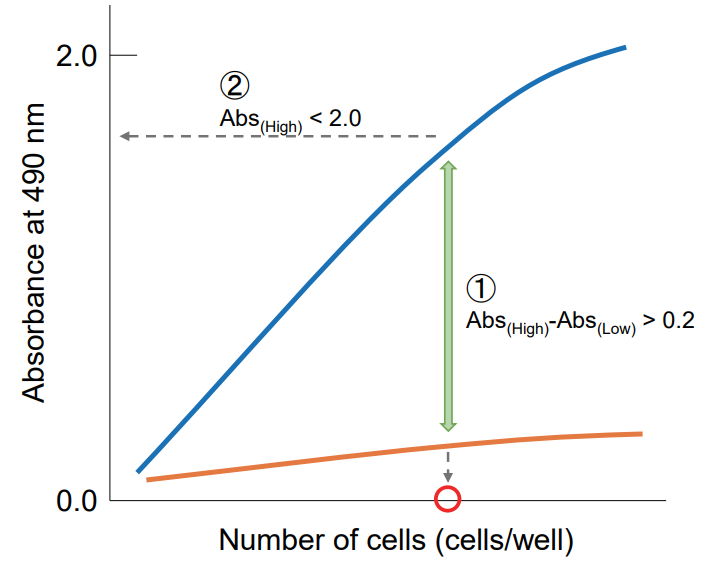
吸光度を縦軸、細胞数を横軸にプロットして、下記の点を考慮し最適なウェル当りの細胞数を決定する。
① 高コントロールと低コントロールの吸光度差が 0.2 以上となる細胞数を選択する。
② 細胞数と吸光度でプロットし直線性があり、吸光度が 2.0 以下の細胞数を選択する。
細胞毒性試験 - ホモジニアスアッセイ -
細胞毒性試験手順 - ホモジニアスアッセイ -
- 平底 96 穴マイクロプレートに培地で調製した細胞懸濁液 50 μl を加える(下表)。
- 細胞懸濁液 50 μl 中に含まれる細胞数が予備実験で決定したウェル当りの細胞数になるように調製する。
- 付着細胞の場合、細胞を一晩インキュベーションして、新しい培地 50 μl に交換した後に操作 2. へ進む。(一晩インキュベーションすることでウェル当りの細胞数が増える場合があります)。
- 実験サンプルのウェル以外の各ウェルに培地を加える (下表)。
- 予め培地で目的の濃度に調製した被験物質溶液 50 μl を実験サンプルのウェルに加える (下表)。
- 予め、被験物質溶液を培地で目的の濃度に調製しておく。
表 各ウェルの溶液量 (ホモジニアスアッセイ) 実験サンプル 高コントロール 低コントロール バックグラウンドコントロール 培地 - 50 μl 50 μl 100 μl 細胞懸濁液 50 μl 50 μl 50 μl - 被験物質 50 μl - - - Lysis Buffer - 10 μl - - - 高コントロールの液量が実験サンプルおよび他のコントロール液の液量よりも 10% 多いが、測定値には影響を与えないため体積を補正する必要はありません。
実験サンプル :被験物質を細胞に加えたことで細胞から放出される LDH 活性 高コントロール :細胞中の全 LDH 活性(放出される LDH 活性の最大値) 低コントロール :被験物質で処理しない細胞から自然に放出される LDH 活性 バックグラウンドコントロール :培地中に含まれる LDH 活性 - 37 ℃で適切な時間 CO2 インキュベーター内でインキュベーションする。
- 被験物質の暴露時間は被験物質や細胞の種類など実験条件に依存するため、最適化の検討をお勧めする。
- 高コントロールウェルに Lysis Buffer 10 μl を加える。
- Lysis Buffer の添加量が少ないため、ウェルの側壁にチップの先端を当てて加えると良い。また、Lysis Buffer がウェル側壁に付着したままの場合は、プレート側面を軽く叩いて Lysis Buffer と培地を混合する。
- 37℃、30 分間 CO2 インキュベーター内でインキュベーションする。
- 各ウェルに Working Solution 100 μl を加える。遮光下、室温で 30 分間呈色反応を行う。
- 全てのウェルに Stop Solution 50 μl を加える。
- プレートリーダーを用いて 490 nm の吸光度を測定する。
【細胞傷害性の算出】
- 「実験サンプル」「高コントロール」「低コントロール」の各吸光度から「バックグラウンドコントロール」 の吸光度を差し引く(吸光度は三重測定の平均値)。
- 各吸光度の値を用いて下式により細胞傷害性を算出する。
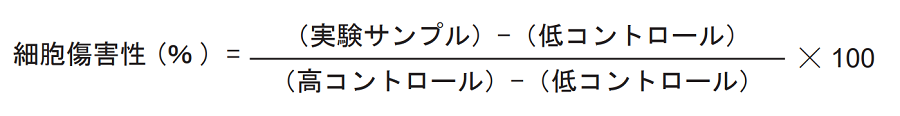
予備実験 - ノンモジホニアスアッセイ -
予備実験手順 -ノンホモジニアスアッセイ-
- 細胞を培地で洗浄し、培地を用いて 5×105 cells/ml の細胞懸濁液を調製する。
- 培地 100 μl を 96 穴マイクロプレートの各ウェルに加える。
- マルチチャンネルピペットを用いて 2 倍希釈系列を調製する(下図)。 高コントロール、低コントロール及びバックグランドコントロール (培地のみ) を各々 3 ウェルずつ準備する。
-
<段階希釈の方法>
1. で調製した 5×105 cells/ml の細胞懸濁液 100 μl を細胞数が最大 となるウェルに加えてピペッティングする。
その後、細胞数が半分 となった細胞懸濁液 100 μl を次のウェルに移して、同様にピペッ ティングにて混合する。
以降、この操作を繰り返す。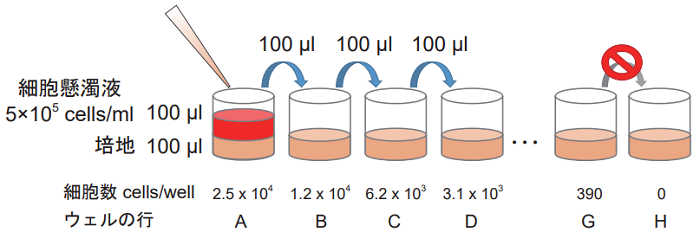
-
- 全てのウェルに培地 100 μl を加える。
- 37 ℃の CO2 インキュベーターでインキュベーションする。
- インキュベーションは実際の細胞毒性試験と同じ時間に合わせる。
- 高コントロール用のウェルに Lysis Buffer 20 μl を加える。
- Lysis Buffer の添加量が少ないため、ウェルの側壁にチップの先端を当てて加えると良い。また、Lysis Buffer がウェル側壁に付着したままの場合は、プレート側面を軽く叩いて Lysis Buffer と培地を混合する。
- 37 ℃、30 分間 CO2 インキュベーター内でインキュベーションする。
- ( 浮遊細胞の場合 ) マイクロプレートを遠心する(250 x g、2 分間)。
- 付着細胞の場合は遠心操作は不要です。
- 各ウェルから上清 100 μl を注意深く取り、測定用の 96 穴マイクロプレートに移す。
- 全てのウェルに Working Solution 100 μl を加える。遮光下、室温で 30 分間呈色反応を行う。
- 全てのウェルに Stop Solution 50 μl を加える。
- プレートリーダーを用いて 490 nm の吸光度を測定する。
吸光度を縦軸、細胞数を横軸にプロットして、下記の点を考慮し最適なウェル当りの細胞数を決定する。
① 高コントロールと低コントロールの吸光度差が 0.2 以上となる細胞数を選択する。
② 細胞数と吸光度でプロットし直線性があり、吸光度が 2.0 以下の細胞数を選択する。
細胞毒性試験 - ノンモジホニアスアッセイ -
細胞毒性試験手順 - ノンモジホニアスアッセイ -
- 96 穴マイクロプレートに培地で調製した細胞懸濁液 100 μl を加える(下表)。
- 細胞懸濁液 100 μl 中に含まれる細胞数が予備実験で決定したウェル当りの細胞数になるように調製する。
- 付着細胞の場合、細胞を一晩インキュベーションして、新しい培地 100 μl に交換した後に操作 2. へ進む。 (一晩インキュベーションすることでウェル当りの細胞数が増える場合があります)。
- 各ウェルに培地を加える(下表)。
- 予め培地で目的の濃度に調製した被験物質溶液 100 μl を実験サンプルのウェルに加える(下表)。
- 予め、被験物質溶液を培地で目的の濃度に調製しておく。
表 各ウェルの溶液量(ノンホモジニアスアッセイ) 実験サンプル 高コントロール 低コントロール バックグラウンドコントロール 培地 20 μl 100 μl 120 μl 220 μl 細胞懸濁液 100 μl 100 μl 100 μl - 被験物質 100 μl - - - Lysis Buffer - 20 μl - - 実験サンプル :被験物質を細胞に加えたことで細胞から放出される LDH 活性 高コントロール :細胞中の全 LDH 活性(放出される LDH 活性の最大値) 低コントロール :被験物質で処理しない細胞から自然に放出される LDH 活性 バックグラウンドコントロール :培地中に含まれる LDH 活性 - 37 ℃で適切な時間 CO2 インキュベーター内でインキュベーションする。
- 被験物質の暴露時間は被験物質や細胞の種類など実験条件に依存するため、最適化の検討をお勧めする。
- 高コントロールウェルに Lysis Buffer 20 μl を加える。
- Lysis Buffer の添加量が少ないため、ウェルの側壁にチップの先端を当てて加えると良い。また、Lysis Buffer がウェル側壁に付着したままの場合は、プレート側面を軽く叩いて Lysis Buffer と培地を混合する。
- 37℃、30 分間 CO2 インキュベーター内でインキュベーションする。
- ( 浮遊細胞の場合 ) マイクロプレートを遠心する(250 x g、2 分間)。
- 付着細胞の場合は遠心操作は不要です。
- 各ウェルから上清 100 μl を注意深く取り、測定用の 96 穴マイクロプレートに移す。
- 各ウェルに Working Solution 100 μl を加える。遮光下、室温で 30 分間呈色反応を行う。
- 全てのウェルに Stop Solution 50 μl を加える。
- プレートリーダーを用いて 490 nm の吸光度を測定する。
【細胞傷害性の算出】
- 実験サンプル」「高コントロール」「低コントロール」の各吸光度から「バックグラウンドコントロール」 の吸光度を差し引く(吸光度は三重測定の平均値)。
- 各吸光度の値を用いて下式により細胞傷害性を算出する。
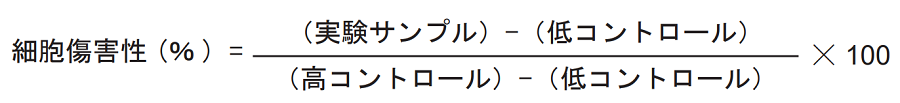
トラブルシューティング
| トラブル | 考えられる原因 | 解決方法 |
| 測定値にバラツキが多い。 | 培地の表面に気泡がある。 | シリンジや注射針などの先端で気泡を除去する。プレート用の遠心機がある場合は、1,000 x g で 1 分間遠心する。 |
| 培地の水分蒸発により試薬濃度 が変わっている。 | 一番外側のウェルは水分蒸発が起こりやすいため、測定には利用せずに培地のみを入れる。 | |
| 試薬溶液が培地と混合していない。 | プレートの側面を指で軽く叩き、ウェルの内壁に付着している試薬溶液を培地中に落とす。プ レートを叩く際は、ウェル中の培地が飛び出さない程度に行う。 | |
| 正確な量の試薬が添加されてい ない。 | 使用するピペットを補正する。 | |
| シングルピペットを使用したこ とで、ウェル間でインキュベー ション時間に差が生じている。 | Working Solution および Stop Solution を添加する際は、特にマルチチャンネルピペットの使用をお勧めする。 | |
| バックグラウンドが高い。 | 培地中の LDH 濃度が高い。 | 血清不含または血清濃度 5% 以下の培地を使用する。 |
| 被験物質または培地の成分に還元性物質が含まれている。 | アスコルビン酸などの還元性物質は、発色試薬 WST と反応するため使用できない。なお、 DMEM、RPMI、F-12 培地については還元性物質が含まれていないため使用できる。 | |
| 吸光度の値が低い。 | 被験物質または培地の成分に LDH 活性を阻害する物質が含 まれている。 | 下記「吸光度測定に影響を与える物質について」を参照。 |
<吸光度測定に影響を与える物質について>
- 還元性を有する物質
被験物質にアスコルビン酸などの還元性を有する物質が含まれる場合、WST が反応してバックグラウンドが 高くなるため、事前に培地で調製した被験物質溶液に Working Solution を添加して吸光度を確認してください。 発色が起こる場合は、細胞傷害性を算出する際に試薬ブランクとして各吸光度から差し引いてください。 - LDH を含む血清
血清を含む培地を使用する場合、バックグラウンドが高くなります。細胞傷害性を算出する際にバックグラウ ンドコントロールとして各吸光度から差し引いてください。バックグラウンドが高い場合は、無血清培地また は血清濃度 5% 以下の培地を使用してください。 - LDH 活性の阻害剤
培地中にピルビン酸が高濃度で含まれている場合、測定が阻害されます。高コントロールの吸光度が低い場合 (低コントロールと同程度) の場合は、培地中にピルビン酸が含まれていないかご確認ください。
よくある質問/参考文献
CK12: Cytotoxicity LDH Assay Kit-WST
Revised Sep., 01, 2023


 を押して省略できます。
を押して省略できます。