はじめに
Cell Counting Kit-F (CCK-F) はCalcein-AM (3’,6’-Di(O-acetyl)-4’,5’-bis[N,N-bis(carboxymethyl) aminomethyl] fluorescein, tetraacetoxymethyl ester ) を用いた、簡単で高感度な細胞増殖、細胞毒性測定キットです。
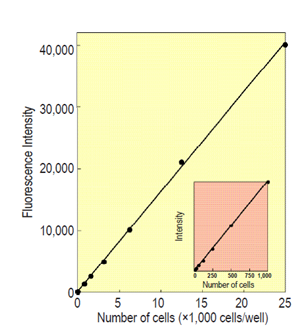
Calcein-AMは生細胞に取り込まれ、細胞内エステラーゼにより酵素的に加水分解されて、Calceinとなり強い黄緑色蛍光(λex=490 nm, λem=515 nm)を発します。生じたCalceinの蛍光値は生細胞数に比例します(図1)。
また、CCK-Fは[3H]-チミジン取り込み法のようなラジオアイソトープや、MTT法のような細胞溶解操作を必要とせず、使用する上で特別な手技もいりません。そのため、再現性の良い正確な結果を得ることができます。
|
使用細胞: HL60 |
図1 細胞数と蛍光強度の関係
キット内容
- Calcein-AM DMSO solution 110 μl×1
キット以外に必要なもの
- 蛍光マイクロプレートリーダー
励起フィルター:480〜500 nm、蛍光フィルター:500〜535 nm - 蛍光測定用(ブラック、又はホワイト)96-wellマイクロプレート
保存
-20℃で保存して下さい。ご購入後、未開封で6ヶ月安定です。
残った溶液はキャップをしっかりと締め、-20℃で保存して下さい。
溶液調製
所要量のCalcein-AM DMSO solutionをPBS(-)で50倍に希釈し、CCK-F希釈溶液を調製する。希釈は使用直前に行い、希釈後は直ぐに使用する。
細胞毒性試験
- 細胞を50,000 cells/mlとなるように計数し、96-wellマイクロタイタープレートの各ウェルに100 μlずつ播種する(5,000 cells/well)。
- 炭酸ガスインキュベーター内で24時間前培養する。
- 目的の濃度に調製した被験物質を各ウェルに10 μlずつ添加する。
- 炭酸ガスインキュベーター内で48時間培養する。
- 細胞を剥がさぬように培地のみを吸引除去する。(浮遊細胞の場合はマイクロプレート用遠心分離機を使用して細胞を沈殿させ、培地を除去する。)
- 各ウェルにPBS(-) を100 μlずつ加え、先と同様に吸引除去して細胞を洗浄し、再度PBS(-)を100 μlずつ加える。
- CCK-F希釈溶液を各ウェルに10 μlずつ添加する。
- 室温で15分〜30分発色させる。
- 蛍光プレートリーダーで蛍光を測定する。(λex=490 nm, λem=515 nm付近)
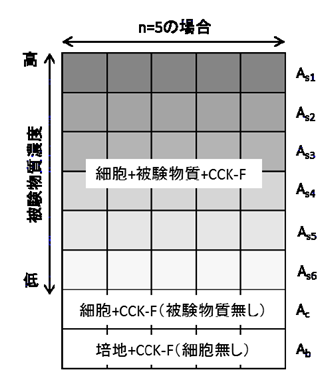
図2 プレートレイアウト例
IC50の求め方
下記式により細胞生存率を算出する。被験物質濃度に対して細胞生存率をプロットし、生存率が50%となる薬剤濃度をIC50とする。
細胞生存率(%) = [(As-Ab)/(Ac-Ab)]×100
As:サンプルの蛍光強度(細胞+被験物質+ CCK-F希釈溶液)
Ac:陰性対照の蛍光強度(細胞+ CCK-F希釈溶液、被験物質無し)
Ab:ブランク蛍光強度(培地+ CCK-F希釈溶液、細胞無し)
HL60細胞を用いて、Mytomycin C (MMC)とSodium dodecylsulfate (SDS)の細胞毒性試験を行った例を図3に示す。
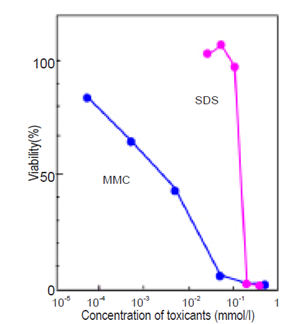
| 使用細胞: HL60 使用薬剤: Mitomycin C (MMC), Sodium dodecylsulfate(SDS) 薬剤処理: 37℃, 5% CO2 , 48 時間 呈色反応: 30 分 Dtection: λex=485 nm, λem=535 nm |
図3 細胞毒性試験
注意事項
- 培地中のフェノールレッドと血清は測定を妨害しますで、CCK-F希釈溶液を加える前にPBS(-)や、血清やフェノールレッドを含まない培地に置換してください。
- 被験物質は培地やPBS(-)、生理食塩水など細胞にダメージを与えない溶液で溶解、希釈してください。陰性対照とブランクのウェルには、被験物質の代わりに被験物質溶解に用いた溶液を加えてください。
- 24-wellや6-wellのプレートを用いる場合、緩衝液(培地)の1/10量のCCK-F希釈溶液を各ウェル添加してください。
よくある質問/参考文献
CK06: Cell Counting Kit-F
Revised Dec., 13, 2023


 を押して省略できます。
を押して省略できます。

