はじめに
Cell Counting Kit-8 (CCK-8) は水溶性テトラゾリウム塩WST-8( 図1) を発色試薬として用いた生細胞数測定キットです。WST-8 は還元されると460 nm 付近に極大吸収を持つ水溶性ホルマザンを生じます(図2)。
CCK-8 は1 液タイプであり、事前の溶液調製は必要ありません。また、細胞増殖/ 細胞毒性測定において放射性同位体を使用することなく、吸光測定により高感度な生細胞数測定が可能です。
細胞中の脱水素酵素により産生されるNADH は、1-Methoxy PMS を介してWST-8 を橙色のホルマザンに還元します( 図2)。このホルマザン色素の量は生細胞数に比例します。
CCK-8 を用いた細胞増殖アッセイは、MTT アッセイや[3H] - チミジン取込み法と良く相関しており、代替法として使用することができます。
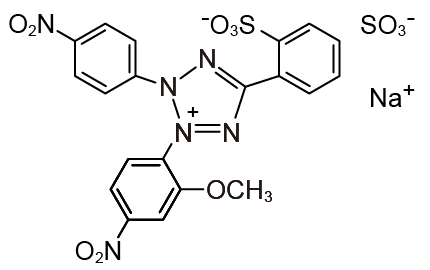
図1 WST-8 の構造式
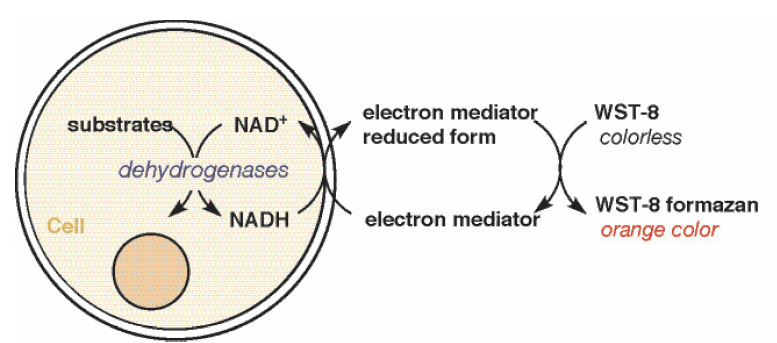
図2 測定原理
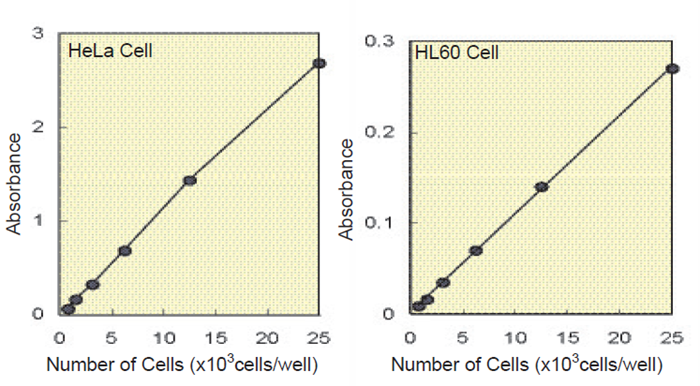
図3 細胞数と吸光度の関係
| Medium : | HeLa : | MEM, 10% FBS |
| HL60 : | RPMI1640, 10% FBS | |
| Incubation : | HeLa : | 37°C, 5% CO2, 2 hours |
| HL60: | 37°C, 5% CO2, 3 hours | |
| Detection : | 450 nm | |
キット内容
| 100 回用: | 1 ml x 1 |
| 500 回用: | 5 ml x 1 |
| 2500 回用: | 5 ml x 5 |
| 5000 回用: | 5 ml x 10 |
| 10000 回用: | 100 ml x 1 |
保存条件
CCK-8 は遮光下、4°C で1 年間安定です。長期間保存する場合は、遮光し-20 ℃ で保存して下さい。凍結融解を繰り返すとアッセイ時にバックグランドが上昇することがあります。
頻繁に使用する場合は、凍結は避け、冷蔵で保存して下さい。
キット以外に必要なもの
- プレートリーダー (450 nm の吸光フィルター)
- 96 穴マイクロプレート
- CO2 インキュベーター
- 10 μl および100 - 200 μl マルチチャンネルピペット
プロトコール (96 穴プレート)
細胞増殖および細胞毒性試験
- 対数増殖期にある細胞を5000 cells/well となるよう計数する。96 穴マイクロプレートの各ウェルに100 μl ずつ播種し、CO2 インキュベーター内で前培養する。(写真① , ②)
- 目的の濃度に調整した薬剤を各ウェルに10 μl ずつ添加し、CO2 インキュベーター内で一定時間(6, 12, 24, 48 時間) 培養する。(写真③ , ④)
- 培養時間は、使用する薬剤の性質に依存します。
- CCK-8 溶液を各ウェルに10 μl ずつ添加する。(写真⑤)
- 気泡は測定値のバラツキの原因となりますので、気泡を生じないよう添加して下さい。
- CO2 インキュベーター内で1 - 4 時間呈色反応を行う。(写真⑥)
- 発色量は細胞種により異なります。発色の程度によりインキュベーション時間を調節して下さい。
- マイクロプレートリーダーで450 nm の吸光度を測定する。(写真⑦)
- 時間を置いて測定する場合には、反応停止液10 μl を各ウェルに加え、蓋をして冷暗所に保存してください。24 時間以内では吸光度変化はほとんど観測されません。反応停止液としては、0.1 mol/l HCl や1 w/v% SDS を用いることができます。
-

① 細胞懸濁液を各ウェルに100 μl ずつ添加する。
② 37℃のCO2 インキュベーター内で前培養する。
-

③薬剤を各ウェルに10 μl ずつ添加する。
④ 37℃のCO2 インキュベーター内で一定時間培養する。
-
⑤ CCK-8 を各ウェルに10 μl ずつ添加する。
⑥ 37℃のCO2 インキュベーター内で1-4 時間培養する。
-
⑦ 450 nm の吸光度を測定する。
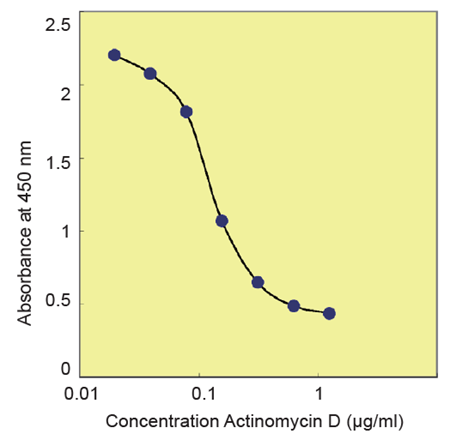
図4 細胞毒性試験(Actinomycin D)-
Cell line : HeLa
Culture medium : DMEM, 10% FBS
Drug : Actinomycin D
Exposure : 24 hours
Incubation : 37℃ , 5% CO2, 4 hours
Detection : 450 nm
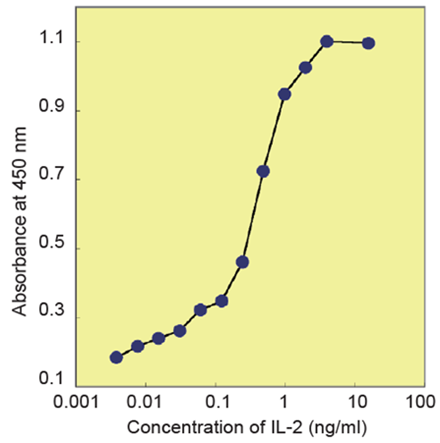
図5 細胞増殖試験(IL-2)-
Cell line : CTLL-2
Culture medium : RPMI1640, 10% FBS
Drug :Human Interleukin-2
Exposure : 72 hours
Incubation : 37℃ , 5% CO2, 4 hours
Detection : 450 nm
-
Cell line : HeLa
Culture medium : MEM, 10% FBS
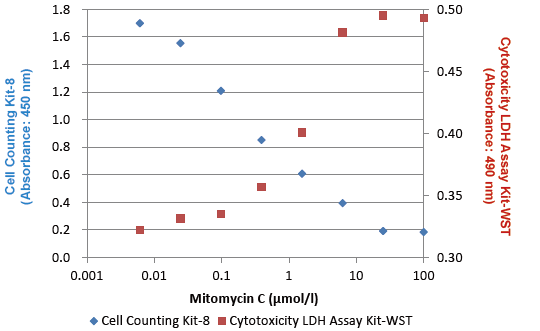
Drug : Mitomycin C
Exposure : 37℃ , 5% CO2, 48 hours
Detection :
Cell Counting Kit-8 (450 nm)
Cytotoxicity LDH Assay Kit-WST (490 nm)
図6 Cell Counting Kit-8 とCytotoxicity LDH Assay Kit-WST [Code: CK12] を併用した細胞毒性試験
使用上の注意
- 本アッセイは生細胞内の脱水素酵素活性に基づいていますので、脱水素酵素活性に影響を及ぼす薬剤の存在や細胞の状態によっては、本キットで求めた生細胞数と顕微鏡観察した細胞数に差が見られることがあります。
- 還元剤が存在するとWST-8 が還元され、バックグラウンドが上昇することがあります。還元能のある薬剤を細胞増殖・毒性試験に用いる場合は、薬剤自身による発色の有無を確認してください。
- 気泡は測定値のバラツキの原因となりますので、ご注意ください。
- 本キットの滅菌が必要な場合は、0.2 μm メンブレンフィルターを用いてろ過して下さい。
- 発色に要する時間は細胞種や細胞数に依存します。一般的に、浮遊系細胞による発色は付着性細胞よりも弱く、浮遊系細胞の場合は、長時間のインキュベーションと、より多くの細胞が必要です。
- 使用する細胞数が多いことにより細胞懸濁液の濁りが強い場合は、600 - 650 nm を参照波長として測定してください。
FAQ
1. アッセイに必要な細胞数はどのくらいですか?
96 穴プレートでアッセイする場合、1 ウェル当たり少なくとも付着性細胞で1000 cells、浮遊系細胞では 2500 cells が必要です。1 ウェル当たりの最大細胞数は96 穴プレートで25000 cells を推奨します。24 穴や6 穴プレートをご使用の際は、96 穴プレートの場合のそれぞれ4 倍、16 倍を目安に細胞数を調整し、培地の1/10 容量のCCK-8 溶液を添加して下さい。
2. CCK-8 は細胞を染色しますか?
いいえ。WST-8 、及びWST-8 ホルマザンは細胞膜を透過しないため、細胞は染色されません。
3. フェノールレッドはアッセイに影響を与えますか?
いいえ。培地中のフェノールレッドの吸収の影響は、それぞれのウェルの吸光度からブランクの吸光度を差し引くことで除くことができます。そのため、フェノールレッド含有培地でもご使用できます。
4. CCK-8 は細胞毒性がありますか?
アッセイ時の濃度での細胞毒性はほとんどありません。そのため、本アッセイを行った後に、ニュートラルレッドやクリスタルバイオレットなどの他の細胞増殖アッセイを行うことも可能です。
5. 450 nm 以外のフィルターは使用できますか。
430 - 490 nm のフィルターが使用可能ですが、450 nm のフィルターをご使用いただきますと最も高感度に
測定できます。
参考文献
- M. Ishiyama, Y. Miyazono, K. Sasamoto, Y. Ohkura and K. Ueno, Talanta, 1997, 44, 1299.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki and M. Watanabe, Anal. Commun.,1999, 36, 47.
よくある質問/参考文献
CK04: Cell Counting Kit-8
Revised Dec., 11, 2023


 を押して省略できます。
を押して省略できます。