はじめに
銅は、生体内に微量しか存在しないにも関わらず、呼吸・代謝といった生命現象を司る酵素の活性中心として機能する遷移金属として知られています。具体的には、ヘモグロビン合成のための鉄の運搬を補助することで鉄代謝を活発にしたり、superoxide dismutase1 (SOD1)と結合することで活性酸素の除去を行います。このように、銅は我々の生命維持に重要な役割を果たしています。
また、細胞死に関する研究においても近年、銅が注目されています。比較的新しい経路の細胞死として、鉄 (Ⅱ)イオンが起点となるFerroptosisに関する研究が盛んに行われていますが、Ferroptosisとは異なった経路の銅 (Ⅰ)イオンが起点となる新しい細胞死 (Cuproptosis)も発見されています1)。
CuprosGreenは細胞内の銅 (Ⅰ)イオンと選択的に反応して蛍光を発する蛍光プローブです。細胞膜透過性を有しているため、銅 (Ⅰ)イオンのライブセルイメージングが可能です。
内容
CuprosGreen 20 μl×1
保存条件
-20℃にて保存してください。
必要なもの
- 蛍光検出器 (蛍光顕微鏡もしくは蛍光プレートリーダー)
- インキュベーター (37℃)
- マイクロピペット (100–1000 µl, 20–200 µl, 0.5–10 µl)
- コニカルチューブ
- 培地またはHBSS (Hanks' balanced salt solution)
- Dimethyl sulfoxide (DMSO)
使用上のご注意
- 試薬は使用前に室温に戻して融解してからご使用下さい。
- 輸送中の振動等により、内容物がスクリューキャップマイクロチューブ壁面やキャップ裏面に付着している場合がありますので、開封前に内容物を底面に落としてからご使用ください。
- 検出器毎の推奨測定波長は表1を参照してください。
| 検出器 | 蛍光顕微鏡 | 蛍光プレートリーダー |
| 測定波長 |
・共焦点レーザー顕微鏡 Ex/Em: 488/500–600 nm ・落射型顕微鏡 GFP フィルター |
Excitation: 430–480 nm Emission: 510–560 nm |
表1 検出器別の推奨測定波長
溶液調製
CuprosGreen 5 μmol/l working solutionの調製
- CuprosGreenをマイクロピペットを用いてマイクロチューブに量り取る。
- 操作1.で量り取った1.5倍量のDMSOをマイクロチューブに量り取り、ピペッティングにより混和する。
- 操作1.で量り取った500倍量の無血清培地をマイクロチューブに量り取り、ピペッティングにより混和し、ボルテックスをかける。
- Working solutionの調製には無血清培地をご使用ください。Working solution中に血清が含まれると色素の検出感度が低くなります。
- Working solutionは保存できません。調製したその日の内にご使用ください。
- 容器別のworking solution量は表2を参考にして下さい。
例) CuprosGreen working solution 1 mlの調製方法
1. CuprosGreen 2 μlをマイクロピペットを用いてマイクロチューブに量り取る。
2. DMSO 3 μlをマイクロピペットを用いてマイクロチューブに量り取り、ピペッティングにより混和する。
3. 無血清培地1000 μlをマイクロピペットを用いてマイクロチューブに量り取り、ピペティングにより混和し、ボルテックスをかける。
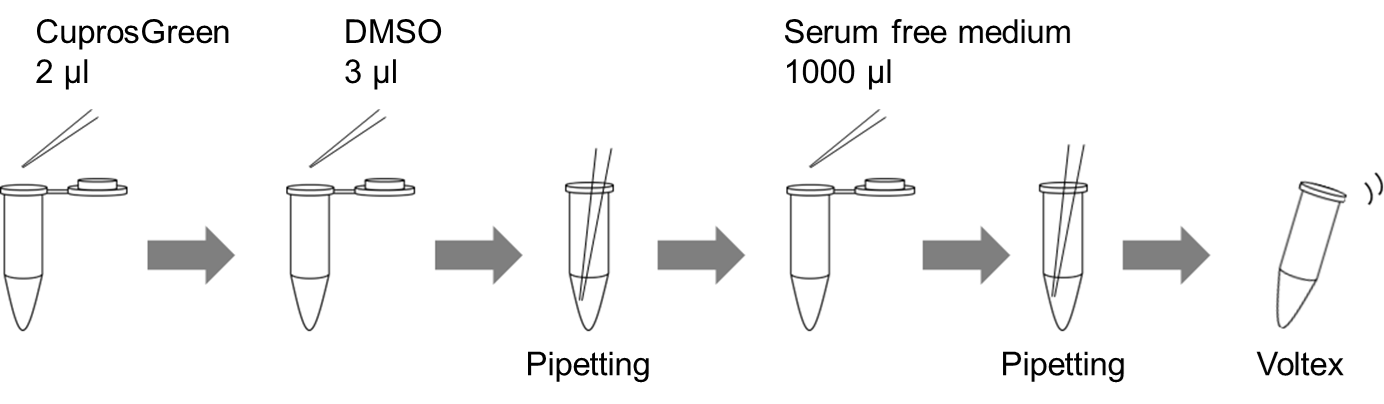
図1 CuprosGreen working solutionの調製方法
| 容器 | 35-mm dish | ibidi 8-well plate | 96-well black plate (clear bottom) |
| 必要量 | 2 ml | 200 μl/well | 100 μl/well |
表2 容器別working solutionの推奨使用量
操作
- 細胞をディッシュに播種し、5% CO2存在下、37℃で培養一晩する。
- 培地を取り除き、培地を用いて1回洗浄する。
- 上清除去後、薬剤等で処理する。
- 上清を吸引除去し、無血清培地で細胞を2回洗浄後する。
- 5 μmol/l CuprosGreen working solutionを添加し、5% CO2インキュベーター内に37℃で3時間インキュベートとする。
- 蛍光顕微鏡にて細胞を観察または、蛍光プレートリーダーで測定する。
- 洗浄せずに観察を行ってください。
実験例
塩化銅を取り込ませたHeLa細胞の細胞内銅検出
- 96-well Black plate (1×104 cells/well)と6-well plate (3×104 cells/well)にHeLa細胞を播種し、インキュベーター内 (37℃、 5% CO2存在下)で一晩培養した。
- 培地を取り除きMEM培地を用いて細胞を洗浄した。
- 上清除去後、200 µmol/lのCuCl2/MEM培地 (10% fetal bovine serum,1% penicillin-streptomycin)を加えインキュベーター内 (37℃、 5% CO2存在下)で16時間インキュベートした。
- 上清を吸引除去し、200 μmol/l EDTA-2Na/PBS溶液を用いて細胞を2回洗浄し、細胞外の銅を除去した。
- 上清を吸引除去し、5 μmol/l CuprosGreen working solutionを加えインキュベーター内 (37℃、 5% CO2存在下)で3時間インキュベートした。
- 共焦点レーザー顕微鏡と蛍光プレートリーダーで検出した。
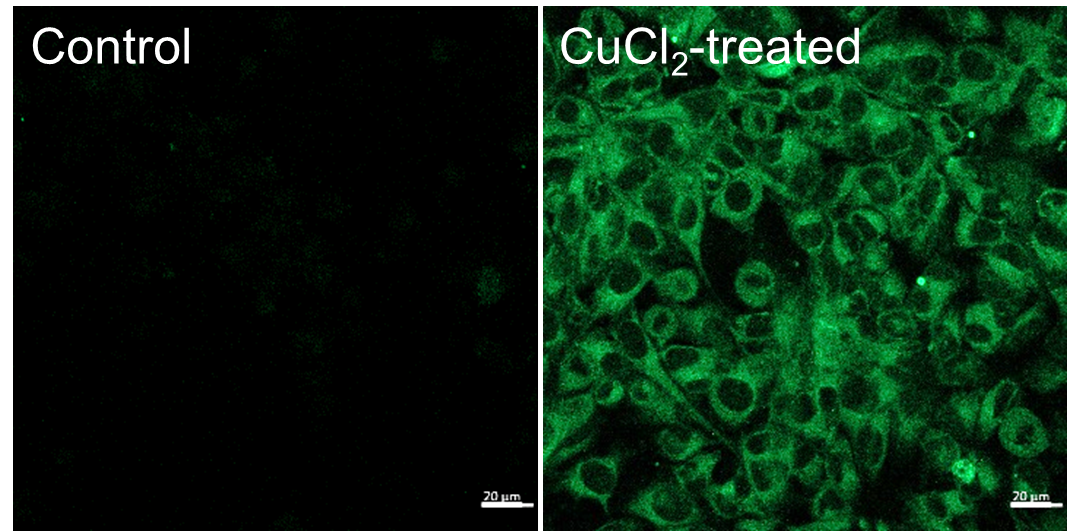
Ex/Em: 488/500–600 nm, Scale bar: 20 μm
図2 共焦点レーザー顕微鏡におけるHeLa細胞の細胞内銅のイメージング
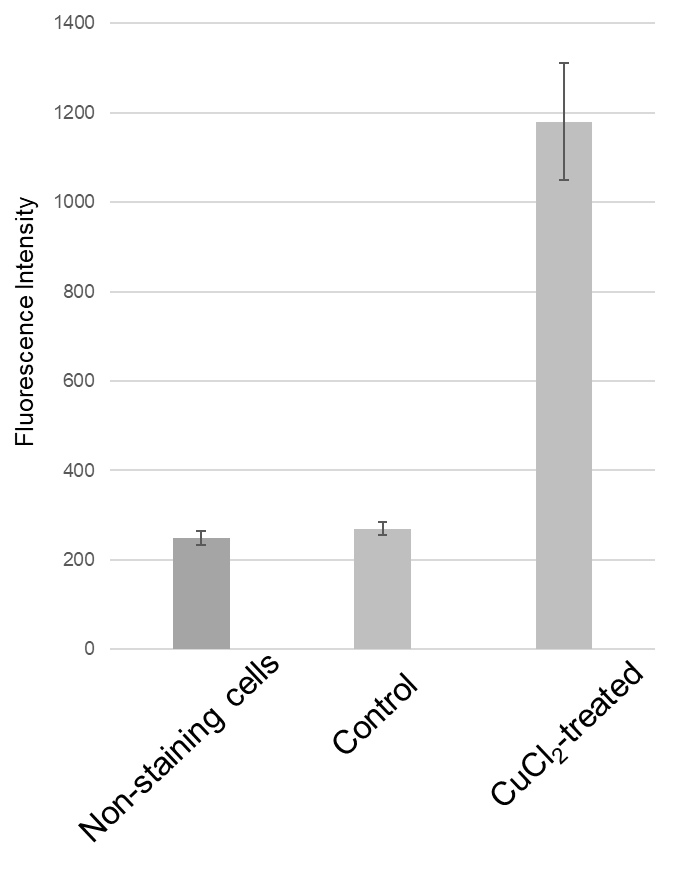
Ex/Em: 470/510 nm
図3 蛍光プレートリーダーにおけるHeLa細胞の細胞内銅の検出
補足情報
CuprosGreenの金属選択性
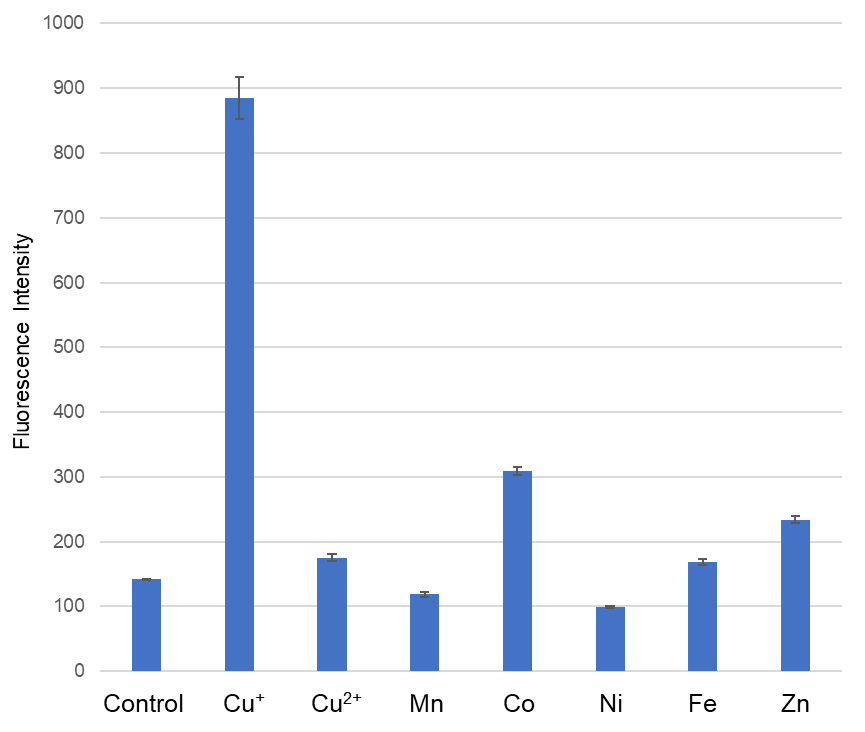
Ex/Em: 470/510 nm
Buffer: 50 mmol/l HEPES (pH 7.2), CuprosGreen濃度: 1 μmol/l, 金属濃度: 20 μmol/l, 反応時間: 1 h
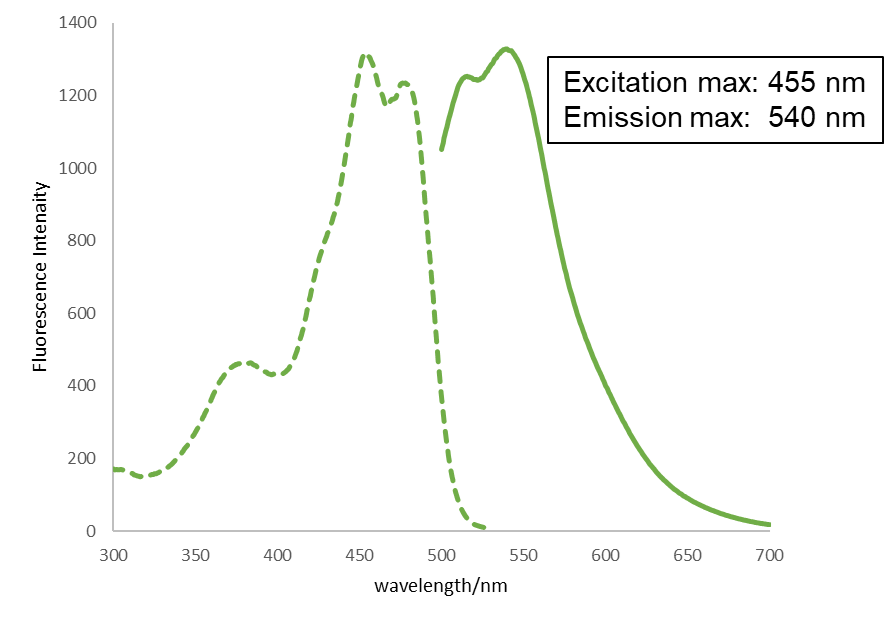
CuprosGreenの励起蛍光スペクトル
参考文献
- Tsvetkov et al., Science, 2022, 375, 1254–1261
よくある質問/参考文献
C557: CuprosGreen
Revised Mar., 14, 2025


 を押して省略できます。
を押して省略できます。

