はじめに
細胞内の不要なタンパク質や細胞小器官を再利用または代謝するための分解過程であるオートファジーは、パーキンソン病などの神経変性疾患、老化に関りがあることが分かってきており盛んに研究されています。近年では、オートファジーを詳細に解析するため、オートファゴソームが増えた要因がオートファジー誘導によるものなのか、またはオートリソソーム阻害によるものなのかを区別する事が求められてきており、オートファジーによる一連の分解の流れを理解することが重要視されています。1)
本キットには、オートファゴソームおよびオートリソソームを検出するDAPRedと、オートリソソームを検出するDALGreen、および、リソソーム酸性阻害剤 Bafilomycin A1 (Baf. A1) が同梱されています。オートファジーの形成からオートリソソームの分解までをモニタリングし、オートファジーの活性を正しく評価できます。 2, 3), 4), 5)
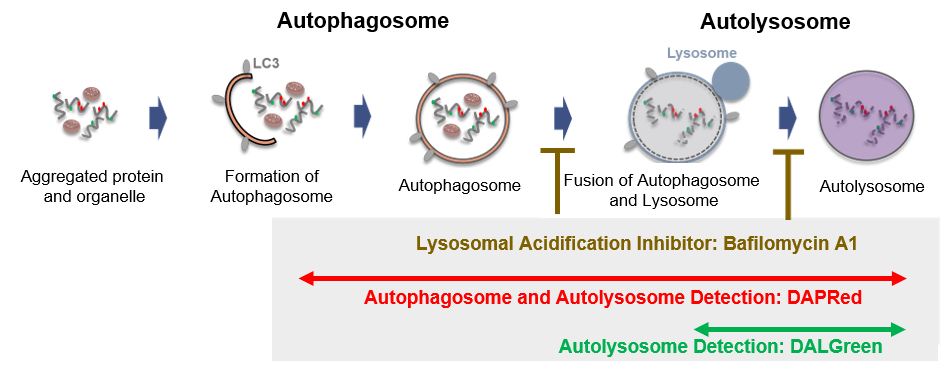
図1. DAPRed及びDALGreenによるオートファジー経路測定について
蛍光特性
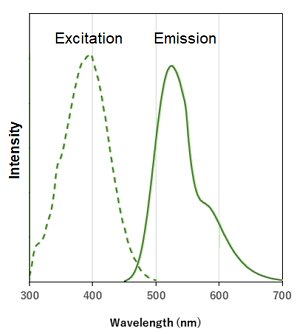
DALGreenとDAPRedの蛍光特性
|
DALGreen |
λex: 405 nm
|
DAPRed 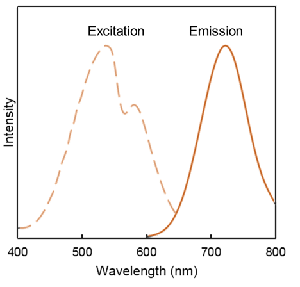 |
λex: 530 nm
|
内容
- DALGreen 10 nmol x 1
- DAPRed 2 nmol x 1
- Bafilomycin A1 x 1
- Bafilomycin A1は極少量であるため、内容物が見え難くなっております。取扱いにご注意下さい。
保存条件
遮光、-20℃にて保存してください。
必要なもの
- Dimethyl sulfoxide (DMSO)
- 培地
- アミノ酸不含培地
- マイクロピペット
- マイクロチューブ
溶液調製
1 mmol/l DALGreen DMSO stock solution の調製
DALGreen 10 nmol を含むチューブに10 μl のDMSOを加え、ピペッティングにより溶解する。
- 調製後は-20℃で保存してください。調製後1ヶ月間安定です。
0.1 mmol/L DAPRed DMSO stock solutionの調製
DAPRed 2 nmolを含むチューブに20 μl のDMSOを加え、ピペッティングにより溶解する。
- 調製後は-20℃で保存してください。調製後1ヶ月間安定です。
DALGreen/DAPRed working solutionの調製
最終濃度が1.0 μmol/l になるようにDALGreen DMSO stock solution を培養培地で希釈し、最終濃度が0.2 μmol/LになるようにDAPRed DMSO stock solutionを培養培地で希釈する。
- 1 ml 調製する場合、DALGreen DMSO stock solution 1 μl とDAPRed DMSO stock solution 2 μl を培養培地に加えて調製して下さい。
- DALGreen/DAPRed working solutionは保存できません。調製したその日のうちに、ご使用ください。
Bafilomycin A1 DMSO stock solutionの調製
Bafilomycin A1を含むチューブにDMSO 24 μl を加え、ピペッティングにより溶解する。
- 調製後は-20℃で保存して下さい。調製後1ヶ月間安定です。
Bafilomycin A1 working solutionの調製
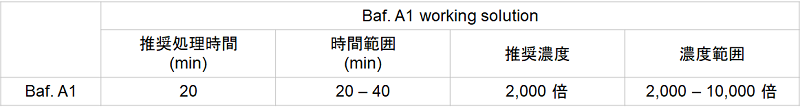
Bafilomycin A1 DMSO stock solutionをアミノ酸不含培地で2,000 ー 10,000倍希釈する。
- 細胞種によって、Bafilomycin A1 working solutionの最適濃度が異なります。予備実験の項を参照して、最適濃度をご検討ください。 (推奨濃度: 2,000 倍)
- Bafilomycin A1 working solutionは保存できません。調製したその日のうちにご使用ください。
予備実験
測定条件の最適化
オートファジーの能力は細胞の種類によって異なるため、事前に測定条件の最適化を行うことをお勧めします。「本製品を初めて使用する」または「細胞種を変更する」場合、DALGreen・DAPRedの染色濃度、Baf. A1の濃度・処理時間を下記プロトコルで検討し、DALGreen/DAPRedのシグナル変化が下記表の通りに変化するよう最適化してください。

- 細胞をディッシュに播種し、5% CO2存在下、37℃で培養する。
- 培地を取り除き、培養培地を用いて細胞を2回洗浄する。
- 調製したDALGreen/DAPRed working solutionを加え、5% CO2存在下、37℃で30分インキュベートする。
- 上澄みを取り除き、培養培地を用いて細胞を2回洗浄する。
- 以下の条件で、サンプルを準備する。
- 培養培地を加え、5% CO2存在下、37℃で2時間20分インキュベートする。(コントロール条件)
- アミノ酸不含培地を加え、5% CO2存在下、37℃で2時間20分インキュベートする。(飢餓誘導条件)
- アミノ酸不含培地を加え、5% CO2存在下、 37℃で2時間インキュベートする。上澄みを取り除き、調製したBafilomycin A1 working solutionを加え、 5% CO2存在下、37℃で20分インキュベートする。(オートリソソーム阻害条件)
6. 蛍光顕微鏡で観察する。
- Baf. A1の希釈倍率、処理時間、添加のタイミングにより、イメージング解析に影響を及ぼす場合があります。詳細は本製品ウェブページの「よくある質問」をご参照ください。
- Baf. A1の実績は、実験例または本製品ウェブページをご参照ください。
- 細胞種によっては、飢餓誘導時、Baf. A1処理時とコントロールとの差が判りにくい場合があります。上記の情報を参考に、DALGreen/DAPRed working solutionの最適濃度の検討することをお勧めします。
操作
オートファジーを標的とする物質には種々の薬剤 (誘導剤/阻害剤) があります。添加する薬剤に応じて、実験方法を選択することができます。
オートファジー阻害剤は、長時間の処理で他の細胞機能に影響を与える可能性があります。そのため、阻害剤に応じて「飢餓誘導と同時処理」、もしくは「飢餓誘導後の短時間処理」の2種類のプロトコルをご検討ください。
- 誘導剤/阻害剤の実績は、製品Webページのよくある質問をご参照ください。
- 薬剤の効果が未知の場合、下記のオートファジー誘導確認と阻害確認の両方の実験を行ってください。
オートファジー誘導確認
- 細胞をディッシュに播種し、5% CO2存在下、37℃で培養する。
- 培地を取り除き、培養培地を用いて細胞を2回洗浄する。
- 調製したDALGreen/DAPRed working solutionを加え、5% CO2存在下、37℃で30分インキュベートする。
- 上澄みを取り除き、培養培地を用いて細胞を2回洗浄する。
- 以下の条件でサンプルを準備する。
オートファジー誘導剤の場合
- 培養培地を加え、5% CO2存在下、37℃で24時間インキュベートする。(コントロール条件)
- 培養培地で調製したオートファジー誘導剤を加え、5% CO2存在下、 37℃で24時間インキュベートする。(オートファジー誘導条件)
飢餓誘導の場合
- 培養培地を加え、5% CO2存在下、37℃で2時間インキュベートする。(コントロール条件)
- アミノ酸不含培地を加え、 5% CO2存在下、 37℃で2時間インキュベートする。(飢餓誘導条件)
6. 蛍光顕微鏡で観察する。
- 必要に応じて、細胞を洗浄して下さい。
オートファジー阻害確認
- 細胞をディッシュに播種し、5% CO2存在下、37℃で培養する。
- 培地を取り除き、培養培地を用いて細胞を2回洗浄する。
- 調製したDALGreen/DAPRed working solutionを加え、5% CO2存在下、37℃で30分インキュベートする。
- 上澄みを取り除き、培養培地を用いて細胞を2回洗浄する。
- 以下の条件でサンプルを準備する。
飢餓誘導/オートファジー阻害剤 同時処理の場合
- 培養培地を加え、5% CO2存在下、37℃で2時間インキュベートする。(コントロール条件)
- アミノ酸不含培地を加え、5% CO2存在下、37℃で2時間インキュベートする。(飢餓誘導条件)
- アミノ酸不含培地で調製したオートファジー阻害剤を加え、 5% CO2存在下、37℃で2時間インキュベートする。(オートファジー阻害条件)
オートファジー阻害剤 後処理の場合
- 培養培地を加え、5% CO2存在下、37℃で2時間20分インキュベートする。(コントロール条件)
- アミノ酸不含培地を加え、5% CO2存在下、37℃で2時間20分インキュベートする。(飢餓誘導条件)
- アミノ酸不含培地を加え、5% CO2存在下、 37℃で2時間インキュベートする。上澄みを取り除き、アミノ酸不含培地で調製したオートファジー阻害剤を加え、 5% CO2存在下、37℃で20分インキュベートする。(オートファジー阻害条件)
6. 蛍光顕微鏡で観察する。
- 必要に応じて、細胞を洗浄して下さい。
- オートファジー阻害剤の実績は、本製品ウェブページをご参照ください。
実験例
共焦点蛍光顕微鏡を用いたBafilomycin A1によるオートリソソーム形成阻害の解析
- μ-slide 8 well plate (ibidi社) にHeLa細胞 (1.0 x 104 cells/well) を播種し、5% CO2存在下、37℃で一晩培養した。
- 10% FBS含有MEM培地で2回洗浄後、DALGreen/DAPRed working solution (DALGreen: 1 µmol/l、DAPRed: 0.2 µmol/l) をwellに200 μl加え、 5% CO2存在下、 37℃で30分インキュベートした。
- 上澄みを取り除き、細胞を10% FBS含有MEM培地で2回洗浄した。
- 以下の条件でサンプルを準備した。
- 10% FBS含有MEM培地をwellに200 μl加え、37℃で2時間20分インキュベートした。(コントロール条件)
- アミノ酸不含培地 (富士フイルム和光純薬、製品コード: 048-33575) をwellに200 μl加え、 5% CO2存在下、 37℃で2時間20分インキュベートした。(飢餓誘導条件)
- アミノ酸不含培地をwellに200 μl加え、 5% CO2存在下、 37℃で2時間インキュベートした。上澄みを取り除き、Bafilomycin A1 working solution (リソソーム酸性化阻害剤) をwellに200 μl加え、5% CO2存在下、 37℃で20分インキュベートした。(オートリソソーム形成阻害条件)
5. 共焦点蛍光顕微鏡で観察した。
- イメージングで評価したのち、画像解析ツールで蛍光画像を数値化した結果は、本製品ウェブページをご参照ください。
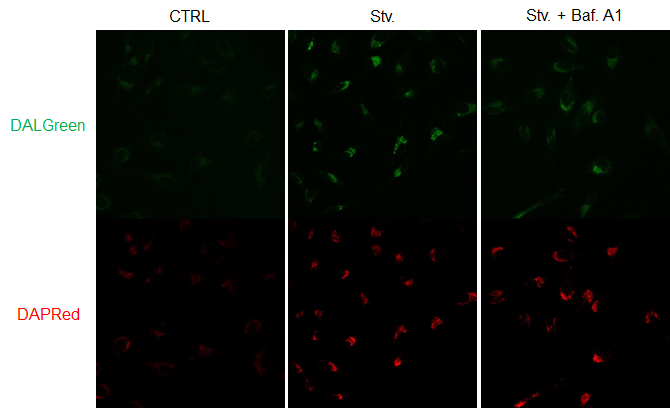
図2. Bafilomycin A1によるオートファジー経路への影響
CTRL: 通常培養条件、Stv.: 飢餓誘導条件、Stv. + Baf. A1: オートリソソーム阻害条件
DALGreen 検出波長: 488 nm (Ex), 490–550 nm (Em)
DAPRed 検出波長: 561 nm (Ex), 565–700 nm (Em)
参考文献
- Xiao-jie ZHANG, et al., Acta Pharmacologica Sinica, 2013, 34, 595–599.
- H. Sakurai, et al., iScience, 2023, 26, 107218.
- Xun Chen, et al., Am J Transl Res., 2020, 12(9), 4902-4922.
- Chang-Ki Oh, et al., J Neurosci., 2022, 42(14), 3011-3024.
- Hidefumi Iwashita, et al., FEBS Lett., 2018, 592, 559-567.
よくある質問/参考文献
A562: Autophagic Flux Assay Kit
Revised Feb., 22, 2024


 を押して省略できます。
を押して省略できます。