細胞外小胞研究の課題と技術的進展
株式会社同仁化学研究所 稲垣 瑞希
細胞外小胞(extracellular vesicle, EV)は、タンパク質やmiRNAなどの生物学的活性を持つ分子を内包しており、細胞間コミュニケーションの担い手として、近年大きな注目を集めている1)。特に、腫瘍微小環境の制御や免疫応答の調節2)、神経変性疾患の進行3)といった、病態における関与が示されており、疾患特異的なバイオマーカーや治療応用への展開が期待されている4)。一方で、EV研究には未だ解決すべき技術的課題が残っている。第一に、EVの直径は数十~数百ナノメートルと非常に小さいため、詳細な構造やマーカーを正確に捉えるには高分解能の観察装置が必要である。第二に、個々のEVに含まれる分子量が極めて少ないため、十分なシグナルを得ることが難しい。第三に、EV集団は不均一性を有しており、細胞種や疾患状態、また同一細胞内でも構成要素やマーカー発現が多様であるため、集団平均に基づく解析のみでは実態を正確に把握できない可能性がある5), 6)。これらの課題を背景に、EV研究では主に二つの方向での技術的発展が見られている。ひとつは、高純度にEVを分離する技術により夾雑物を減らし、下流のオミクス解析やマーカー検出の精度を向上させている7)。もうひとつは、単一EV解析技術であり、フローサイトメトリーやマイクロ流体技術を活用した単一粒子解析といった新しいアプローチが報告されている8)。
本稿では、特に最近報告された、単一EV解析の最先端手法を紹介したい。
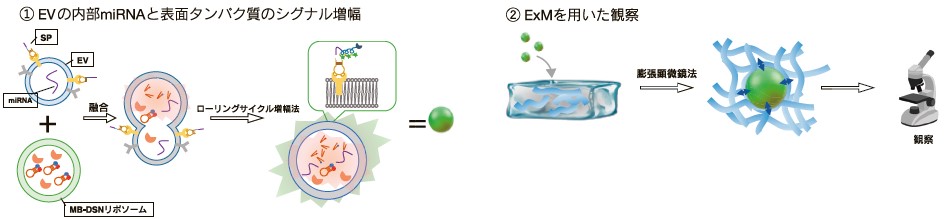
2025年、Wuらはローリングサークル増幅法(rolling circle amplification, RCA)と膨張顕微鏡法(expansion microscopy, ExM)を組み合わせた、新しい単一EV解析技術の研究成果を報告している9)。この手法は、以下3点の特徴を持つ。
-
EV表面タンパク質(EpCAM, PD-L1)シグナルの増幅
PD-L1を認識するスイッチヘアピンプローブ(switch hairpin probe, SP)を用いて、SPを鋳型としてRCAを行い、蛍光シグナルを増幅した。 -
EV内部 miRNA(miR-21)シグナルの増幅
miR-21を検出するため、EV-リポソーム融合を利用し、分子ビーコン(molecular beacon, MB)と二本鎖特異的ヌクレアーゼ(dual-specificity nuclease, DSN)を導入し、増幅回路を構成した。 -
ExMを用いた観察
1,2のシグナル増幅後、ハイドロゲルを用いたExMを適用することで、EVを物理的に拡張させ、通常の蛍光顕微鏡でナノスケール構造を観察可能にした。
RCA-ExM 法は、従来の蛍光顕微鏡の限界を超えて、単一EVの表面タンパク質と内部miRNAの同時可視化を実現した。さらに臨床検体を用いた解析では、特定のEV集団が患者群と健常群を識別し、免疫療法の効果予測にもつながる可能性が示された。本技術は、EVの単一粒子解析を実現する新たな方法であり、1粒のEVを診断や治療モニタリングに活用するための一歩となるだろう。こうした技術革新がエクソソームのさらなる利用法を切り拓き、研究や臨床応用が一層進展することが期待される。
【参考文献】
- H. Valadi, K. Ekström, A. Bossios et al., “Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells”, Nat. Cell Biol., 2007, 9(6), 654-659.
- G. Chen, A. C. Huang, W. Zhang et al., “Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response”, Nature, 2018, 560(7718), 382-386.
- Z. Ruan, D. Pathak, S. V. Kalavai, A. Yoshii-Kitahara, S. Muraoka, N. Bhatt, K. Takamatsu-Yukawa, J. Hu, Y. Wang, S. Hersh, M. Ericsson, S. Gorantla, H. E. Gendelman, R. Kayed, S. Ikezu, J. I. Luebke and T. Ikezu, “Alzheimer's disease brain-derived extracellular vesicles spread tau pathology in interneurons”, Brain, 2021, 144(1), 288-309.
- M. Zhang, S. Hu, L. Liu et al., “Engineered exosomes from different sources for cancer-targeted therapy”, Sig. Transduct. Target. Ther., 2023, 8(1), 124.
- C. Théry, K. W. Witwer, E. Aikawa et al., “Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines”, J. Extracell. Vesicles, 2018, 7(1), 1535750.
- S. Sharma, M. LeClaire, J. Wohlschlegel et al., “Impact of isolation methods on the biophysical heterogeneity of single extracellular vesicles”, Sci. Rep., 2020, 10(1), 13327.
- V. Solovicová, A. Ď atková, T. Bertók et al., “Advances in magnetic affinity-based isolation/detection of exosomes for robust diagnostics”, Microchim. Acta, 2025, 192(4), 206.
- S. H. Hilton, I. M. White, “Advances in the analysis of single extracellular vesicles: A critical review”, Sens. Actuators Rep., 2021, 3, 100052.
- J. Wu, Q. Dou, M. Mao et al., “Single extracellular vesicle imaging via rolling circle amplification-expansion microscopy”, Nat. Commun., 2025, 16(1), 7498.