機能性ラマンイメージングプローブの開発
Development of functional Raman imaging probes

藤岡 礼任
東京科学大学
総合研究院・化学生命科学研究所
助教

神谷 真子
東京科学大学
総合研究院・化学生命科学研究所
教授
Abstract Recently, Raman imaging has attracted significant attention for its higher multiplexed detection capability than fluorescence imaging. Lower sensitivity of Raman imaging compared to fluorescence imaging has been improved by the progress of Raman microscopy and Raman probes, however, most Raman probes showed constant Raman signal, that is called “always-on” probe. We focused on resonance Raman effect that enhanced Raman signal significantly when the molecular absorption approaches to pump wavelength, and developed several functional Raman probes. In this review, we would like to overview our recently developed functional Raman probes and the frontiers of vibrational imaging.
1. はじめに
生体を観察する手法として、有機小分子蛍光色素や蛍光タンパク質といった蛍光プローブを用いた蛍光イメージングが幅広く普及し、生命現象の解明に多大なる貢献をしてきた。一方で、蛍光イメージングではスペクトルの幅広い線幅のためにcolor barrierが存在すると言われ、同時多重検出数に一定の限界がある点が課題として挙げられている。これに対し、分子振動を検出するラマンイメージングでは蛍光スペクトルよりも50–100倍狭いラマンスペクトルの特徴により、特に細胞由来の信号が生じないsilentregion に信号を示すラマンタグ構造を有したプローブを利用することで、蛍光を凌駕する多重検出数を達成できる点において近年注目を浴びている1)(図1)。
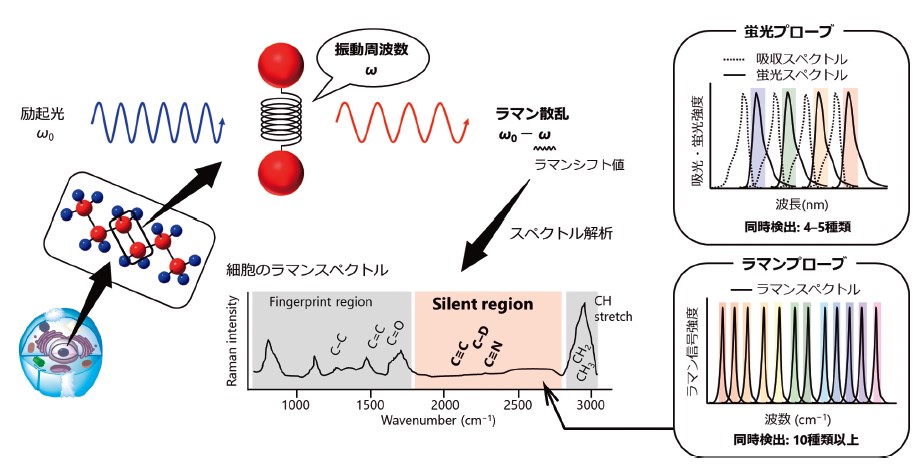
励起波長から分子の振動数分だけ波長が変化した散乱光をラマン散乱と呼ぶ。この波長の変化量をラマンシフト値と呼ぶが、ラマンシフト値は分子固有の値であるため蛍光分子などで標的分子をラベル化しなくても分子を直接検出することが可能である。また、生体由来の信号が生じない波数域をsilent regionと呼ぶが、silent regionに信号を示すラマンタグプローブを用いることで10種類以上の標的分子を同時に可視化可能であることが近年報告された。
2.吸収波長変化を利用したラマン信号制御
第1章で述べたような利点を有しているラマンイメージングであるが、検出するラマン散乱の典型的な散乱断面積は10-30cm2であり、一般的な蛍光分子の吸収断面積10-16cm2と比べて1014倍も小さい。このため検出感度が低く、特に生体イメージングにおいては撮像時間に数十分から数時間かかってしまうことが大きな課題であった2)。そのような中、誘導ラマン散乱(stimulated Raman scattering, SRS)現象を利用することでビデオレートでの高速撮像が可能となったSRS顕微鏡3)や、共鳴ラマン散乱を利用したラマン色素プローブの登場によって、ラマンイメージングの生体適合性が大きく向上した。特にMin教授らによって報告された、前期共鳴ラマン(electronic pre-resonance,EPR)条件とSRS顕微鏡を組み合わせたEPR-SRS検出系は、10種類以上の標的を高感度に同時検出した例として大きな注目を浴びた4)。しかし、このようなラマンプローブの多くは常に一定の信号を発するalways-on型のラマンプローブであり、特定の化学反応に伴ってはじめて信号を発するような機能性を有したactivatableなラマンプローブの設計法は確立されていなかった。そこで我々は特に、共鳴ラマン散乱が「励起波長に対して分子の吸収波長が近づくにつれてラマン散乱強度が著しく増大する」現象であることに着目し、分子の吸収波長変化を制御できればラマン信号のoff/onを制御できるようになるのではないかと着想し研究を行った(図2)。本稿では、このような制御原理に基づいて最近著者らのグループが報告した機能性ラマンプローブについて紹介する。
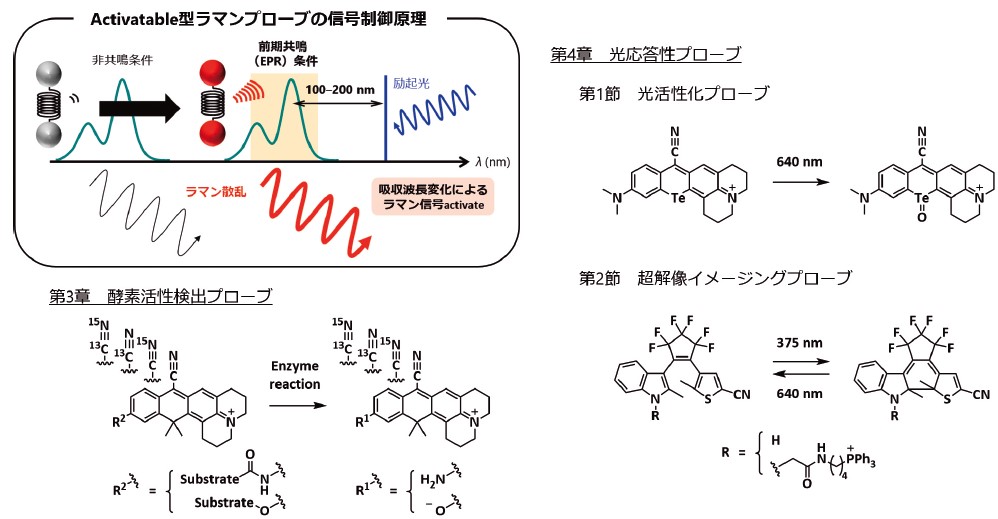
励起波長が分子の吸収波長に近づくにつれてラマン散乱強度が著しく増大する現象を共鳴ラマン散乱と呼び、特に分子の吸収よりやや長波長の光を用いる前期共鳴条件が高感度ラマンイメージングに適していることが報告された。著者らのグループでは、共鳴ラマン効果を利用すれば分子の吸収波長変化に基づいてラマン信号のoff/onを制御できるのではないかと考え、機能性を有したラマンプローブ開発を行ってきた。
3.酵素活性検出ラマンプローブ
生体内では様々な酵素が化学反応を触媒しているため、一度に複数の酵素活性を検出することができれば生命現象をより包括的に理解できる可能性があり、多重検出能の高いラマンプローブでの複数酵素活性検出を目指した。著者らのグループではこれまでに酵素活性を検出可能な蛍光プローブを数多く開発してきている5), 6)が、その開発過程でプローブとして使用している蛍光色素が標的酵素による加水分解反応を受ける前後で吸収波長を変化させる特性を見出してきたため、この吸収波長変化を利用することでactivatable型のラマンプローブが設計できるのではないかと考えた。第3章では、はじめに概念実証を行ったactivatable型ラマンプローブ、およびその細胞内滞留性を改善した凝集型ラマンプローブについて概説する。
3.1. 酵素活性検出activatableプローブ
Activatable型ラマンプローブを開発するにあたってキサンテン環3位のアミド結合が加水分解されて1級アミンへと変換されることで吸収波長が長波長化する性質を利用できると考えた。すなわち、はじめは吸収波長が短波長であり共鳴ラマン効果が得られずラマン信号がoffとなっているが、加水分解酵素との反応によって吸収波長が長波長化しEPR条件を満たすようになることでラマン信号がonとなる分子設計を考案した。そこで、キサンテン色素にsilent regionに振動を生じるラマンタグとしてニトリル基を導入した9CN-pyroninを誘導体展開した結果、9CNJCPが生理的条件下でも安定なプローブ母核であることを見出した。実際に9CN-JCPにアミド結合を介してGGT(γ-glutamy-ltranspeptidase)の酵素基質部位を導入したgGlu-9CN-JCPは、9CN-JCPよりも吸収波長が大きく短波長化することでラマン信号強度が60倍程度低下し、GGTとの反応によって9CN-JCPを生成することでラマン信号をactivate可能であることが確認された。さらに、ラマンイメージングの多重検出能に基づけばニトリル基の炭素原子および窒素原子を安定同位体で置換することによってラマンシフト値を変化させることができ、異なる波数で検出可能なプローブ母核に対してそれぞれ異なる酵素反応部位を導入することで、4種類の酵素活性検出ラマンプローブを開発することに成功した。これらを生きた細胞に用いることで4種類の酵素活性をライブイメージングすることができ、細胞種によって酵素活性パターンが異なることが示された7)(図3.1.)。
3.2. 細胞内滞留性プローブ
前節の9CN-pyroninを母核としたラマンプローブは、酵素活性を検出可能であることが実証された一方で、酵素反応後に生成される色素母核の細胞内滞留性が低く、標的酵素活性が高い標的細胞と低い非標的細胞が混在するような生体組織サンプルにおいては、activateされた色素の漏出のために標的細胞のみを選択的に検出することができないという課題が明らかとなってきた。そこで細胞内滞留性を改善した新規プローブの開発に着手したところ、9CN-pyroninのアミノ基をヒドロキシ基に置換した9CN-rhodolが生理的条件下で高い凝集性を示す特性が見出された。そこで、この性質を利用して酵素反応後に凝集性を獲得するようなプローブ設計ができれば細胞内滞留性を改善できるのではないかと考えた。実際に9CN-pyroninと9CN-rhodolの性質を精査したところ、分子全体の電荷がcationicである9CN-pyroninや酸性条件下の9CN-rhodolは凝集性を示さなかったのに対し、分子全体の電荷がneutral となる中性条件下の9CN-rhodolは顕著な凝集性を示すことが明らかとなった。更なる誘導体展開を経て開発した9C15N-JCR-Bn-βGalは、標的酵素であるβ-Gal(β-galactosidase)との反応前は吸収波長が短波長なためラマン信号強度がoffでありかつ凝集性も低いが、β-Galとの反応後には長波長化によってラマン信号強度がonになると同時に凝集性を獲得することが確認された。このようにして新規開発した9CN-rhodolプローブでは、標的酵素と非標的細胞が混在するショウジョウバエ組織を用いたex vivoイメージングにおいても、標的細胞の存在領域を高選択的に検出可能であることが実証された8)(図3.2.)
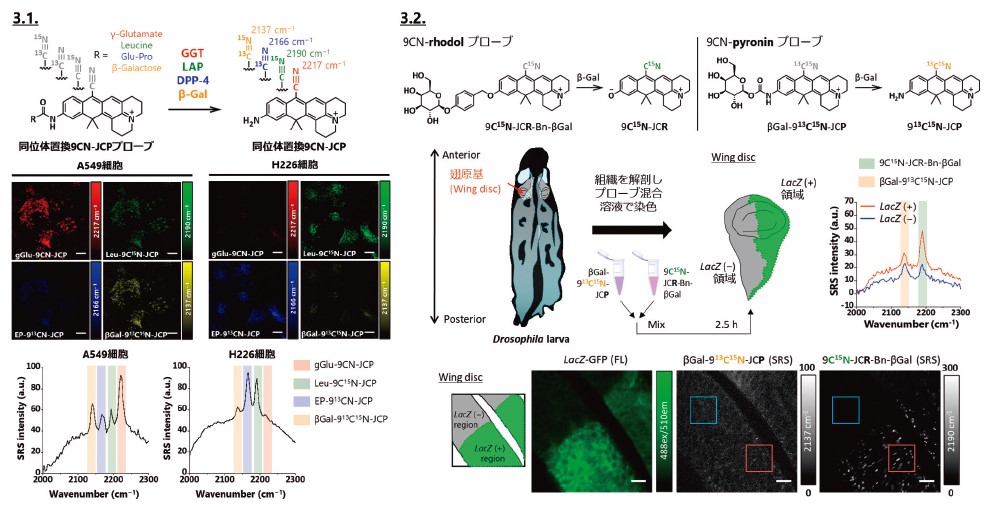
3.1.9CN-pyroninをプローブの母核構造とし、アミド結合を介して導入した酵素基質部位が加水分解されることに伴う波長変化によってCN基のラマン信号がactivateされるプローブの開発に成功した。CN基を安定同位体で置換することによってラマンシフト値を調節することが可能であり、異なる4種類の酵素活性を同時に検出可能なラマンプローブを開発し、生きた細胞で細胞種によって酵素活性パターンが異なることを実証した。3.2.9CN-pyroninプローブでは酵素反応後に色素が標的細胞から漏出するために組織でのイメージングが困難であったが、9CN-rhodolを母核としたプローブでは酵素反応後に生成する色素が凝集体を形成することで細胞内滞留性を改善することができた。一部の領域にのみβ-galactosidaseを過剰発現させたショウジョウバエ組織に対して9CN-rhodolプローブと9CN-pyroninプローブを同時に添加して比較した実験では、9CN-rhodolが9CN-pyroninよりも高い領域選択性で組織を染色可能であることが示された。
4. 光応答性ラマンプローブ
第3章では酵素反応を起点とした波長変化に基づいた分子設計を行ったが、近年では光をトリガーとした機能性ラマンプローブの報告も増えつつある9), 10), 11)。著者らのグループでも最近いくつかの光応答性ラマンプローブを報告しており、第4章ではこれらのプローブについて概説する。
4.1. 光活性化プローブ
10 位元素をTe原子に置換したrhodamine類は、10位のTe原子の酸化によって吸収波長が長波長化することが知られており12)、これを利用すれば10位元素を反応点とした新規ラマンプローブが開発可能ではないかと考えた。そこで、第3章・第1節でプローブ母核として活用した9CN-pyroninの10位元素をTeに置換した一連の誘導体を合成・評価したところ、9CNdiMeJTePを最適な構造として見出した。9CN-diMeJTePは640nmの光照射によって10位のTe原子が(Te=O)構造へと酸化され、この構造変化に伴う吸収波長変化によってEPR効果が強くなりSRS信号強度が増大することが確認された13)(図4.1.)。
4.2. 超解像イメージングプローブ
光照射によってラマン信号がスイッチングするプローブを開発するべく、紫外光照射により長波長吸収の閉環構造に、可視光照射により短波長吸収の開環構造に変換されるDAE(diarylethene)色素を母核としてDAE620を設計・開発した。開発したDAE620は、375nm光と640nm光の照射によって閉環体と開環体をスイッチングする特性を示し、長波長吸収を有する閉環体では、共鳴ラマン効果により開環体と比べてC=C 振動ピークが大きくactivateされることが明らかとなった。さらに本プローブを、紫外光とドーナツ状に成形した可視光を用いた光学系に適用することによって狭小領域の分子のラマン信号のみをactivateし、RESOLFT(reversible saturable optical fluorescence transitions)と同様の原理に基づいた超解像ラマンイメージングを行えるのではないかと考えた。本手法をRESORT(reversible saturable optical Raman transitions)と命名し、RESORT実証に向け、DAE620にミトコンドリア指向性リガンドを導入したDAE620-Mitoで染色した細胞を用いてRESORT 観察を行ったところ、細胞内のミトコンドリアを高い分解能でイメージング可能であることが示された14)(図4.2.)。
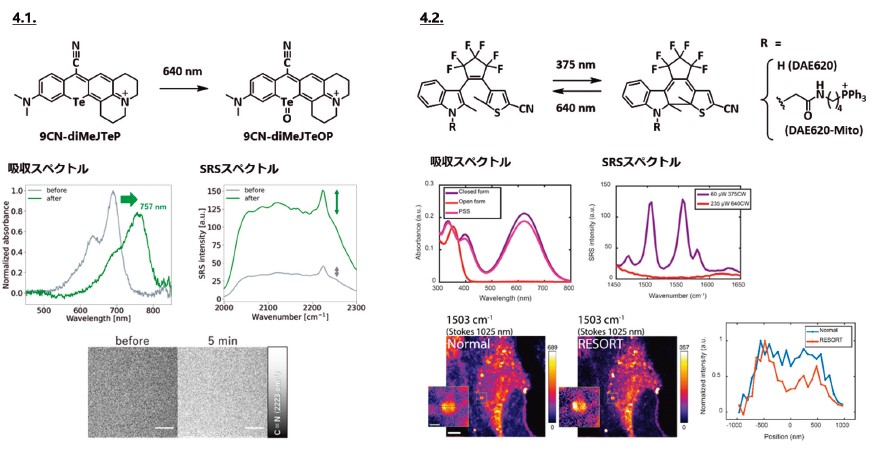
4.1.9CN-pyroninの10位元素をTe原子に置換した9CN-TeP誘導体は640nmの可視光照射によって吸収波長が長波長化し、これに伴ってCN基のラマン信号強度が増大することが確認された。4.2.DAE620は375nmの紫外光と640nmの可視光によって閉環体と開環体をスイッチする特性があり、C=C結合のラマン信号も大きくスイッチングする性質が見出された。この性質を利用することでRESOLFTと同様の原理に基づいた超解像ラマンイメージング(RESORT)が可能であり、細胞内のミトコンドリアを高い分解能でラマンイメージングすることに成功した。
5. おわりに
本稿では、著者らのグループの研究成果を基に機能性ラマンプローブの開発について概説した。ラベル化剤としてだけではなく、activatableな機能性を有したラマンプローブによる多重イメージングが進めば、生命現象のより包括的な理解が深まると期待される。
最後に、本稿で紹介した著者らの研究は、東京大学先端科学技術研究センターの小関泰之教授との共同研究成果であり、この場を借りて深く感謝申し上げる。
| [ 著者プロフィール ] | |
| 氏名 | 藤岡 礼任(Hiroyoshi Fujioka) |
|---|---|
| 所属 |
東京科学大学 総合研究院・化学生命科学研究所 〒226-8501 神奈川県横浜市緑区長津田町4259 Tel:045-924-5233 |
| 出身学校 | 東京大学大学院薬学系研究科 |
| 学位 | 博士(薬科学) |
| 専門分野 | ケミカルバイオロジー |
| 現在の研究テーマ | 機能性ラマンプローブの開発 |
| [ 著者プロフィール ] | |
| 氏名 | 神谷 真子(Mako Kamiya) |
|---|---|
| 所属 |
東京科学大学 総合研究院・化学生命科学研究所 〒226-8501 神奈川県横浜市緑区長津田町4259 Tel:045-924-5233 |
| 出身学校 | 東京大学大学院薬学系研究科 |
| 学位 | 博士(薬学) |
| 専門分野 | ケミカルバイオロジー |
| 現在の研究テーマ | 光機能性プローブの開発 |