生体内銅の代謝と銅誘導性細胞死(カプロトーシス)、及び疾患との関係
株式会社同仁化学研究所 中久保 政一
必須微量栄養素である銅は、ほぼ全ての細胞かつ広範囲な生理学的プロセスに必要とされている上に、細胞内銅の蓄積は酸化ストレスを誘発し細胞機能を乱す可能性があるため、銅の恒常性は細胞内で厳密に制御されている。最近の研究では、既知の細胞死の経路とは異なる銅誘導性細胞死(カプロトーシス)が特定され、生体内の銅の代謝や疾患との関係がより一層注目を集め始めている。カプロトーシスは、トリカルボン酸(TCA)回路の脂質化酵素に銅が結合することで発生し、その後タンパク質凝集、タンパク質毒性ストレス、そして最終的には細胞死につながる1)。
ここでは、銅代謝とカプロトーシス並びに、カプロトーシスと神経変性疾患との関連性について紹介する。
〈生体内銅の代謝2)〉
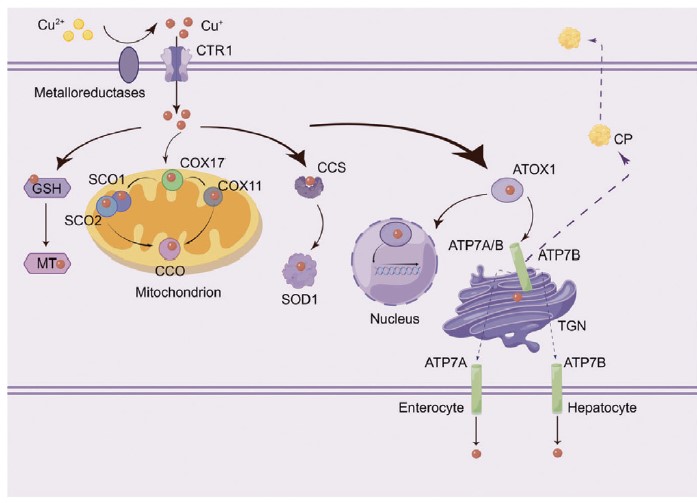
銅にはCu+(第一銅イオン、還元型)とCu2+(第二銅イオン、酸化型)の二つの陽イオン形態があり、細胞の酵素活性・発現調節に関与している。Cu2+は細胞表面の金属還元酵素によってCu+に還元され、銅トランスポーター1(CTR1)により細胞内に取り込まれる。循環血中の銅はセルロプラスミン(CP)やアルブミンと結合して臓器に運ばれ、肝細胞に貯蔵される。細胞内では、銅の代謝と運搬は複数のシャペロンタンパク質(COX17等)によって行われる。COX17はCu+をシトクロムc酸化酵素(CCO)の合成に関わるタンパク質(SCO1、SCO2)に運び、CCOの酵素活性を維持サポートする。スーパーオキシドディスムターゼ(SOD1)用の銅シャペロン(CCS)はCu+をSOD1に渡し、抗酸化に寄与する。銅シャペロン(ATOX1)はCu+を核に輸送し、転写因子に結合して遺伝子発現を調整する。また、ATOX1は銅輸送ATPase(ATP7A、ATP7B)にもCu+を渡す。ATP7Aはほとんどの組織で、ATP7Bは主に肝臓で機能し、トランスゴルジ体ネットワーク(TGN)に銅を輸送する。細胞内のCu+が増加すると、ATPaseは細胞膜と融合してCu+を排出し、銅レベルが正常化すると再びTGNに戻る(図1を参照)。
〈カプロトーシス〉
1978年、Chanらは正常線維芽細胞における細胞内銅の制御メカニズムを解明し、高濃度の銅が細胞死につながることを発見した3)。培地中の銅濃度が30 μg/mlを超えると線維芽細胞は死滅したが、当時はまだそのメカニズムは不明で、それ以来、銅誘導性細胞死の研究が進み、銅イオンの役割が明らかとなった。銅イオンの恒常性が乱れると、活性酸素種(ROS)の蓄積、プロテアソーム阻害、ミトコンドリア機能不全などを通じて細胞死を引き起こす可能性が判明し、この過程が「カプロトーシス」と名付けられた。銅イオンはトリカルボン酸(TCA)回路で脂肪酸アシル化タンパク質に結合し、脂肪酸アシル化修飾を引き起こす。これらのタンパク質の凝集とそれに続くFe-S(鉄-硫黄)クラスターの減少により、TCA回路の阻害、タンパク質毒性ストレスが引き起こされ、最終的に細胞死が引き起こされる1)。しかし、銅誘導性細胞死には未だ不明な点も多く、現在もなお研究が進んでいる。
〈カプロトーシスと疾患〉
多くの研究から、銅の恒常性の変化がアルツハイマー病(AD)、ハンチントン病(HD)、筋萎縮性側索硬化症(ALS)などの神経変性疾患の進行に直接関与していることが示されている4)。AD患者の老人斑と血清中、またマウスモデルのAβ斑に高濃度の銅が見つかっており、銅キレート治療と銅トランスポーター1(CTR1)のノックダウンが神経毒性を回復させることが示された。HDに関しても、脳内の銅の蓄積が変異ハンチンチン(HTT)タンパク質の凝集を促進し、疾患の進行を加速することが示された。その基礎となるメカニズムとしては、カプロトーシスによるミトコンドリアの機能不全が挙げられる。例えば、神経芽腫細胞を銅にさらすとミトコンドリアROSの産生が増加し、ピルビン酸脱水素酵素の産生が減少し、銅が神経細胞/グリア細胞培養に添加されるとミトコンドリア膜電位が低下し、酵素の産生が阻害される。ただし、カプロトーシスが神経変性疾患において主要な原因となっているかどうか、またその阻害が治療戦略となるかどうかについては、さらなる研究が必要である。
【参考文献】
- P. Tsvetkov et al., “Copper induces cell death by targeting lipoylated TCA cycle proteins”, Science, 2022, 375(6586), 1254-1261.
- X. Chen et al., “Copper homeostasis and copper-induced cell death in the pathogenesis of cardiovascular disease and therapeutic strategies”, Cell Death Dis., 2023, 14(2), 105.
- W. Y. Chan et al., “Cell culture studies of Menkes kinky hair disease”, Clin. Chim. Acta., 1978, 88(3), 495-507.
- L. Chen et al., “Copper homeostasis and cuproptosis in health and disease”, Signal Transduct Target Ther., 2022, 7(1), 378.
Fig. 1 was reprinted from Reference 2).
Copyright © X. Chen et al. licensed under CC BY 4.0.