小社が立地する熊本県の生命科学研究最前線を、熊本大学の若手研究者が連載(8回)でお届けします。
最長寿・老化耐性齧歯類ハダカデバネズミの細胞老化制御機構
Cellular senescence regulation mechanisms in the longest-lived rodent, the naked mole-rat

河村 佳見
熊本大学
大学院生命科学研究部
老化・健康長寿学講座
助教

岡 香織
熊本大学
大学院生命科学研究部
老化・健康長寿学講座
助教

三浦 恭子
熊本大学
大学院生命科学研究部
老化・健康長寿学講座
教授
Abstract Naked mole-rats (NMRs) exhibit exceptional longevity and resistance to age-related diseases such as cancer. Unlike other long-lived species, NMRs can be maintained in laboratory settings, making them a valuable model for studying aging resistance and cancer resistance. We recently identified a species-specific mechanism in NMRs that prevents accumulation of senescent cells. Upon cellular senescence induction, NMR fibroblasts undergo delayed and progressive cell death mediated by the INK4a-RB pathway, a phenomenon absent in mouse fibroblasts. NMR fibroblasts uniquely accumulate serotonin and are sensitive to hydrogen peroxide (H2O2). After activation of the INK4a-RB pathway, NMR fibroblasts increased monoamine oxidase levels, leading to serotonin oxidization which produces H2O2, resulting in increased intracellular oxidative damage and cell death activation. In the NMR lung, cellular senescence similarly triggered monoamine oxidase-mediated cell death, preventing senescent cell accumulation. These findings suggest that INK4a-RB-mediated cell death likely acts as a natural senolytic mechanism in NMRs, contributing to their resistance to aging and age-related diseases.
1. はじめに
近年の解析技術の進歩により、従来のモデル動物にはない有用な形質、特に長寿命や老化関連疾患耐性をもつ生物種を研究対象として、がんや老化の予防機構を探索する試みが盛んになっている。中でもハダカデバネズミは、マウスと同程度の大きさの小型齧歯類でありながら、最大寿命が40年の最長寿齧歯類であり、顕著な老化耐性と強いがん化耐性を示す。加えて、ゾウやクジラ、コウモリなどの他の長寿/がん化耐性動物と比べ、実験室での飼育方法がほぼ確立されており、革新的ながん・老化の予防・治療方法を開発するための新たな実験動物として非常に注目されている。本稿では、ハダカデバネズミの細胞老化とその制御機構に関する最新の研究成果を紹介する。
2.ハダカデバネズミとは
ハダカデバネズミ(Naked mole-rat、Heterocephalus glaber、デバ、図1左)は、アフリカ東部(エチオピア・ケニア・ソマリア)のサバンナの地下に生息する齧歯類である。哺乳類では極めて珍しい、昆虫のアリやハチに類似した分業制の社会構造(真社会性)(図1右)をもち、数十匹から100匹以上でコロニーを形成し、集団生活を営む。デバは体長8–11 cm、体重約40 gとマウスと同程度の体格ながら、その寿命はマウスの約10倍(最大寿命40年)であり、齧歯類の中で最も長命である。さらに、個体老化の指標として重要な加齢に伴う死亡率の上昇が認められず、各種生理機能(活動量・繁殖能力・心臓拡張機能・血管機能など)の加齢による低下が起こりにくいという老化耐性を示す1, 2)。また、2000例以上の剖検で、自然発生腫瘍は数例しか確認されていない3, 4)。近年、私達はデバに化学発がん剤である3-メチルコラントレンもしくはDMBA(7,12-dimethylbenz[a]anthracene)/TPA(12-O-tetradecanoylphorbol-13-acetate)を投与し発がん誘導を行ったが、2年以上の長期にわたって全例で腫瘍の発生は認められなかった5)。以上より、顕著な発がん耐性を持つ動物種であると言える。これらの特徴からデバは、老化やがんを含む加齢性疾患の「予防法」の開発につながる実験動物として、分子生物学的研究が盛んになってきた。

繁殖は女王と繁殖オスのみに限られ、その他の下位個体は性成熟が抑制されている。下位個体は巣内の様々な仕事を行う。
3.デバにおける細胞老化
細胞老化とは、様々なストレスによって引き起こされる不可逆的な細胞の分裂停止状態であり、異常細胞の増殖抑制に寄与する。一方、加齢に伴い老化細胞が組織中に蓄積すると、老化細胞は多様な炎症性サイトカインなどを周囲に分泌する。この現象はsenescence-associated secretory phenotype (SASP)と呼ばれ、周囲の組織に炎症反応を誘発し、がんをはじめとする様々な加齢性疾患を促進することが知られている。近年では、老化細胞の除去によって老化形質を改善すべく、世界中で競ってsenolytic drug(老化細胞除去薬)の開発が進められている。それでは、老化耐性を示すデバで細胞老化は起こっているのだろうか。
3.1 デバ細胞の細胞老化
デバの線維芽細胞は、増殖速度は遅いながらも200日の間テロメアの短縮も見られず永続的に増殖する、つまり、複製老化を示さないことが報告されている6)。これは異常細胞の増殖抑制に寄与する細胞老化の役割を考えると、がん抑制にはマイナスに働くことが予想される。一方で、デバの線維芽細胞は種特異的に高発現している高分子量ヒアルロン酸により、ヒトやマウスよりもかなり低い細胞密度で早期接触阻害を示して増殖停止すると言われており7)、このような性質ががん抑制に寄与している可能性がある。さらに、高分子量ヒアルロン酸は、デバ線維芽細胞への恒常活性化型Ras(HRAS-V12)とsimian virus 40ラージT抗原(SV40LT)の導入による形質転換および免疫不全マウスへ移植後の造腫瘍性を抑制することも示され、デバ特異的ながん抑制因子の1つであると考えられている8)。しかし、高分子量ヒアルロン酸の有無に関わらずHRAS-V12およびSV40LTの導入のみで形質転換が起こるという相反する報告もあり、デバの細胞が遺伝子導入による発がん誘導にどの程度抵抗性をもつかは現在議論がある9, 10)。
また、最近デバの骨髄から単離された間葉系幹細胞(MSC)について、培養90日目には細胞老化の特徴を示し増殖が停止するが、その後自発的に不死化して増殖を再開したことが報告されている11)。デバMSCは早期接触阻害を示さないこと、また、高分子量ヒアルロン酸を作るHAS2の発現が低く、ヒアルロン酸分解酵素HYAL3の発現が高いことから、おそらく高分子量ヒアルロン酸の量が少ないために、デバ線維芽細胞と比べ不死化しやすい可能性があると述べられている。しかし、先述のデバ線維芽細胞が200日もの間増殖し続けたことを考えると、培養下のストレスによってデバ線維芽細胞でも不死化細胞が出現していた可能性が考えられる。デバ線維芽細胞で複製老化が起こらないと報告したグループは、発生過程の細胞老化および線維芽細胞へのがん遺伝子導入や放射線照射による細胞老化については、マウスと同様にデバでも起こることを報告している12)。これらのことから、デバ線維芽細胞は早期接触阻害や高分子量ヒアルロン酸の産生など種特異的な特徴を持つ一方、マウスと同様のストレスにより細胞老化を起こしうると考えられる。
3.2 デバ細胞特有の細胞老化
私達はこれまでに、デバ線維芽細胞において、iPS細胞を作製する際の初期化誘導時やがん原遺伝子c-Mycの活性化時にがん抑制因子ARFをノックダウンすると、マウスやヒト線維芽細胞では見られない細胞老化(ASIS: ARF suppression-induced senescence)を起こすことを発見した13)。ARFの抑制というヒトやマウスではがん化につながるような事象が生じた場合、ASISという種特有の細胞老化を起こし、がん化の危機を回避している可能性がある。また、デバ線維芽細胞では細胞接着やWntシグナルに関与するβ-cateninが高発現しており、そのノックダウンにより細胞老化が起こることが報告されている14)。このように、デバ線維芽細胞はマウスと同様のストレスに加え、デバ特異的な状況下でも細胞老化を起こすことがわかってきている。
4.デバにおける細胞老化制御機構
デバ細胞は様々な状況で細胞老化を起こす。一方で、加齢したデバの脳、筋肉、脂肪、皮膚組織では、老化細胞の指標となるINK4a遺伝子の発現が低い15,16)。デバには老化細胞の蓄積を抑制する何らかの機構があるのだろうか。
4.1 DNA 傷害耐性
DNA傷害は細胞老化を引き起こす要因の一つだが、デバの細胞はDNA傷害に耐性をもつことが報告されている。デバ線維芽細胞にγ線を照射し、DNA傷害による細胞老化を誘導した際、デバ線維芽細胞はマウスと比較してアポトーシスを起こしにくかった12)。私達もデバ新生仔の脳から神経幹/前駆細胞(NSPC: Neural stem/progenitor cell)を単離・培養し、マウスNSPCよりもDNA損傷への抵抗性が高いことを明らかにした17)。放射線照射によるDNA損傷は主にDSBだと考えられるが、近年、デバを含む様々な寿命の齧歯類18種の線維芽細胞の比較解析から、DSBの修復能が最大寿命と相関することが報告されている18)。この研究では、DSB修復に寄与するSIRT6の活性が種によって異なり、デバを含む長寿の齧歯類はマウスなどの短命種よりSIRT6の活性が高いことを明らかにした。このようなデバ細胞のDNA傷害耐性は、細胞老化の出現抑制に寄与している可能性がある。
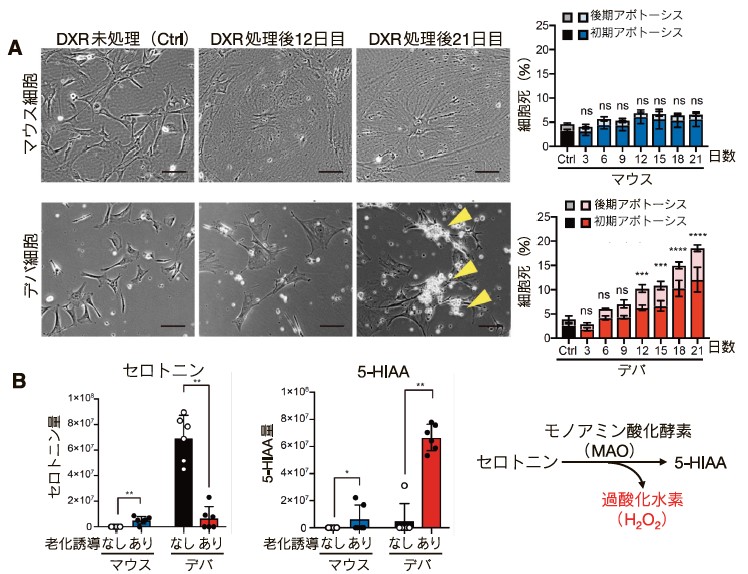
(A)マウス及びデバ線維芽細胞に、低濃度のドキソルビシン(DXR)を添加して細胞老化を誘導した細胞の写真(左)。黄色矢印は死細胞を示す。日数が経過するにつれて、デバ細胞のみで初期及び後期アポトーシスを含む細胞死が有意に増加した(右)。ns: 有意差なし。*: 有意差あり。
(B) マウス及びデバ線維芽細胞に、INK4aを強制発現して細胞老化を誘導し、セロトニン及び5-HIAA量を解析。細胞老化誘導していないデバ線維芽細胞ではセロトニン量が多く、細胞老化誘導後は5-HIAA量が多かった(左)。セロトニンはモノアミン酸化酵素により代謝されて5-HIAAになる。その際、大量のH2O2が生じる(右)。(文献16より改変引用)
4.2 デバ特有の老化細胞の細胞死
デバ細胞は様々な状況下で細胞老化を起こすが、その長期的な挙動は明らかになっていない。私達はデバにおける老化細胞の動態を調べるため、マウスおよびデバ線維芽細胞にDNA傷害剤であるドキソルビシンを低濃度添加し、細胞老化を誘導して経時的に解析した16)。その結果、両者で細胞老化の特徴が見られたが、デバではアポトーシスを含む細胞死が徐々に増加することを発見した(図2A)。一般的に老化細胞は細胞死抵抗性になることが知られており、このような細胞死はマウスやヒトではみられない。また、この細胞死はアポトーシスに重要なp53経路には非依存的であり、細胞老化に重要なINK4a-RB経路が活性化することで誘導されていることがわかった。
細胞老化を誘導すると、デバもマウスもINK4a-RB経路が活性化するのにもかかわらず、なぜデバのみに細胞死が引き起こされるのだろうか。細胞老化誘導後の代謝産物を調べたところ、興味深い現象を見出した。細胞老化を起こしていない通常のデバ線維芽細胞には、マウスでは見られないセロトニンの蓄積が生じている一方、細胞老化するとセロトニンが減少し、その代謝産物である5- ヒドロキシインドール酢酸(5-HIAA: 5-hydroxyindoleacetic acid)が増加したのである(図2B左)。セロトニンから5-HIAAへの代謝経路では、モノアミン酸化酵素(MAO: monoamine oxidase)が働き、過酸化水素(H2O2: hydrogen peroxide)を同時に産生することが知られている(図2B右)。実際、マウスとは異なり、細胞老化を誘導したデバ細胞ではMAOのタンパク質量が増加していた。また、H2O2を含む活性酸素種(ROS: reactive oxygen species)レベルも上昇していた。デバはH2O2を水に還元するグルタチオンペルオキシダーゼの活性が著しく低く19, 20)、マウス線維芽細胞に比べてH2O2に顕著な脆弱性を示すことが報告されている21)。そのため、老化誘導時にセロトニン代謝経路の活性化により細胞内で生じるH2O2によって、デバのみに細胞死が引き起こされている可能性が考えられた。そこで、細胞老化を誘導後、ROSを抑制する抗酸化剤、もしくはMAO阻害剤を添加したところ、デバの細胞死が有意に抑制された。これらの結果から、細胞老化時にINK4a-RB経路が活性化すると、細胞内でデバ特異的なMAOの発現上昇によりH2O2の産生を伴うセロトニン代謝が亢進し、生来的な細胞のH2O2への脆弱性と協調して、細胞死が生じていることが明らかになった(図3)。
さらに、デバ生体内でも同様の機構が働いているのかを解析するため、マウスおよびデバにDNA傷害剤であるブレオマイシンを気管内投与し、肺に細胞老化を誘導した。その結果、ブレオマイシン投与による急性の細胞死はマウスとデバの両者で見られたが、マウスでは老化細胞の蓄積が見られる投与後21日目において、デバでのみ細胞死が増加した。この増加した細胞死がMAO依存的かを調べるために、MAO阻害剤を投与したところ、細胞死が抑制され、老化細胞が増加した。これらのことから、生体内でもMAOを介した細胞死が、老化細胞の蓄積抑制に寄与していると考えられる。
このデバ特有のINK4a-RB活性化時のMAOを介した細胞死により、老化細胞の蓄積が抑制されることが、デバにおける組織の慢性炎症抑制や老化抑制、ひいては発がん抑制の一因となっている可能性がある。先述したように近年、老化状態を改善するためのsenolytic drugの開発が進められているが、老化細胞が生体の恒常性維持に寄与する面も報告されており22, 23)、老化細胞除去の安全性についてはさらなる検証が必要である。デバは進化の過程で、種特有の生来的な老化細胞を除去する性質を獲得したと考えられ、安全性の高い老化細胞除去システムを獲得していると推測される。デバにおける老化細胞除去機構の研究を発展させることで、どのような老化細胞をいつ、どのように除去するべきかなど、より安全なsenolytic drugの開発へ貢献できるかもしれない。
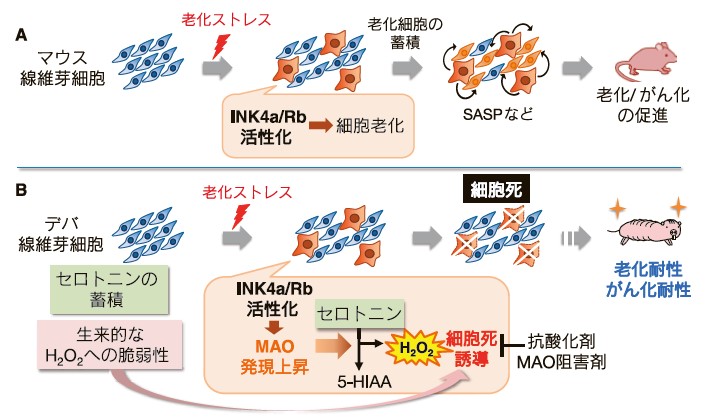
(A)マウス細胞では老化ストレスによりINK4a-Rbが活性化すると、細胞老化が生じる。老化細胞が蓄積することにより、老化やがん化が促進される。
(B)デバ細胞では老化ストレスによりINK4a-RBが活性化すると、モノアミン酸化酵素(MAO)が発現上昇し、蓄積していたセロトニンが5-HIAAに代謝される。その際に産生される過酸化水素(H2O2)と生来的なH2O2への脆弱性が協調的に働くことで、細胞死が誘導される。本機構による老化細胞の蓄積抑制が、老化耐性やがん化耐性に寄与している可能性がある。
5. おわりに
本稿では、デバにおける細胞老化とその制御機構について紹介した。老化耐性齧歯類であるデバの細胞でも細胞老化は生じる。しかし、デバ線維芽細胞はDSBの修復活性が高いと考えられるため、もともと生体内で老化細胞が出現しにくい可能性がある。加えて、DNA傷害による細胞老化が生じた場合、少なくとも肺においては老化細胞で細胞死が誘導され、老化細胞の蓄積が抑制されていると考えられる。デバは、本稿で述べた機構および未発見の機構で細胞老化を制御し、健康長寿を実現しているのかもしれない。紙面の都合上割愛したが、デバの健康長寿は、細胞老化制御に加えて、多岐にわたる要素が複合的に作用することで実現していると考えられる。現在、内因性の炎症の減弱5, 24)や免疫系の特殊性25, 26)、翻訳正確性27)、タンパク質安定性28)、代謝制御など多様な切り口から研究が進められている。近年、様々な長寿動物の解析が可能になったが、組織や個体を用いた研究はいまだ少なく、デバが実験室で飼育・繁殖でき、個体を用いた解析も可能である利点は大きい。発生工学技術の開発は困難が予想されるが、将来的にデバ個体の遺伝子改変が実現することで、より核心に迫った研究が進展すると期待される。
【参考文献】
- R. Buffenstein, “Negligible senescence in the longest living rodent, the naked mole-rat: insights from a successfully aging species”, J. Comp. Physiol. B., 2008, 178(4), 439-445.
- J. G. Ruby et al., “Naked mole-rat mortality rates defy gompertzian laws by not increasing with age”, Elife, 2018, 7, e31157.
- Y. H. Edrey et al., “Successful aging and sustained good health in the naked mole rat: A long-lived mammalian model for biogerontology and biomedical research”, ILAR J., 2011, 52(1), 41-53.
- M. A. Delaney et al., “Initial Case Reports of Cancer in Naked Mole-rats (Heterocephalus glaber)”, Vet. Pathol., 2016, 53(3), 691-696.
- K. Oka et al., “Resistance to chemical carcinogenesis induction via a dampened inflammatory response in naked mole-rats”, Commun. Biol., 2022, 5(1), 287.
- A. Seluanov et al., “Distinct tumor suppressor mechanisms evolve in rodent species that differ in size and lifespan”, Aging Cell, 2008, 7(6), 813-823.
- A. Seluanov et al., “Hypersensitivity to contact inhibition provides a clue to cancer resistance of naked mole-rat”, Proc. Natl. Acad. Sci. U. S. A., 2009, 106(46), 19352-19357.
- X. Tian et al., “High-molecular-mass hyaluronan mediates the cancer resistance of the naked mole rat”, Nature, 2013, 499(7458), 346-349.
- F. Hadi et al., “Transformation of naked mole-rat cells”, Nature, 2020, 583(7814), E1-E7.
- J. Zhao et al., “Reply to: Transformation of naked mole-rat cells”, Nature, 2020, 583(7814), E8-E13.
- S. Emmrich et al., “Characterization of Naked Mole-Rat Mesenchymal Stromal Cells: Comparison with Long- and Short-Lived Mammals”, Aging Biol., 2024, 2, e20240029.
- Y. Zhao et al., “Naked mole rats can undergo developmental, oncogene-induced and DNA damage-induced cellular senescence”, Proc. Natl. Acad. Sci. U. S. A., 2018, 115(8), 1801-1806.
- S. Miyawaki et al., “Tumour resistance in induced pluripotent stem cells derived from naked mole-rats”, Nat. Commun., 2016, 7, 11471.
- W.-Y. Chee et al., “β-catenin-promoted cholesterol metabolism protects against cellular senescence in naked mole-rat cells”, Commun. Biol., 2021, 4(1), 357.
- B. P. Lee et al., “Negligible senescence in naked mole rats may be a consequence of well-maintained splicing regulation”, Geroscience, 2020, 42(2), 633-651.
- Y. Kawamura et al., “Cellular senescence induction leads to progressive cell death via the INK4a-RB pathway in naked mole-rats”, EMBO J., 2023, 42(16), 1-19.
- Y. Yamamura et al., “Isolation and characterization of neural stem/progenitor cells in the subventricular zone of the naked mole-rat brain”, Inflamm. Regen., 2021, 41(1), 31.
- X. Tian et al., “SIRT6 is responsible for more efficient DNA double-strand break repair in long-lived species”, Cell, 2019, 177(3), 622-638.e22.
- B. Andziak et al., “Antioxidants do not explain the disparate longevity between mice and the longest-living rodent, the naked mole-rat”, Mech. Ageing Dev., 2025, 126(11), 1206-1212.
- M. V. Kasaikina et al., “Reduced utilization of selenium by naked mole rats due to a specific defect in GPx1 expression”, J. Biol. Chem., 2011, 286(19), 17005-17014.
- A. B. Salmon et al., “Fibroblasts from naked mole-rats are resistant to multiple forms of cell injury, but sensitive to peroxide, ultraviolet light, and endoplasmic reticulum stress”, J. Gerontol. A Biol. Sci. Med. Sci., 2008, 63(3), 232-241.
- M. Demaria et al., “An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA”, Dev. Cell., 2014, 31(6), 722-733.
- N. S. Reyes et al., “Sentinel p16INK4a+ cells in the basement membrane form a reparative niche in the lung”, Science, 2022, 378(6616), 192-201.
- Z. Zhang et al., “Increased hyaluronan by naked mole-rat Has2 improves healthspan in mice”, Nature, 2023, 621(7977), 196-205.
- T. D. Lin et al., “Evolution of T cells in the cancer-resistant naked mole-rat”, Nat. Commun., 2024, 15(1), 3145.
- G. Sanchez Sanchez et al., “Invariant γδTCR natural killer-like effector T cells in the naked mole-rat”, Nat. Commun., 2024, 15(1), 1-17.
- J. Azpurua et al., “Naked mole-rat has increased translational fidelity compared with the mouse, as well as a unique 28S ribosomal RNA cleavage”, Proc. Natl. Acad. Sci. U. S. A., 2013, 110(43), 17350-17355.
- V. I. Perez et al., “Protein stability and resistance to oxidative stress are determinants of longevity in the longest-living rodent, the naked mole-rat”, Proc. Natl. Acad. Sci. U. S. A., 2009, 106(9), 3059-3064.
| [ 著者プロフィール ] | |
| 氏名 | 河村 佳見(Yoshimi Kawamura) |
|---|---|
| 所属 |
熊本大学大学院生命科学研究部 老化・健康長寿学講座 〒860-0811 熊本県熊本市中央区本荘2-2-1 TEL:096-373-6852 FAX:096-373-6852 |
| 出身学校 | 九州大学 |
| 学位 | 博士(理学) |
| 専門分野 | 発生工学 |
| 現在の研究テーマ | 最長寿齧歯類ハダカデバネズミの発生工学技術の開発 |
| [ 著者プロフィール ] | |
| 氏名 | 岡 香織(Kaori Oka) |
|---|---|
| 所属 |
熊本大学大学院生命科学研究部 老化・健康長寿学講座 〒860-0811 熊本県熊本市中央区本荘2-2-1 TEL:096-373-6852 FAX:096-373-6852 |
| 出身学校 | 北海道大学 |
| 学位 | 博士(生命科学) |
| 専門分野 | 比較動物学 |
| 現在の研究テーマ | 長寿動物が有する抗老化・抗疾患メカニズムの探索 |
| [ 著者プロフィール ] | |
| 氏名 | 三浦 恭子(Kyoko Miura) |
|---|---|
| 所属 |
熊本大学大学院生命科学研究部 老化・健康長寿学講座 〒860-0811 熊本県熊本市中央区本荘2-2-1 TEL:096-373-6852 FAX:096-373-6852 |
| 出身学校 | 奈良女子大学 |
| 学位 | 博士(医学) |
| 専門分野 | 長寿生物医科学 |
| 現在の研究テーマ | ハダカデバネズミの体と社会の「健康長寿」システムの理解と応用 |