腫瘍微小環境におけるメトホルミンの影響
株式会社同仁化学研究所 山本奈緒子
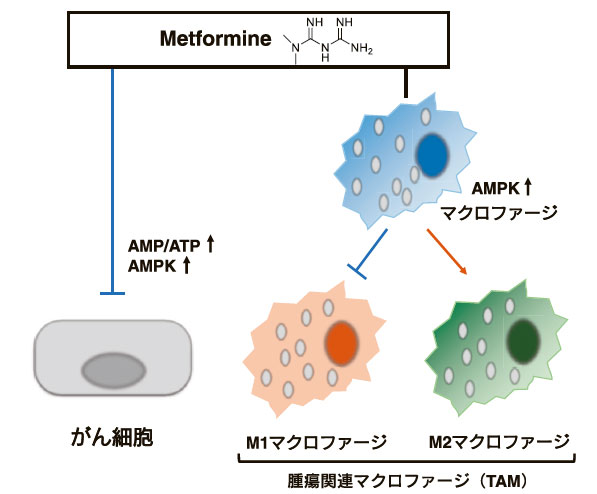
がん細胞はワールブルグ効果により解糖系に依存してエネルギー産生を行っており、糖を取り込み、解糖系の亢進によって乳酸を産生している。さらに、その腫瘍微小環境は、低酸素、低pH、低栄養な環境であることが知られている。また、免疫細胞が機能を発揮するには糖を栄養として必要としているため、がん細胞と免疫細胞間では、糖を巡る代謝競合が起こってしまう。これまでも解糖系阻害剤を用いた抗がん剤の開発が行われてきたが、がん細胞だけでなく免疫細胞の解糖系も低下させてしまう等の課題があり、未だ有効な抗がん剤の開発には至っていなかった。2型糖尿病治療薬であるメトホルミンを服用している糖尿病患者では、前立腺、膀胱、子宮頸、食道、胃、頭頸部、口腔、肺、卵巣、甲状腺のがん罹患リスクの低下が報告されている1)。メトホルミンがミトコンドリア複合体Ⅰ(ComplexⅠ)を阻害することによって、細胞のAMP/ATP比が増加し、最終的には細胞のエネルギー恒常性維持に寄与するAMPKを活性化し、腫瘍の進行を抑制するというものである2)。本稿では、メトホルミンの抗腫瘍効果が腫瘍微小環境である腫瘍関連マクロファージ(TAM)やリンパ球などの免疫細胞にも影響を及ぼす可能性について紹介する3)。
がん組織に浸潤しているマクロファージであるTAMは、M1とM2に分極される。M1マクロファージは、がん細胞の増殖や転移を抑制し、炎症を促進する作用を持っている。また、M2マクロファージは、がん細胞の増殖や転移を促進し、炎症を抑制する作用を持っている。メトホルミンは、TAMにおいて炎症性サイトカインの発現を減少させる一方で、抗炎症性サイトカインの発現を増加させた4)。メトホルミン処理したマクロファージとがん細胞を共培養した条件においては、抗炎症性のM2マクロファージの増加がみられなかった5)。このようなメトホルミン治療によって起こる変化から、メトホルミンが腫瘍微小環境の機能に間接的な影響を及ぼす可能性が示唆された(図1)。
リンパ球T細胞の一種で、がん細胞などを認識して破壊する細胞傷害性T細胞は、受容体PD-1を持ち、がん細胞表面に発現しているPD-L1によって疲弊する。その疲弊した細胞傷害性T細胞によって、免疫抑制が起こり、がん細胞が生存する6)。また、メトホルミンによって活性化されたAMPKが、PD-L1のS195を直接りん酸化することで、折りたたみ構造をとれなくなり、ERAD(小胞体関連分解)を引き起こす。その結果、がん細胞表面のPD-L1が減少し、細胞傷害性Tリンパ球の効果を高めた7)。
最近の研究において、鵜殿らはメトホルミンと免疫チェックポイント阻害薬である抗PD-1抗体を併用した治療によって、細胞傷害性T細胞の腫瘍内への流入を促進し、抗腫瘍効果を改善する可能性を報告している8)。
今回紹介した報告では、メトホルミンはがん細胞の増殖を阻害する以外にも、腫瘍微小環境を調節することによって腫瘍の進行に影響を及ぼす可能性があることが明らかとなった。メトホルミンの作用機序が明らかになりつつある現在、がん細胞だけでなく、腫瘍微小環境の非悪性細胞集団においても研究が進むことで、新たな治療法の開発が進むことを期待している。
【参考文献】
- L. Connor et al., “Association of metformin use and cancer incidence: a systematic review and meta-analysis”, Journal of the National Cancer Institute, 2024, 116(4), 518-529.
- W. Wheaton et al., “Metformin inhibits mitochondrial complex I of cancer cells to reduce tumorigenesis”, elife, 2014, 3, e02242.
- K. Inava et al., “The multifaceted effects of metformine on tumor microenvironment”, Semin. Cell Dev. Biol., 2020, 98, 90-97.
- Z. Yan et al., “Metformin suppresses UHMWPE particle-induced osteolysis in the mouse calvaria by promoting polarization of macrophages to an anti-inflammatory phenotype”, Mol. Med., 2018, 24( 20), s10020-018-0013-x.
- M. Chen et al., “Metformin affects the features of a human hepatocellular cell line (HepG2)by regulating macrophage polarization in a co-culture microenviroment”, Diabetes Metab. Res. Rev., 2015, 31(8), 781-789.
- M. Nishino et al., “Monitoring immune-checkpoint blockade: response evaluation and biomarker development”, Nat. Rev. Clin. Oncol., 2017, 14, 655-668.
- J. Cha et al., “Metformin promptes antitumor immunity via endoplasmic-reticulum-associated degradation of PD-L1”, Mol. Cell, 2018, 71(4), 606-620.
- M. Tokumasu et al., “Metformin synergizes with PD-1 blockade to promote normalization of tumor vessels via CD8T cells and INFγ”, Proc. Natl. Acad. Sci., 2024, 121(30), e2404778121.