RNA修飾病と修飾ヌクレオシド
RNA modopathy and modified nucleosides
 |
永芳 友 熊本大学大学院 生命科学研究部 特任助教 |
 |
富澤 一仁 熊本大学大学院 生命科学研究部 教授 |
Abstract
More than 100 chemical modifications of RNA have been reported in bacteria, archaea, and eukaryotes.
RNA modifications are involved in various biological functions, especially protein synthesis.
Moreover, the deficits of these modifications cause various diseases, such as type 2 diabetes,
mitochondrial myopathy, and intellectual disability. We also focus on the metabolites of modified RNA.
The modified nucleosides have many physiological functions and potential for biomarker of diseases. In
this topic, we introduce about (1) the relationships between FTSJ1, a human tRNA
2′-O-methyltransferase and X-linked intellectual disability (XLID) and (2) the efficacy of
modified nucleosides as a potential biomarker for COVID-19.
1.はじめに
2023年、ノーベル生理学・医学賞の栄誉に輝いたのはカタリン・カリコ博士とドリュー・ワイスマン博士であった。両氏の受賞理由は新型コロナウイルス感染症に対する効果的なmRNAワクチンの開発を可能にしたヌクレオシド塩基修飾に関する発見である。2019年より世界的大流行を来したCOVID-19の原因ウイルスであるSARS-CoV-2に対して、本知見による迅速なmRNAワクチン開発により世界中がその恩恵に預かった。このワクチン開発の中心的な役割を果たしたのが、RNAの化学修飾である。mRNAワクチンの内部にはウリジンの修飾塩基であるN1-メチルシュードウリジン(m1Ψ)が挿入されることで、宿主の外部RNAに対する免疫活性が抑制され、ワクチンとしての役割を果たした(図1)。現在、RNAの化学修飾は、全生物において100種類以上報告されている。我々はこれまでに、RNAの化学修飾がタンパク質合成を中心としたさまざまな生命現象と密接に関係していることに加え、修飾酵素欠損による疾患発症メカニズムを明らかにしてきた。また現在は、これら修飾を受けたRNAが最終的に単一ヌクレオシドまで分解され、修飾ヌクレオシドは積極的に細胞外へ分泌される現象に注目している。今回は、RNA修飾の重要性とその代謝物である修飾ヌクレオシドに関する知見を紹介する。
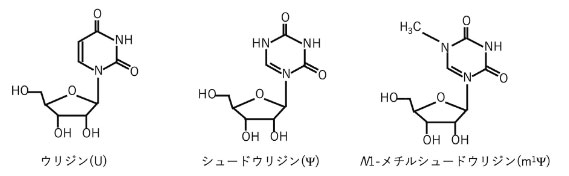
図1 mRNA ワクチンに使用されたRNA修飾の一例
2.RNA修飾の重要性とRNA修飾病
ヌクレオシドとは前述にもあるRNAの構成要素であるアデノシン・グアノシン・シチジン・ウリジンを指す。RNAはDNAより転写されるため、DNAと同様4つの塩基の羅列であると考えられていた。1957年に、RNAの加水分解産物から5つ目の塩基としてウリジンの化学修飾塩基であるシュードウリジンが発見されたことでRNA修飾、またはエピトランスクリプトームと呼ばれる研究領域が産声をあげた1)。これらRNA修飾は、質量分析器の測定技術向上に伴い、現在約150種類にも及ぶことが明らかとなった(図2)2)。現在も新たなRNA修飾様式が報告され続けている。
特にRNA修飾が高度に付与されるのは、アミノ酸を運搬することが主たる役割である転移RNA (tRNA)である3)。tRNAにおける化学修飾はtRNAの構造維持やタンパク質合成の効率に寄与する。特に我々が最近報告した知見として、tRNAメチル化酵素であるFTSJ1について解説する4)。FTSJ1は、FtsJと呼ばれる大腸菌rRNAメチル化酵素のヒトにおけるホモログである。この遺伝子は進化の過程で保存されており、酵母のホモログはTrm7で、tRNAのメチル化酵素である。またFTSJ1遺伝子は、ヒトにおいてX染色体上に存在し、機能喪失型変異によりX染色体連鎖性精神遅滞(XLID)が発症することが報告されていたが、その発症メカニズムは未解明のままであった。我々はFtsj1欠損マウスを作成し、FTSJ1によるメチル化を受けるtRNAを明らかにした。またFTSJ1による修飾部位がtRNAの32位と34位とアンチコドンおよびその周辺部位であったため、Ftsj1欠損に伴う修飾欠損はコドン特異的な翻訳効率変化を引き起こすと考えた。我々は本仮説を実証するためリボソームプロファイリング法を用い、Ftsj1欠損マウスの脳内でのコドン特異的な翻訳効率評価を行った。その結果、Ftsj1欠損マウスの脳内では、FTSJ1が修飾を付与するフェニルアラニンtRNAで有意に翻訳効率が低下していた。またtRNAの化学修飾はtRNAを分解から保護することが知られている。Ftsj1欠損マウスの脳内においてフェニルアラニンtRNAが積極的に断片化されていた。これらの結果からFtsj1の欠損により、フェニルアラニンtRNAの分解に起因するmRNAのフェニルアラニンコドンにおけるリボソームの停滞を介して、コドン特異的に翻訳効率を低下させていることを明らかにした。加えて、脳で翻訳効率の低下していた遺伝子に関してGene Ontology解析を行ったところ神経伝達や神経分化に関連する遺伝子が多く検出された。
またFtsj1欠損マウスの神経組織の形態学的評価を行った。古典的な神経細胞染色法であるゴルジ染色を行うと、樹状突起スパインにthin型の未熟なスパインが増加していた。電子顕微鏡写真でも同様にシナプス後肥厚(PSD)の有意な狭小化が観察された。これらの結果から、前述の翻訳効率低下に伴い、Ftsj1欠損マウスに形態学的異常が引き起こされていることが推察された。加えてFtsj1欠損マウスの脳スライス用いて、電気生理学的評価を行った。具体的には長期増強および長期抑圧という、学習機能と関連する反応に関して評価を行ったところ、Ftsj1欠損マウスにおいて長期増強および長期抑圧共に有意に低下していた。この結果からFtsj1欠損に伴う神経伝達機能異常が明らかになった。最後に、Ftsj1欠損マウスを用いてバーンズ迷路試験および恐怖条件付け記憶を実施したところ、有意に学習機能が障害されていることが明らかになった。
以上より、我々はRNA修飾が欠損することでコドン特異的にタンパク質合成障害が惹起され、その結果形態学的および電気生理学的異常を伴いながら学習障害という表現型に繋がっていることを明らかにした(図3)。我々は、これまでにもRNA修飾欠損に伴うアジア人型2型糖尿病やミトコンドリア脳筋症の発症機構を解き明かし5,6)、これらRNA修飾欠損に伴う疾患をRNA修飾病(RNA modopathy)と呼称した。今後も新たな疾患メカニズム解明を探究していきたい7)。
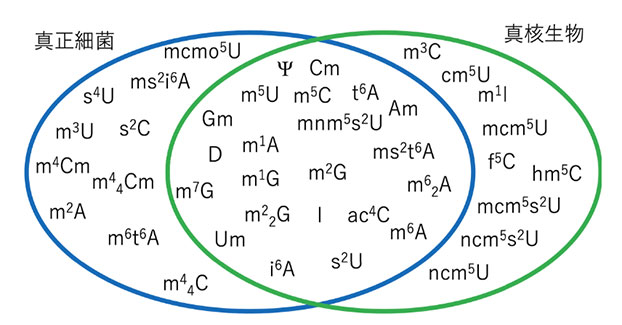
図2 多彩なRNA修飾
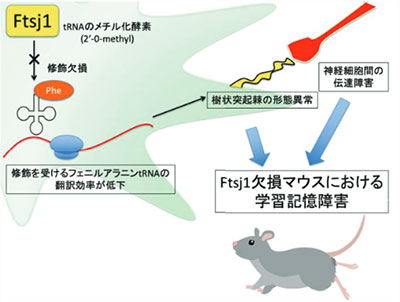
図3 Ftsj1欠損による学習記憶障害メカニズム
3.修飾ヌクレオシド排泄現象
これまでに世界中のグループが100種類を超えるRNA修飾および修飾酵素を報告し、研究を行ってきた。その過程でRNAに対する脱修飾酵素はほとんど報告がなかった。我々は一度修飾を受けたRNAの転帰に着目した。その結果、RNAは細胞内で一定期間経過すると単一ヌクレオシドまで分解され、無修飾ヌクレオシドは細胞内で再利用されるが修飾を担うヌクレオシドは積極的に細胞外へ排泄されることを明らかにした。特に哺乳動物においては平衡型ヌクレオシドトランスポーター(ENTs)を介して排泄されていた8)。ENTはこれまでに1-4までサブタイプが報告されており、ENT1および2が修飾ヌクレオシド排泄に積極的に関与していた。また修飾ヌクレオシドは単なる分解産物ではなく、N 6- メチルアデノシン(m6A)は細胞外に排泄された後アデノシン受容体の真のリガンドとして機能することが明らかとなった9)。また培養細胞へのN 6- イソペンテニルアデノシン(i6A)の添加は細胞内RNAへのi6A取り込みを引き起こし、抗腫瘍効果を発揮するなど、今後も修飾ヌクレオシドによるさまざまな生理活性の発見が期待される10,11)。またこれら修飾ヌクレオシドは細胞外へ排泄された後、哺乳動物では尿中へ多く排泄されていることを明らかにした。この点からもバイオマーカーとしての有用性が考えられる。次章でバイオマーカーとしての有用性に関する知見に関して解説する。
4.疾患バイオマーカーとしての修飾ヌクレオシド
修飾ヌクレオシドは積極的に細胞外へ排泄され、最終的に尿中に多く排泄される9)。この点に加え我々はRNA修飾の多種多様性に着目した。RNA修飾は種特異的なもの、多くの種で共有されているものが存在する。またHIVなどのウイルスでは宿主のRNA修飾酵素をハイジャックし、免疫逃避に関与していることが知られている12)。そこで、感染症に罹患すると、その病原に応じて修飾ヌクレオシド排泄が変化すると考えた。我々は2019年より世界中で流行を来したCOVID-19に着目し、バイオマーカーとなり得る修飾ヌクレオシドを同定したので、その知見に関して解説する13)。COVID-19はRNAウイルスの1種であるSARS-CoV-2による呼吸器感染症である。SARS-CoV-2内部のgenome RNAをナノポアシーケンスで解析したグループより、genome RNAに未知の化学修飾領域の存在が報告されていた。そのため、COVID-19患者では血中や尿中の修飾ヌクレオシド排泄状態が変化するのではないか?と仮説を立てた。まず我々は、バイオマーカーとなり得る候補物質を抽出するため、SARS-CoV-2をACE2過剰発現HEK293細胞に感染させ、抽出RNAを分解し修飾ヌクレオシドを網羅的に解析した。その結果、6種類の候補物質を明らかにした。その後、COVID-19感染患者の血清および尿中の修飾ヌクレオシドを解析したところ2種類の修飾ヌクレオシドが有意に上昇していた。また血清および尿中のこれら修飾ヌクレオシドは、重症度に応じて量が増え、症状改善に伴い低下した。また感染拡大に伴い、複数の変異株(α,β,δ)が出現したが、いずれの変異株の感染者でも同様に有意な上昇を認めた。血液や尿はSARS-CoV-2のウイルス粒子が検出されず感染リスクも低いことから、唾液や咽頭ぬぐい液と比較して安全に測定が可能である(図4)。今回の治験を基軸として今後は他の感染性疾患での修飾ヌクレオシド変化にも着目していきたい。
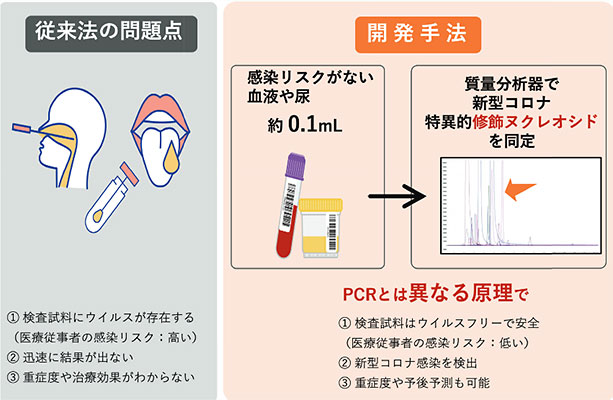
図4 修飾ヌクレオシド測定によるCOVID-19検査システム
5.まとめ
今回は、前半でRNA修飾の重要性からRNA修飾病について概説し、後半で修飾RNAの分解産物である修飾ヌクレオシドのバイオマーカーとしての有用性について紹介した。前半のRNA修飾病に関しては、まだ発症メカニズムまで解明されていない疾患も数多くあり、新たな診断法から治療法への展開が期待される。また後半の修飾ヌクレオシドに関しても感染症のみならず他の疾患での排泄変化や生理学的意義が明らかでないものが多数を占める。これらRNA修飾領域の研究展開に必須な事項として、これらRNA修飾および修飾ヌクレオシドをどのように評価していくか?という点である。これまでは質量分析機器によるRNA修飾の評価が主流であったが、ナノポアシーケンス法による配列と化学修飾の同時評価法の開発が日進月歩で進められている。各測定法の利点を把握した上で、より詳細な生命現象の解明に今後も尽力したい。
| [ 著者プロフィール ] | |
| 氏名 | 永芳 友 (Yu Nagayoshi) |
|---|---|
| 所属 | 熊本大学大学院生命科学研究部 加齢医学寄附講座 〒860-8556 熊本県熊本市中央区本荘1-1-1 TEL : 096-373-5164 FAX : 096-366-8458 |
| 出身学校 | 熊本大学 |
| 学位 | 博士(医学) |
| 専門分野 | RNA生物学、腎臓内科学 |
| 現在の研究テーマ | RNA修飾病、修飾ヌクレオシドと疾患 |
| [ 著者プロフィール ] | |
| 氏名 | 富澤 一仁 (Kazuhito Tomizawa) |
|---|---|
| 所属 | 熊本大学大学院生命科学研究部 分子生理学講座 〒860-8556 熊本県熊本市中央区本荘1-1-1 TEL : 096-373-5051 FAX : 096-373-5052 |
| 出身学校 | 岡山大学 |
| 学位 | 博士(医学) |
| 専門分野 | 分子生理学 |
| 現在の研究テーマ | RNA修飾病、修飾ヌクレオシドと疾患 |