細胞内相分離を理解するためのケミカルバイオロジー
Chemical Biology: Dissecting the physicochemical traits of phase separation inside cells
 |
雨森 翔悟 金沢大学 ナノマテリアル研究所 助教 |
 |
西山 嘉男 金沢大学 理工研究域 准教授 |
 |
添田 貴宏 金沢大学 理工研究域 准教授 |
 |
羽澤 勝治 金沢大学 新学術創成研究機構 准教授 |
Abstract
Biomolecules undergo liquid–liquid phase separation (LLPS) to spatiotemporally compartmentalize and
regulate diverse biological processes. Because of the limited numbers of tools to directly probe LLPS,
the physicochemical traits of phase-separated condensates remain largely elusive. Here, we introduce a
light-switching dipyrene probe (Pyr-A) that forms monomers in either hydrophobic or viscous
environments, and intramolecular excimers in aqueous solutions, which could characterize LLPS and
enhance our understanding of phase separation underlying biological functions.
1. はじめに
ゲノム計画が終了し、生物を構成する膨大な種類のタンパク質に関する情報が明らかとなった現代、細胞・組織内において時空間的にタンパク質の活性や相互作用が適切に調節され、生命システムを制御する仕組みを解明することが次世代生命科学の大きな課題である。従来、タンパク質は既定のアミノ酸配列から固有の構造を形成し、その構造によって機能を発現すると考えられてきた。一方、近年になって、タンパク質内に存在する、特定の構造をとらない天然変性領域(IDRs: Intrinsically Disordered Regions)の重要性が注目されている。このIDRsは液-液相分離(Liquid-Liquid Phase Separation(LLPS))による会合・集合体を促進し、複雑ながらも秩序ある高次構造体を形成することで、転写や翻訳など多くの生命現象と密接に関わっている(図1)。その一方で、不規則領域を構成するアミノ酸配列異常と相転移・相分離異常は、神経変性疾患やがんなどの病気が発症する要因となる1)。そのため、高次構造体LLPSの形成機序の基盤となる物理化学的性質を明らかにすることは生命現象の理解や疾病機序解明につながる重要な課題である。私たちは生物学、化学、理工学の異分野融合研究を推進し、相分離の粘性・極性変化を解析できる蛍光プローブの開発に取り組んでいる。本稿では、私たちが開発した第一世代蛍光プローブの成果について紹介したい。
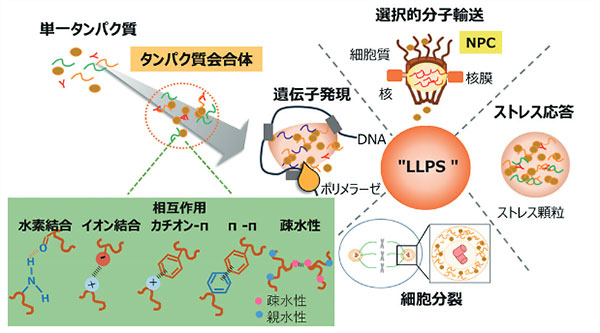
図1 IDRsが惹起するLLPSは生命反応を調節する基盤機構
2. 相分離生物学の更なる発展を阻む課題
これまでに、細胞内における相分離の理解に向けて、観測環境中に標的分子動態を解析できる光退色後蛍光回復法(FRAP:FFuorescence Recovery After Photobleaching)、ラベルした二分子間の蛍光共鳴エネルギー移動法(FRET:Fluorescence Resonance Energy Transfer)を評価する顕微鏡ベースの技術を用いた手法、核磁気共鳴(NMR:Nuclear Magnetic Resonance)による化学シフトを介して化学環境と二次構造を解析することで、核オーバーハウザー効果や常磁性弛緩増強を指標にした近接相互作用に基づく分子ダイナミクスを評価するアプローチが展開されている2)。これらの技術はいずれも、興味のあるタンパク質(POI:Protein of Interest)の拡散を評価するために有効な方法である。とりわけ、蛍光に依存する解析方法では、POIに蛍光タンパク質を融合したタンパク質を作製する必要があること、この蛍光タンパク質がPOIのサイズや特性に悪影響を及ぼす可能性を否定できない一面がある。また、後者のNMR解析では高い純度と濃度のPOIが必要であることに加えて、タンパク質の配列の複雑性や分子量、スペクトルの重なりや検出信号の拡散が結果の解釈を複雑にするという短所がある。そのため、遺伝子工学やタンパク質精製などの複雑な手順なしにLLPSを評価できるケミカルツールを開発することは、現行アプローチの欠点を克服できるだけでなく、相分離の仕組みを理解するうえで重要な課題となる3)。
3. ピレンの蛍光特性を活用した周囲環境モニタリング蛍光プローブ
ピレンは4個のベンゼン環が菱形のように結合した平面構造を持つ芳香族炭化水素であり、溶液中の存在濃度に依存して異なる蛍光を示す特性がある。希薄溶液においてはモノマー発光(励起波長350 nm/ 発光波長~380 nm)を濃厚溶液においては二分子が近接し励起錯体を形成することでエキシマー発光(励起波長350 nm/ 発光波長~480 nm)を示す。ピレンは化学修飾がし易いことに加え、エキシマー発光を示す性質を利用することで、DNA、タンパク質、細胞膜といった生体分子の位置・空間情報を得るための研究が数多く行われてきた4)。
筆者らは、相分離から成る生体高分子液滴(バイオ液滴)の粘性・極性変化を評価できるケミカルツールの創出に向けて、ピレンの蛍光特性を生かした蛍光プローブ開発に取り組んでいる。図2に示すように、筆者らの開発した第一世代・蛍光プローブ(Pyr-A)はピレンをリンカーでつなげたピレンダイマー型の構造を特徴とする5)。異なる極性溶媒におけるPyr-Aの蛍光発光スペクトル解析の結果から、本プローブは極性溶媒ではエキシマー発光を示すが、疎水性溶媒中ではモノマー発光を示すことが明らかになった(図3A)。また、この蛍光発光スペクトルはPyr-A濃度に依存しなかったため、分子内エキシマー発光が起こっていることが確認できた。さらに、異なる粘性溶媒中での蛍光発光スペクトル解析の結果から、粘性環境下ではモノマー発光を示すことが明らかになった(図3B)。これらエキシマー発光(E)とモノマー発光(M)の蛍光強度比E/Mを測定することで、Pyr-A の濃度に関係なく観測対象の状態(極性、粘性)を定量化できることに成功した。
続いて、試験管内においてIDRsを介して液滴を形成するBRD4タンパク質、細胞内における相分離体の一つである中心体の粘性・極性変化の評価を行った。BRD4のIDRsを介して形成されるバイオ液滴のサイズが大きくなると、E/M比が減少することから、バイオ液滴の内部環境が低極性・高粘性になることが明らかとなった(図4A)。また、中心体は細胞分裂の過程で成熟・肥大化することが知られている。Pyr-Aを用いた解析より、細胞分裂期における中心体内部環境は、E/M比が低下していることが明らかとなった(図4B)。これらの結果は、相分離したバイオ液滴はサイズの肥大化に伴い、極性の低下ならびに粘性上昇を起こしていることが明らかになった(図5)。
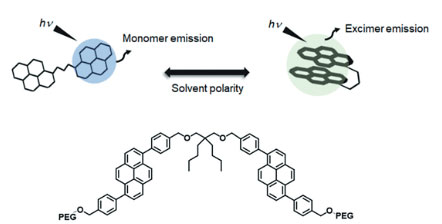
図2 第一世代ピレンダイマー型プローブ
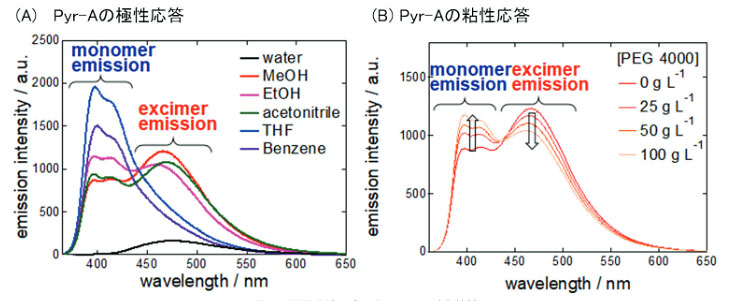
図3 周囲環境に応じたPyrAの蛍光特性
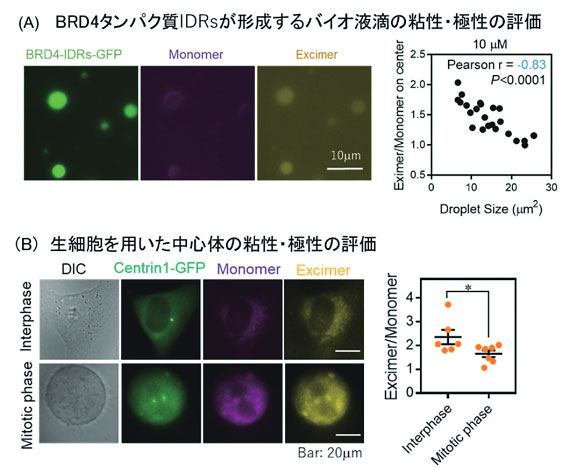
図4 Pyr-Aを用いた極性・粘性イメージング
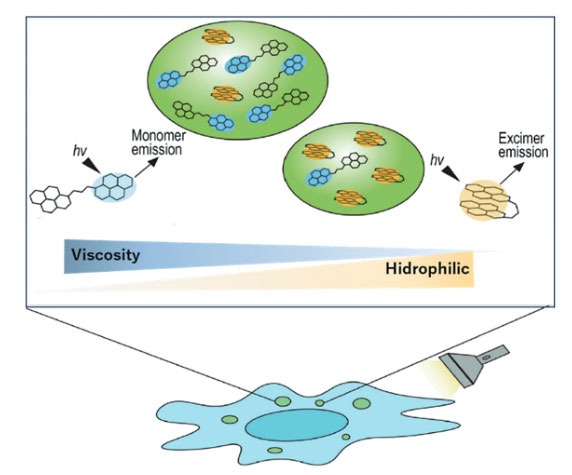
図5 Pyr-Aのプローブ特性の概要
4.おわりに
本稿では、筆者らが開発した相分離したバイオ液滴の物理化学的性質を評価できる蛍光プローブについて紹介した。現在取り組んでいるが、リンカー部位の最適化や残基修飾による標的指向性の獲得など本プローブの実用化にむけた課題は多い。煩雑ながらもLLPSによる時空間的なタンパク質ダイナミクスの仕組みを調べるケミカルツール開発により、基本生命現象から疾患の発症機序解明など生命科学が発展することが期待される。
| [ 著者プロフィール ] | |
| 氏名 | 雨森 翔悟(Shogo Amemori) |
|---|---|
| 所属 | 金沢大学・ナノマテリアル研究所 〒920-1192 石川県金沢市角間町 Tel:076-264-5924 |
| 出身学校 | 北海道大学総合科学院物質化学コース |
| 学位 | 博士(理学) |
| 専門分野 | 超分子化学、高分子化学 |
| 現在の研究テーマ | 高分子中における分子会合体評価、刺激応答性高分子の開発、ガス分離膜の開発 |
| [ 著者プロフィール ] | |
| 氏名 | 西山 嘉男(Yoshio Nishiyama) |
|---|---|
| 所属 | 金沢大学・理工研究域 〒920-1192 石川県金沢市角間町 Tel:076-264-5704 |
| 出身学校 | 京都大学大学院理学研究科 |
| 学位 | 博士(理学) |
| 専門分野 | 分光分析化学 |
| 現在の研究テーマ | 貴金属ナノ粒子の生成過程の解明、新規時間分解分光法の開発および相互作用解析への応用 |
| [ 著者プロフィール ] | |
| 氏名 | 添田 貴宏(Takahiro Soeta) |
|---|---|
| 所属 | 金沢大学・理工研究域 〒920-1192 石川県金沢市角間町 Tel:076-264-5732 |
| 出身学校 | 京都大学大学院薬学研究科 |
| 学位 | 博士(薬学) |
| 専門分野 | 有機合成化学 |
| 現在の研究テーマ | 触媒的不斉反応、低分子ゲル化剤の開発、多成分反応の開発、機能性小分子の合成研究 |
| [ 著者プロフィール ] | |
| 氏名 | 羽澤 勝治 (Masaharu Hazawa) |
|---|---|
| 所属 | 金沢大学・新学術創成研究機構 〒920-1192 石川県金沢市角間町 Tel:076-264-6206 |
| 出身学校 | 弘前大学大学院保健学研究科 |
| 学位 | 博士(保健学) |
| 専門分野 | 分子細胞生物学、ゲノム情報機能学、放射線生物学、ケミカルバイオロジー |
| 現在の研究テーマ | 核構造ダイナミクスと遺伝子発現、相分離解析プローブの開発、スーパーエンハンサーの機能化メカニズム |