がんと代謝 ~多細胞連関からオルガネラレベルの解像度での解析を目指して~
Cancer Metabolism ~understanding cell-cell to organelle-organelle metabolic interactions~
 |
大澤 毅 東京大学 先端科学技術研究センター 准教授 |
Abstract
Recently, integrative multi-omics analyses that link organs,
cells and even organelles has been extensively studied
and are attracting attention. In solid tumors, because of
microenvironments such as hypoxia, malnutrition, and acidic
pH caused by impaired vascular structures, cancer cells
promote metastasis and invasiveness contributing resistance
to chemotherapy and poor prognosis. Not only changes in the
omics of cancer cells themselves, but also interactions between
cells and organelles play an important role in cancer malignancy,
attention as a target. Therefore, in this review, I would like
to provide an overview from the perspective of multi-omics
analysis that links cells, multicellular spaces, and organelles,
which can be the essential cause of diseases such as cancer.
1. はじめに
近年、疾患生物学研究において、臓器間や細胞間を連関するオ ミクス統合解析が盛んに行われている。また最近では、疾患オミ クス解析がオルガネラレベルの解像度で明らかになってきており 注目を浴びている。固形がんでは、不完全な血管構築や血流不全 により生じる低酸素、低栄養、低pH などのがん微小環境が存在し、 エピゲノム、トランスクリプトーム、プロテオーム、メタボロー ムなど様々な階層のオミクス変動を介して、転移・浸潤能などを 促進し、治療抵抗性や再発・転移などにより、予後不良のがん悪 性化に寄与することが知られてきた。この粗悪ながん微小環境で は、がん細胞自身のオミクス変動のみならず、細胞間の相互作用 やオルガネラ間の相互作用もがん悪性化に重要な役割を果たすた め、オルガネラ制御が新しい癌治療標的として注目を集めている。 そこで本項では、がんなど疾患の本質的な原因となり得る細胞― 多細胞間―オルガネラ間を連関するマルチオミクス解析の視点か ら概説したい。
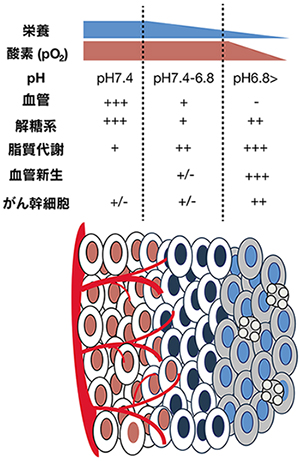
栄養素と酸素は、血管から遠く離れた細胞に利用できない。ワールブルグ効果としても知られる解糖系の亢進は、乳酸を排出により微小環境のpH を酸性にします。脂質代謝は、低栄養で亢進される可能性がある。極端な微小環境におけるがん細胞特異的な代謝変化は、がんの幹細胞性の維持、血管新生の誘導、および転移にも関与する。
2. がんと代謝研究におけるマルチオミクス研究の必要性
がんや生活習慣病などの克服には、多階層オミクスを統合した疾患の病態解明から治療戦略の確立が重要と考えられる。がん組織内には、酸素や栄養状況が時空間的に変化するがん微小環境に起因する細胞不均一性(ヘテロジェナイティー)が存在する。固形がんでは、不完全な血管構築や血流不全により生じる低酸素、低栄養、低pH などのがん微小環境が、細胞間の相互作用やオルガネラ間の相互作用を介して、エピゲノム、遺伝子発現、タンパク質の相互作用、エネルギー代謝変動など、各階層における膨大な多次元要素が有機的に繋がって、がん細胞の転移や浸潤能の促進を引き起こし、がんの悪性化に寄与するが知られている。また、このような粗悪ながん微小環境に適応したがん細胞は、しばしば細胞死耐性を獲得し、免疫寛容や薬剤耐性を示すことで再発や患者の予後不良に関与することが報告されている。このことから、酸素や栄養の供給が不足したがん微小環境で生存するがん細胞に対する創薬標的を探索することが重要であると考えられる。本総説では、近年一般的になってきた、エピゲノム、トランスクリプトーム、メタボロームのマルチオミクス解析から新たに見えてきた、粗悪ながん微小環境で中心的な役割を果たす細胞―多細胞―オルガネラレベルのマルチオミクス解析の視点から最近の知見を紹介したい。
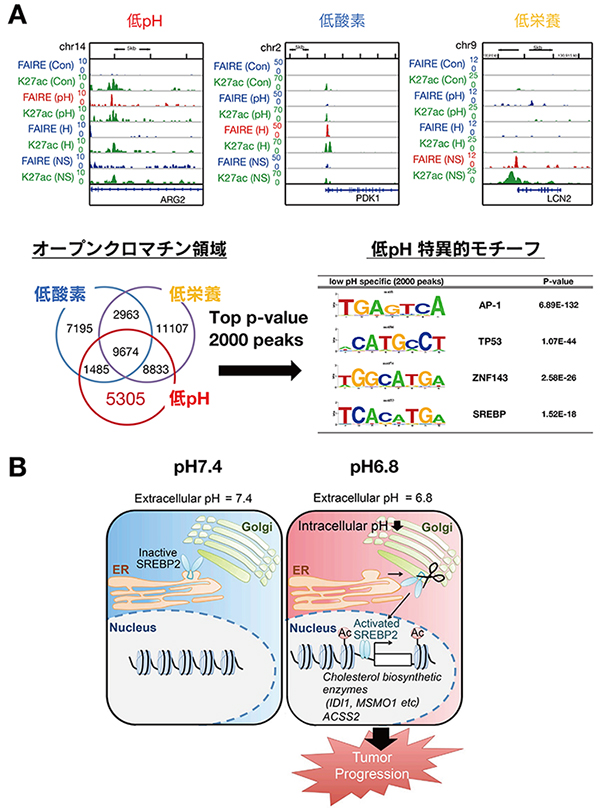
(A)がん微小環境における、低pH(pH)・低酸素(H)・低栄養(NS)では、異なったエピゲノム状態(ヒストン修飾(活性化遺伝子H3K27Ac)及び、ヌクレオソームフリーな(FAIRE))の遺伝子が存在する。(B)通常状態(左、細胞外pH 7.4)では、SREBP2 はER(小胞体)に局在し不活性型である。低pH 環境にがん細胞が陥ると(右、細胞外pH 6.8)、細胞内のpH が低下し、SREBP2 がゴルジ体を経由して核内に移行し活性化する。その結果、コレステロール生合成や酢酸代謝に関連する酵素群の発現を誘導することで、がんの生存や進展に寄与する。
3.1 オミクス統合解析からみたがん細胞の悪性化機構
正常細胞と比べてがん細胞では解糖系に依存した代謝に変化することが古くから知られている。オット・ワーブルグ博士(1883-1970)により1920 年代に提唱された有名な事象であるが1)、酸素の有無に関わらずがん細胞は、エネルギー産生としては非効率な経路(酸化的リン酸化が1分子のグルコースから38ATP
産生するのに対し、解糖系からは2ATP
しか産生しない)である解糖系を中心的に利用するというものである。また、増殖期や低酸素のがん細胞において解糖系は、主要なエネルギー産生系であり、さらに、解糖系から核酸合成、アミノ酸合成、タンパク合成、細胞膜合成など細胞増殖のために必要な分子が制御される。また、グルタミン(グルタミノリシス)やロイシン、イソロイシン、リジンなどの分岐鎖アミノ酸(BCAA)を利用した経路が、がん幹細胞維持に重要であるということが注目されている2),3)。また、増殖期の細胞における解糖系の亢進は、低酸素で活性化するHIF1a
を介した一連の解糖系酵素群の発現誘導(転写制御)や、低酸素応答性ヒストンメチル化・脱メチル化酵素群
(エピゲノム制御)が関与していることが報告されている。さらに、最近では、タンパク質のリン酸化や複合体形成のみならず、RNA
修飾やRNA―タンパク質の結合を介したエピトランスクリプトーム制御が4)、増殖期のがん細胞における多階層オミクスが解糖系を制御することが報告されている。
これまで単なる低酸素や解糖系の結果として考えられてきた低pH
がん微小環境においても、酢酸代謝の中心代謝酵素であるACSS2 が発現誘導されることを明らかとした5),6)。我々の研究グループは、がんにおける酸性状態を模した培養系を用い、がん細胞に対しトランスクリプトーム、エピゲノムなどのオミクス統合解析を行なった。その結果、コレステロール代謝におけるマスターレギュレーターとして知られるSREBP2
を、低pH で機能する転写因子として見出した7)(図2)。マルチオミクス解析が一般化されつつある現在、これまで知られていない多次元を連関するフィードバック制御機構が次々と発見されることが期待できる。
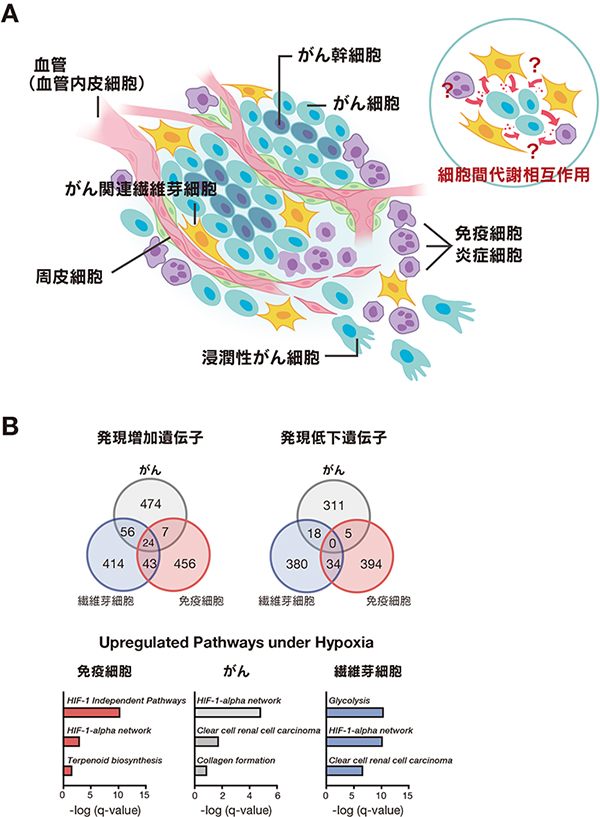
(A)がん細胞は、隣接する間質細胞または免疫細胞の代謝リプログラムし、がん細胞の増殖に利用できるアミノ酸などの栄養素を提供し、また、免疫寛容するシグナル伝達物質を分泌する。(B)低酸素腫瘍微小環境は、がん細胞、線維芽細胞、および単球/マクロファージにおいて異なる遺伝子発現系を誘導する。低酸素下ではHIF1αを介した解糖系は様々な細胞で共通して亢進されるが、単球/マクロファージではHIF1αに非依存的経路も亢進することが明らかとなってきた。
3.2 がん微小環境における細胞間代謝相互作用
がん組織内の腫瘍微小環境は、栄養素や酸素、pHのみならず、さまざまな種類の細胞間の相互作用によって形成される8)。例えば、がん細胞は、腫瘍微小環境で最も豊富な細胞の一つであるがん関連線維芽細胞(CAF)からのアラニンやグルタミンといった代謝物質を利用して増殖する。また、免疫細胞もがんの進行に関与しており、がん細胞から分泌される乳酸やキヌレニンなどの代謝物質が免疫細胞の免疫抑制機能を増強することが知られている9)。さらに、T細胞の代謝異常は、がん細胞に対する免疫応答を抑制することが報告されている10)。当研究室においても、がん細胞単独、あるいは多細胞連関モデルを用いた腫瘍形成実験を行ったところ、がん細胞-CAF-免疫細胞の代謝相互作用が腫瘍形成に大きく寄与することを見出している。
これらの代謝相互作用を介した細胞間連関は、がん細胞の遺伝子やエピジェネティックな変化を誘導することが知られており、がんの進行や治療耐性に影響を与える可能性がある。例えば、CAFはがん細胞の増殖を促進するサイトカインを分泌することで、がん細胞の遺伝子発現プロファイルを変化させることが報告されている。また、腫瘍微小環境に存在する酸素の欠乏は、がん細胞の遺伝子発現や代謝プロセスを変化させ、治療抵抗性を引き起こすことが報告されている。したがって、腫瘍微小環境における細胞間相互作用の理解は、新しい治療法の開発に重要な役割を果たすことが期待される。
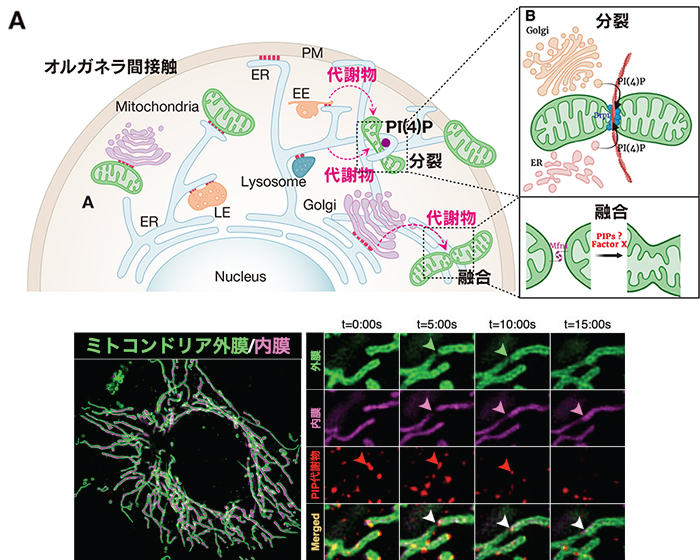
(A)オルガネラ間代謝相互作用は、互いの機能を協調的に制御することで生体恒常性に重要な役割を果たしている。オルガネラ間代謝相互作用の理解は、がんを含む疾患の病態生理学の解明し、生体における代謝ロバストネス制御に繋がる新しい疾患治療戦略となることが期待される。(B)オルガネラ代謝相互作用によるミトコンドリア融合メカニズムは未だに解明されていない。(C)PIP代謝物がミトコンドリア外膜に作用することでミトコンドリア融合が開始される。
3.3 オルガネラ-オルガネラ代謝相互作用を介した疾患制御
近年、疾患オミクス解析が臓器間や細胞間、さらにはオルガネラレベルの解像度で明らかになってきており、組織や細胞間相互作用だけでなく、オルガネラレベルでの代謝相互作用が注目されている。オルガネラは、時々刻々とその形態や局在を変化させ、局所的な生体物質の調節やシグナル伝達の場として機能し、多様な生理学的プロセスを調節することで、積極的に細胞機能を制御している。近年、超解像度顕微鏡をはじめとしたイメージング技術の飛躍的な向上により、個々のオルガネラが直接的な接着を介して互いに連関し、オルガネラ相互作用(ネットワーク)を形成していることが明らかになってきた。あるオルガネラの機能や形態変化が他のオルガネラにも影響するように、このネットワークは物理的な繋がりに留まらず、代謝物やシグナル伝達、オルガネラ形態制御など互いの機能を協調的に制御することで生体恒常性に重要な役割を果たしている11)。我々は、腫瘍微小環境下におけるゴルジ体と小胞体(ER)の融合が起因となり転写因子が活性化し、コレステロール生合成を促進することを発見し、オルガネラの形態変化を介したがんや生活習慣病の新たな転写調節メカニズムとして注目している。また、ミトコンドリアの分裂が小胞体やゴルジ体との相互作用によって調節されていることが報告されているが12),13)、我々も他のオルガネラを介したPIPsの代謝変換により制御される、新たなミトコンドリア外膜融合機構を見出している(図4)。さらに、PIPs代謝酵素KOマウスはミトコンドリア形態の異常を示し、循環機能不全を呈することから、オルガネラの独自構造が生体恒常性の維持は密接に関連しており、細胞内の正常な機能とバランスを維持するために重要な要素であることが示唆される。
がんでは、オルガネラが腫瘍微小環境への適応を調節する上で重要な役割を果たし、細胞内でのミトコンドリア、ゴルジ体、小胞体、オルガネラの機能の変化は、がんの増殖、浸潤、そして転移や生活習慣病に関与すること報告されている14)。最近では、ミトコンドリアがSTING活性化に関与していることが示唆されており、ミトコンドリア由来小胞からのDNAの放出やミトコンドリアのストレス応答がSTINGを刺激し、免疫応答を誘導することが報告されている15)。さらに、従来ミトコンドリアは細胞内で生成・維持されるものと考えられてきたが、細胞間でミトコンドリア輸送を行う細胞間ミトコンドリア転送も観察され、オルガネラを介した細胞間連関という、新たな階層の細胞間オルガネラ相互作用の存在も示唆されている16)。細胞間ミトコンドリア転送は、細胞の生存や代謝に重要な役割を果たす可能性があり、疾患の理解に新たな展望を提供する研究領域となり得る。細胞は、環境の変化やストレスに応じてオルガネラの形態を調節し、適切な機能を維持する仕組みを有しており、腫瘍微小環境下に晒されたがん細胞では、劇的なオルガネラ構造変化が起こり、オルガネラ相互作用が変動すると考えられる。これら病態の克服には、細胞内代謝適応の要となるミトコンドリアをはじめとしたオルガネラ間の代謝物を介した相互作用の理解が必須であり、がんや生活習慣病の新たな治療法の開発に繋がることが期待される。
4.おわりに
生命は核酸、糖質、脂質、タンパク質などの複雑な有機化合物から構成されている。近年、次世代シークエンサー、質量分析器やクライオ電子顕微鏡などの普及により、ゲノム配列、転写、翻訳、代謝、タンパク質複合体、などの生命現象が網羅的に解析されてきており、従来の多細胞間相互作用、あるいは1細胞解析では捉えきれない、オルガネラレベルの代謝相互作用の解析へと展開され、がんの病態の研究はさまざまなスケールでの組織微小環境における代謝相互作用の評価が可能となってきている。本項では、(1)がん細胞自身は、がん代謝を変化させることにより、低酸素、栄養飢餓、酸性 pH などの腫瘍微小環境に適応する。これは、治療に抵抗性を持つがん細胞が存在する理由の一つであり、適応がんが創薬の新たな標的になる可能性がある。(2)がん細胞と異なる細胞間の代謝相互作用は、がんの進行と生存に不可欠な栄養素を供給する。CAFは、腫瘍微小環境内で最も豊富な細胞であり、腫瘍の形成に必要な栄養素の供給源である。したがって、CAFを標的とした治療法の開発が期待される。(3)オルガネラ間相互作用は、がんや生活習慣病における細胞増殖・老化、生存、転移、環境適応など本質的な特徴に関与している可能性がある。オルガネラを標的としたがんの治療は、細胞内での特定の代謝経路やオルガネラを制御のみならず生体における代謝ロバストネス制御に繋がる新しいがん治療戦略となることが期待される。
| [ 著者プロフィール ] | |
| 氏名 | 大澤 毅(Tsuyoshi Osawa) |
|---|---|
| 所属 | 東京大学 先端科学技術研究センター ニュートリオミクス・腫瘍学分野 〒153-8904 東京都目黒区駒場4-6-1 東京大学先端科学技術研究センター Tel:03-5452-5025 |
| 出身学校 | 英国ロンドン大学(UCL)大学院 腫瘍学専攻 |
| 学位 | (博士(腫瘍学)) |
| 専門分野 | がん代謝学、ニュートリオミクス |
| 現在の研究テーマ | オミクスデータを統合し、がん微小環境におけるがん悪性化機構の研究に取り組んでいる。 |
| [ 出版物のご案内 ] | |
| 本総説の大澤毅先生の編集による新刊「マルチオミクス データ駆動時代の疾患研究」(羊土社)は、オミクス解析の概説から疾患研究の例までまとめられています。これからこの分野の研究を始める方はもちろん、新たなヒントを得たい方におすすめです。 | |
 |
実験医学 増刊 マルチオミクス データ駆動時代の疾患研究 大澤 毅 編 発行:羊土社 2023年9月5日発行 B5判 222ページ ISBN 978-4-7581-0413-5 |
|---|---|