神経変性疾患とLLPSの関わり
株式会社同仁化学研究所 末永 元輝
LLPS 研究分野と神経変性疾患
近年、生命現象を解き明かす新たな研究として、細胞内で生じる液‐液相分離 (liquid – liquid phase separation: LLPS) が注目を浴びている。LLPS は細胞内で RNA やタンパク質などの高分子が局所的に集まり、水と油のように細胞質から分離して液滴を形成する現象である。それは核小体に代表されるような、生体膜を持っていない (膜で区切られていない) 固有の働きをもつ集合体 (droplet) であり、オルガネラのように様々な生理現象を担う場となっている。ほぼすべての細胞内現象で LLPS が関与しているとも言われており、神経変性疾患に関わる研究も盛んに行われている。例えば、細胞内でのタンパク質凝集が病因となる疾患 (ミスフォールディング病) のうち、パーキンソン病や前頭側頭葉変性症、アルツハイマー病、筋萎縮性側索硬化症においては、それらの原因タンパク質である α-シヌクレイン、FUS、タウ、TDP-43 が droplet を形成することにより、凝集体形成が促進される 1)。LLPS は生体現象を解明するための新たな糸口であり、神経変性疾患と LLPS の関与を明らかにすることで病態の理解、新規治療法の開発に繋がることが期待されている。
Droplet か凝集体か
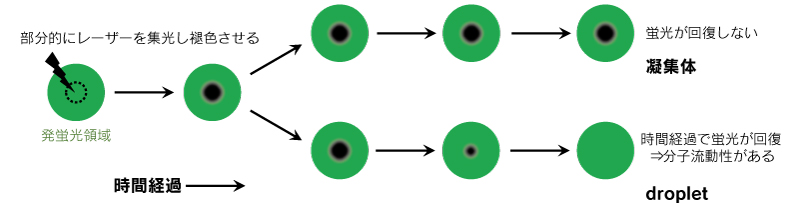
ミスフォールディング病の病態を明らかにしていく上で、タンパク質凝集過程における droplet と凝集体の境目を見分けることは重要である。LLPS を評価する実験において、試験管内や細胞内に形成された droplet と凝集体をどうやって見分けているのだろうか。タンパク質凝集が原因とされる疾患では、in vitro 環境下でタンパク質を凝集させる実験が古くから行われてきたが 2)、蛍光プローブや蛍光タンパク質を利用して観察しただけでは蛍光の集合が何を示すのか判断できない。そこで、 droplet を判断する手法の一つとして、分子動態を観察できる FRAP (光褪色後蛍光回復法) が使用されている 3)。レーザーにより褪色させた領域の蛍光回復の程度をもとに、「蛍光の集合に流動性があるか」を確認することで、 droplet かどうかを判断できる(図1)。Droplet を細胞内で観察するためには標的タンパク質に GFP を発現させて FRAP によって評価するが、最近では羽澤らによりピレン化合物を応用した LLPS に応答する低分子プローブも報告されており 4)、LLPS の検出手法についても盛んに研究が進められている。
LLPS はアミロイドーシスにも関与しているのか
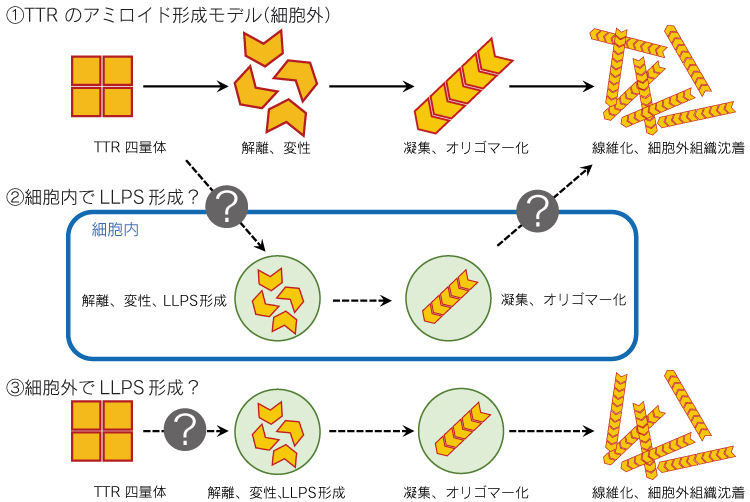
次に、同じくミスフォールディング病に分類されるアミロイドーシスと LLPS との関連についても焦点を当ててみる。前述の通り、細胞内にタンパク質凝集が生じる疾患とLLPSの関与が示唆されているが、一方でアミロイドーシスと LLPS との関連を証明するには気を付けなければならない点もある。例えば、アルツハイマー病の原因タンパク質である アミロイド β、家族性アミロイドポリニューロパチーの原因タンパク質であるトランスサイレチン (TTR) に関して、凝集過程における LLPS の関与が報告されている 5)6)。しかし、アミロイドーシスの原因タンパク質は細胞外タンパク質であり、生じるアミロイド線維も細胞外に沈着するため、そこに細胞内の現象である LLPS がどのように関与するかは不明である(図2)。また、細胞外 (細胞外のマトリックス、または血中など) において線維形成を促進するような LLPS が生じるかも確認されていない。したがって、原因タンパク質がどのように細胞内外を移行するのか、細胞外において LLPS 形成が起きているのか、患者病態において実際に LLPS が観察されるのか、などまだまだ解明すべき点は多い。
今後の LLPS研究
LLPS 研究の広がりの観点から、神経変性疾患に関する最近の知見を紹介したが、これらの研究は人工的な LLPS 形成や細胞株を使った in vitro実験系での検証が多い。今後どのように実際の患者病態に近づけるか、あるいは有用な細胞モデル、in vivo モデルをどう作製していくかが課題である。さらに、真に病態との関連を示すためには、患者生体内や生体サンプルでの観察手段が不可欠になってくる。今後、LLPS研究分野が発展し、多くの疾患の原因究明に貢献していくことを期待する。
【参考文献】
- A. Zbinden et al., “Phase Separation and Neurodegenerative Diseases: A Disturbance in the Force”, Dev Cell, 2020, 55, 45-68.
- W. Colon and J. W. Kelly, “Partial denaturation of transthyretin is sufficient for amyloid fibril formation in vitro”, Biochemistry, 1992, 31, 8654-60.
- N. O. Taylor et al., “Quantifying Dynamics in Phase-Separated Condensates Using Fluorescence Recovery after Photobleaching”, Biophys. J., 2019, 117, 1285-1300.
- M. Hazawa et al., “A light-switching pyrene probe to detect phase-separated biomolecules”, iScience, 2021, 24, 102865.
- X. Gui et al., “Liquid-liquid phase separation of amyloid-β oligomers modulates amyloid fibrils formation”, J. Biol. Chem., 2023, 299, 102926.
- G. Duan et al., “The Regulatory Mechanism of Transthyretin Irreversible Aggregation through Liquid-to-Solid Phase Transition”, Int. J. Mol. Sci., 2023, 24, 3729.