細胞老化の理解と酸素消費速度
株式会社同仁化学研究所 高橋 政孝、見汐 航太朗
2021 年にCamell らのグループは、SARS-CoV-2 に感染させた老齢のマウスに老化細胞除去薬(senolytic drug)であるフィセチンを投与することで、死亡率が50%減少し、免疫応答が改善されたという報告をした1)。近年、老化細胞除去薬の研究は大いに注目を集めているが、対象となる老化の機序が複雑で、研究の進展にはそれを理解することが必要である。本稿では老化現象を複数の指標で評価し、対象の酸素消費速度(即ちミトコンドリア活性)を確認している論文をいくつか紹介したい。
2015 年、竹林らは網膜芽細胞種の原因遺伝子 Retinoblastoma protein(RB)が老化に伴うエネルギー代謝を調整していることを報告した。著者は、老化細胞の代謝を理解するため、酸素消費速度、メタボローム解析、細胞外pH 変動等を測定し、癌遺伝子活性下において RB が代謝遺伝子を活性化し、ミトコンドリア活性(解糖系、TCA サイクル、酸化的リン酸化系)を促進することで、細胞老化が誘導されることを示唆している2)。
同年、Capasso らのグループは、急性及び慢性的な老化間葉系幹細胞の特徴をオートファジーやプロテアソーム活性、代謝の変化から確認できることを報告した。細胞老化の誘導には大きく分けて2 種類存在し、酸化ストレス・抗がん剤(Doxorubicin)処理・X 線照射による急性的な細胞老化と、継代培養の繰り返しによる複製老化(慢性的な老化)があるとしている。彼らは、どの老化誘導においても、細胞は解糖系によるグルコース代謝が盛んであることを確認したが、慢性的な老化(複製老化と低線量のX 線照射)誘導の細胞のみ、脂肪酸とグルタミンをグルコースの代わりに代謝する能力を持つことを発見した。つまり、解糖系からミトコンドリア呼吸に代謝シフトしていることが示唆された。彼らの検討方法は、まず、間葉系幹細胞に前述した種々の刺激を与え、急激に老化を誘導した細胞と慢性的に老化を誘導した細胞を作製し、次いで、それぞれの細胞に異なる栄養素(脂肪酸、グルタミン、グルコース)を与えATP レベルや酸素消費速度、オートファジー活性を分析するものである。彼らの研究は、それらが細胞老化の表現型(急性もしくは慢性)の違いを識別するのに有用な情報であることを示唆している3)。
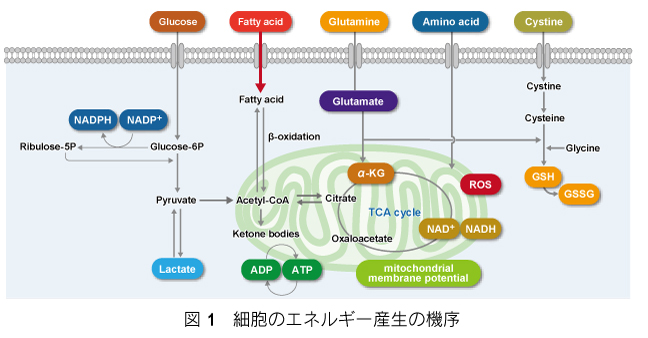
2019 年、Quijano らのグループは、化学療法と細胞老化の関係性に関して報告した。具体的には、ミトコンドリア外膜に存在するMitofusins が老化メラノーマ細胞の治療においてミトコンドリアの長さやエネルギー生産、分泌表現型を調節していることを見出した。彼らは、老化誘導に伴うミトコンドリア量や形態の変化、酸素消費速度、ATP 生産、さらにミトコンドリアの分裂や融合を調整するmitofusin1, 2 やDRP1 の発現量を測定し、mitofusins は、senescence-associated secretory phenotype (SASP) を調節するための薬理学的標的として有望であることを明らかにした4)。 エネルギー産生の機序を 図 1 に示す。
この中でも特に酸素消費速度の解析は、老化現象を確認した論文の多くで行われており、測定方法はフラックスアナライザーを用いた手段が主流であった2, 4)。参考文献の中で紹介されているが、老化には様々な誘導方法があり、誘導の種類によっては老化細胞の応答が大きく異なる。すなわち、ある特定の薬剤の検証を行う場合、細胞における様々な老化の表現型が存在するため、分析しなければならない検体数は多くなってしまうことが予想され、装置の維持費や必要な消耗品を考えると分析に係る費用はかさむことになる。試薬ベースで酸素消費速度の測定を気軽に行う事ができると、本研究の価格的なハードルを下げることができる。DOJIN NEWS Vol.183(Reviews)に掲載されている群馬大学 吉原らが開発した リン光プローブ分子を用いて汎用の蛍光プレートリーダーやマイクロプレートで酸素消費速度を評価する手法は、老化研究の進展に更なる加速化に寄与することが期待される。
【参考文献】
- C . D. Camell et al.,“ Senolytics reduce coronavirus-related mortality in old mice” Science, 2021, 373, eabe4832.
- S . Takebayashi et al.,“ Retinoblastoma protein promotes oxidative phosphorylation through upregulation of glycolytic genes in oncogene-induced senescent cells”, Aging Cell, 2015, 14, 689-697.
- S. Capasso et al.,“ Changes in autophagy, proteasome activity and metabolism to determine a specific signature for acute and chronic senescent mesenchymal stromal cells” Oncotarget, 2015, 6(37), 39457-39468.
- J . Martinez et al.,“ Mitofusins modulate the increase in mitochondrial length, bioenergetics and secretory phenotype in therapy-induced senescent melanoma cells” Biochemical Journal, 2019, 476, 2463-2486.