SCAT1 を利用した単一細胞レベルでのパイロトーシス解析
株式会社同仁化学研究所 村井 雅樹
細胞死とは生体を構成する細胞の死を意味する。細胞死は生体内の多くの細胞で起こり、細胞が死滅した後は、それらが排除される機構が働いている。 これまでは、単に不要となった細胞内タンパク質等の除去が目的で細胞死が起こると考えられてきた。 しかしながら、近年の研究により細胞死は周囲の正常な細胞に様々なシグナルを発信することで、生体応答をコントロールするために起こっていることが分かってきている1)。
細胞死は分子によって制御された細胞死と偶発的な細胞死に分けられる。制御された細胞死の中でも近年、注目を浴びてきているのがパイロトーシスである。 パイロトーシスが誘導された細胞は、炎症性サイトカインを放出し、周囲の細胞に危険を知らせると共に細菌やウイルスの増殖の場である自らを消去する。 この現象はサルモネラの細胞内感染モデルを用いてCaspase-1依存性の細胞死としてCooksonらにより発見された2)。 Caspase はシステインプロテアーゼファミリー酵素の一種であり、細胞内でpro Caspaseと呼ばれる不活性型として合成される。 パイロトーシスが誘導されるにはCaspase-1の活性化が必要と考えられており、Caspase-1活性化の分子制御について様々な研究がなされている。Caspase-1の活性化はInflammasomeと呼ばれる高分子のタンパク質複合体の形成を経由して始まり、活性化されたCaspase-1(cleaved Caspase-1)は炎症性サイトカインであるIL-1βやIL-18 を生成し3)、Gasdermin D(GSDMD)と呼ばれる細胞質タンパク質のN 末端を切断する。N末端が切断されたN-GSDMD は、細胞膜に低分子透過性の孔を形成し細胞質成分の流出を引き起こすことでパイロトーシスを誘導する4)。このようにCaspase-1はパイロトーシスにおいて重要な役割を担っており、パイロトーシスを理解するには、Caspase-1 の機能解明が不可欠である。
cleaved Caspase-1を検出する方法として、①ウェスタンブロット5)、② cleaved Caspase-1と特異的に反応する色素を利用したアッセイ6)、③ Fluoredcect-Labeled Inhibitor of Caspases(FLICATM)が存在する。 上述するすべての手法により、cleaved Caspase-1を特異的に検出することはできるが、いずれもエンドポイント法でありCaspase-1の活性化からパイロトーシスが誘導されるまでのタイムラプス測定や、単一細胞レベルの解析には応用できない。
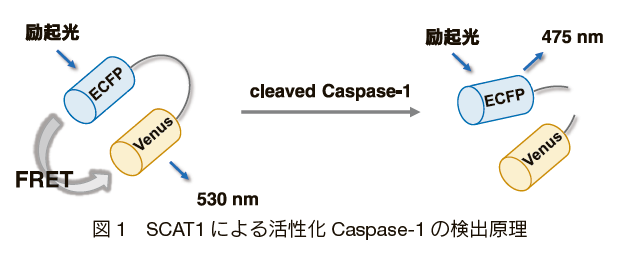
この問題を解決するために、LiuらはSensor for Caspase1 Activation based on FRET(SCAT1)と呼ばれる活性化Caspase-1の新たな検出手法を開発した。SCAT1とは、cleaved Caspase-1と特異的に反応するTyr-Val-Ala-Asp(YVAD)配列を介して連結した2 種類の融合タンパク質である。YVADはcleaved Caspase-1 と特異的に反応することから、SCAT1 に導入された2種類の蛍光タンパク質の蛍光強度比を測定することで 活性化されたCaspase-1を検出することが可能となる(図1)7) 。
Liu らは、SCAT1発現マクロファージに対しリポ多糖刺激を行うとIL-1βの分泌とともに、パイロトーシスが起こることを報告している。 一方で、Caspase-1 が活性化されないマクロファージではパイロトーシスの誘導は見られなかった7)。 パイロトーシスは炎症応答を誘導する細胞死であることから、パイロトーシスの更なるメカニズムの解明により自己免疫疾患や神経変性疾患などの治療に繋がる可能性が考えられる。
世界的に広がりを見せているCOVID-19においてもパイロトーシスとの関連性が報告されている8)。 Ferreiraらは、ヒト単球をモデルにCOVID-19を感染させCaspase-1の活性化、IL-1βの分泌、さらにGSDMDの活性化が起こることから、COVID-19が引き起こす細胞死はパイロトーシスであることを示唆している8)。加えて、COVID-19重症化モデルにおいてInflammasome の活性化が原因で炎症反応に繋がることも示唆している8)。未だ未知の点が多くあるパイロトーシスであるが、その分子機構の解明によりCOVID-19に対する新規治療法にも寄与する事を期待する。
【参考文献】
- L. Galluzzi et al., “Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018”, Cell Death & Differentiation, 2018, 25, 486-541.
- B. T. Cookson et al., “Pro-inflammatory programmed cell death”, Trends Microbiol., 2001, 9, 113-114.
- K. Tsuchiya et al., “The Inflammasome and Its Regulation”, Crit. Rev. Immunol., 2014, 34, 41-80.
- Y. Pian et al., “Pyroptosis: mechanisms and diseases”, Nature, 2021, 6, 128.
- C. Jakobs et al., “Immunoblotting for active Caspase-1”, Methods Mol. Biol., 2013, 1040, 103-115.
- N. Pereira et al., “Some commonly used caspase substrates and inhibitors lack the specificity required monitor individual caspase activity”, BBRC, 2008, 377, 873-877.
- T. Liu et al., “Single-cell imaging of caspase-1 dynamics reveals an all-or-none inflammasome signaling response”, Cell Reports, 2014, 8, 974-982.
- A. Ferreira et al., “SARS-CoV-2 engages inflammasome and pyroptosis in human primary monocytes”, Cell Death Discovery, 2021, 7, 43.
