エクソソーム研究を支える精製技術の発展
エクソソームはエンドソーム由来の直径 30-150 nm の細胞外小胞体の一種である。発見当初は細胞からの排泄物という見方がされる傾向にあったが、2000 年以降の研究で細胞間コミュニケーション1, 2) や薬物輸送のベクター3) としての役割が見えてきている。また、エクソソーム内には、タンパク質、DNA、RNA 類、脂質、代謝物が含まれており、近年では、がん 4) や慢性閉塞性肺疾患 5)、リンパ性機能障害6) などのバイオマーカーとしても注目されている。しかしながらエクソソームの生理学的な機能は十分に解明されておらず、今後、研究が進むことで病理との関係性が明らかになることが期待される。
エクソソームの実験を行うにあたっては、血漿や血清、組織、馴化培地などのサンプルからエクソソームを精製し回収するところから始まる。精製方法には、超遠心法、Poly-Ethylene Glycol(PEG)ベースの沈殿法、限外ろ過法、免疫親和性で捕獲する方法、マイクロ流体法、サイズ排除クロマトグラフィー法(SEC 法)がある。それぞれの精製方法には固有の長所短所があるため、精製の精度や回収率に違いが生じる。 Singh らが行った超遠心法と複数の市販キットを用いた比較では、エクソソーム量やサイズ分布、細胞毒性の違いが確認されており、精製方法により得られる結果に差異が生じる要因になっている7)。
現在、最も一般的に用いられる方法は超遠心法であるが8)、高い精製技術が求められる上に、高価な超遠心機が必要である。そこで簡便で特別な装置を必要としない精製方法も望まれており、これまでそれぞれの手法で課題とされてきた点を改良する報告も出てきている。ここでは PEG ベースの沈殿法と SEC 法にスポットをあて紹介する(表 1)。

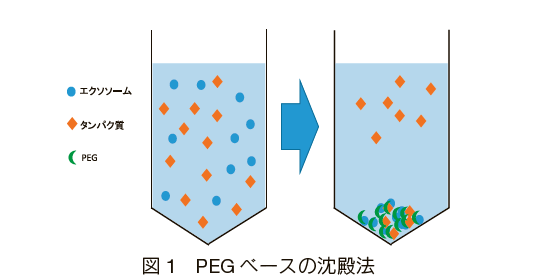
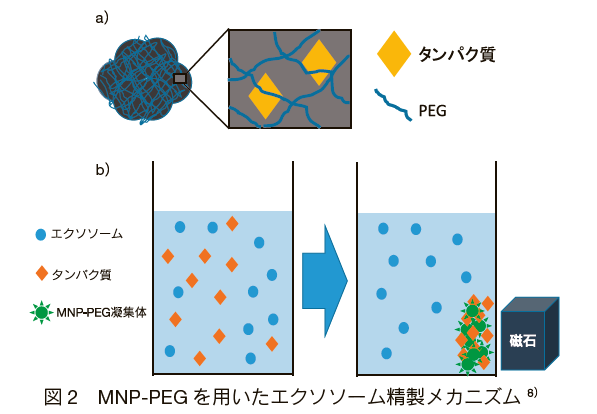
PEG ベースの沈殿法は、PEG 溶液によってエクソソームが包み込まれ凝集を促進させることで、汎用の遠心機で PEG とエクソソームの共沈殿物を回収する方法である。図 1 に示すように PEG は非特異的にエクソソーム以外のタンパク質も一緒に取り込み沈殿するため、エクソソームへの選択性が劣る 10)。また、PEG とエクソソームは一つの凝集体として沈殿するため、PEG が下流実験に影響を及ぼす可能性もあった。そこを打開する方法として Fe3O4 をベースにしたマグネティックナノパーティクル(MNP)に PEG をコーティングした化合物を用いたエクソソームの精製技術が報告されている 11)。 MNP の単体の構造は Fe3O4 表面に多くの PEG が固定されており、大きさは約 20 nm である。さらに MNP 同士で凝集する性質を持ち、その凝集体の直径は約 400 nm ほどになる。凝集作用によって表面には無数の PEG が網目状に群がりたくさんの穴がもたらされ、タンパク質や微細な不純物がトラップされるメカニズムである( 図 2a)。最終的に不純物をトラップした MNP-PEG 凝集体は磁石によって固定され、上澄みに残ったエクソソームを回収する仕組みである(図 2b)。また、PEG と Fe3O4(MNP)は化学結合していることを確認しており 12)、PEG 自体が不純物として精製エクソソームに混入する可能性が低く、精度の高いエクソソームを得ることが可能になっている。実際、ウシ胎児血清や人の血清サンプルから簡便にタンパク質を除去でき 30-200 nm のエクソソームを得ることに成功しており、エクソソームに対する分離能が向上している。
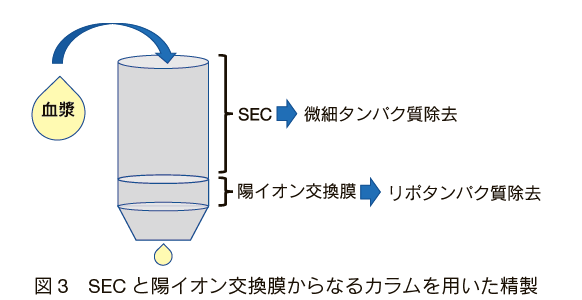
SEC 法はコスト、簡便性、精製の質を総合して高く評価されている。このことは International Society for Extracellular Vesicles(ISEV)が行った調査結果において、2015 年から 2019 年にかけて SEC 法を使う研究者の割合が 2 倍に増えているところにも表れている 13)。しかしながら、SEC 法は大きさで分離するため、エクソソームと同じサイズの細胞由来の微小小胞体やリポタンパク質粒子の分離は不得意とされている(表 1)。精製の最適化を行うために SEC 法を超遠心法や PEG 沈殿法と組み合わせる選択肢はあるが、簡便性が失われてしまう。そこで Lee らは、低コストと簡便性を担保しつつ精製効率を上げるために、SEC と陽イオン交換膜を組み合わせたカラムを開発し、血漿に含まれるリポタンパク質粒子を SEC 法に比べて 60 倍の効率で除くことに成功している 14)。 SEC と陽イオン交換膜を物理的に組み合わせたカラムで、操作としては SEC 法と変わらない(図 3)。カラム上段の SEC で 30 〜 40 nm 以下のタンパク質などを分離し、下段にある陽イオン交換膜で小胞体と混在しているリポタンパク質を捕捉する。このように SEC 法と変わらない簡便な操作でリポタンパク質を除去できる精製方法になっている。
簡便かつ低コストでできる新たな精製方法として、Fe3O4 をベースにした MNP に PEG をコーティングした沈殿法と SEC 法に陽イオン交換膜を組み合わせた方法を紹介した。目的物の機能解析を行う上で「精製」は非常に重要である。今後このような方法が精製技術としてさらなる発展をしていくことでスタンダードとなり、エクソソーム研究躍進の名脇役になることを期待する。
[参考文献]
-
1) C. Thery et al., “Exosomes: Composition, biogenesis and function”, Nat. Rev. Immunol., 2002, 2, 569.
2) H. Valadi et al., “Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells”, Nat. Cell Biol., 2007, 9(6), 654.
3) E. Van Der Pol et al., “Classification, Functions, and Clinical Relevance of Extracelluar Vesicles”, Pharmamol. Rev., 2012, 64, 676.
4) H. Julich et al., “Extracellular Vesicle Profiling and Their Use as Potential Disease Specific Biomarker”, Front. Immunol., 2014, 5, 413.
5) J. Salimian et al., “Chronic obstructive pulmonary disease: MicroRNAs and exosomes as new diagnostic and therapeutic biomarkers”, J. Res. Med. Sci., 2018, 23, 27.
6) A. Milasan et al., “Extracellular Vesicles as Potential Prognostic Markers of Lymphatic Dysfunction”, Front. Physiol., 2020, 11, 476.
7) G. K. Patel et al., “Comparative analysis of exosome isolation methods using culture supernatant for optimum yield, purity, and downstream applications”, Scientific Rep., 2019, 9, 5335.
8) P. Li et al., “Progress in Exosome Isolation Techniques”, Thernostics., 2017, 7, 789.
9) K. Sidhom et al., “A Review of Exosomal Isolation Methods: Is Size Exclusion Chromatography the Best Option?”, Int. J. Mol. Sci., 2020, 21, 6466.
10) R. Linares et al., “High-speed centrifugation induces aggregation of extracellular vesicles”, J. Extracell. Vescles, 2015, 4, 29509.
11) M. Chang et al., “Exosome purification based on PEG-coated Fe3O4 nanoparticles”, PLoS ONE., 2018, 13(6), e0199438.
12) M. Anbarasu et al., “Synthesis and characterization of polyethylene glycol (PEG) coated Fe3O4 nanoparticles by chemical co precipitation method for biomedical applications”, Spectrochim Acta A Mol Biomol Spectrosc., 2015, 135, 536.
13) F. Royo et al., “Methods for Separation and Standardization of Extracellular Vesicles: Results of a Worldwide Survey Performed by the ISEV Rigor and Standardization Subcommittee”, Cells, 2020, 9, 1955.
14) J. Van Deun et al., “Integrated Dual-Mode Chromatography to Enrich Extracellular Vesicles from Plasma”, adv. Biosyst., 2020, 1900310.

