転写因子 BACH1 によるフェロトーシスの促進機構とフェロトーシスの伝播現象
Promoting mechanism of ferroptosis by transcription factor BACH1 and propagation of ferroptosis
 |
西澤 弘成 東北大学 大学院医学系研究科 生物化学分野 学術研究員 |
 |
山中 美慧 東北大学 大学院医学系研究科 生物化学分野 |
 |
五十嵐和彦 東北大学 大学院医学系研究科 生物化学分野 教授 |
Abstract
Ferroptosis, an iron-dependent cell death, is a cause of various diseases, including ischemic and neurodegenerative disorders. Ferroptosis has also been found to work as a cancer suppressor mechanism in vivo, as well as apoptosis. With the requirements for new treatments for these diseases, increasing attention has been paid to the regulatory pathways of ferroptosis and the effects of ferroptosis on tissues. Here, we summarize our latest discoveries: the promoting mechanism of ferroptosis by the transcription factor BACH1 (BTB domain and CNC homology 1) and the propagating phenomenon of ferroptosis associated with the diffusion of lipid peroxidation from ferroptotic cells. These two findings may lead to the realization of new ferroptotic therapy in the future, in which BACH1 is overexpressed in immune cells that have invaded tumors, thereby propagating ferroptosis within tumors.
1. はじめに
近年、生体にはアポトーシスとは異なるメカニズムで生じる制御性の細胞死が複数存在することが報告され 1)、「細胞はアポトーシスもしくはネクローシスのいずれかで死ぬ」という従来の通説が覆された。フェロトーシスはこのような展開の中で、2012 年に新規の細胞死として Dixon らによって報告された 2)。フェロトーシスはその名が示す通り、鉄依存性の細胞死であることが特徴であり、鉄キレート剤によって抑制される。フェロトーシス細胞では、細胞内自由鉄を介する電子の供与反応(フェントン反応)によって、細胞膜やオルガネラ膜のリン脂質の過酸化反応が進むことによって、フリーラジカルの一種である脂質ヒドロキシラジカルが蓄積することで細胞が死に至ると考えられている 2-5)。
フェロトーシスは、虚血性疾患や神経変性疾患をはじめ、様々な疾患の病態形成に関わると考えられている。逆にフェロトーシスを抑制することでこれらの疾患の病態が緩和されることも多数報告されており 6-13)、フェロトーシスはこれらの疾患の新規治療標的として期待される。一方、フェロトーシスは生体内でがん抑制メカニズムとして働くことも分かっており、がん治療にフェロトーシスを応用できる可能性がある。特に、分子標的治療に耐性化したがん細胞がフェロトーシスへの感受性が高まることが分かっており 14, 15)、腫瘍の分子標的薬耐性化を克服するための鍵としてフェロトーシスが非常に注目されている。
このような背景のもと、フェロトーシスを制御する経路とフェロトーシス細胞が他の細胞や組織に及ぼす影響を解明することが喫緊の課題となっている。本稿では、近年、私達が報告した転写因子 BACH1(BTB domain and CNC homology 1)によるフェロトーシスの促進機構 7)と、フェロトーシス細胞からの脂質過酸化反応の拡散に伴う細胞死の伝播現象 16)を紹介する。さらに、それらを利用したがん治療への応用の可能性について考察したい。
2.転写因子 BACH1 によるフェロトーシスの促進機構
BACH1 は、塩基性ロイシンジッパー(basic-leucine zipper: bZip)構造を有する転写抑制因子であり、同じく bZip を有する小 Maf 分子(MafK, MafG, MafF)とロイシンジッパーで二量体を形成し、標的遺伝子の転写制御領域に結合して転写を抑制する 17)。 BACH1 にはヘムと結合して分解されるユニークな特徴がある。BACH1 はヘム分解酵素であるヘムオキシゲナーゼ 1(heme oxygenase-1: HO-1)の転写を抑制するが 17-19)、細胞内ヘム濃度の上昇に応じて BACH1 が分解され、HO-1 の発現が上昇してヘムが分解される。このフィードバック機構によってヘムひいてはその分解産物である細胞内自由鉄の恒常性が維持される。これらの知見から、ヘムおよび鉄代謝を制御する BACH1 が鉄依存性細胞死であるフェロトーシスを制御する可能性は高いと予想した。
マウス胎仔線維芽細胞(mouse embryonic fibroblasts: MEFs)にフェロトーシス誘導剤である Erastin を投与して、遺伝子発現の変化を網羅的に解析すると、グルタチオン合成経路や細胞内自由鉄代謝に関わる遺伝子を中心に、酸化ストレスに拮抗する遺伝子の発現が活性化されることが分かった 7)。これはフェロトーシス誘導に抵抗する細胞の防御反応だと考えられるが、これらの遺伝子群には、シスチンのトランスポーターである Slc7a11、グルタチオン合成の律速酵素である Gclm、Gclc、フェリチン(Fth1、Ftl1)、フェロポルチン(Slc40a1)などが含まれ、これらは BACH1 の標的遺伝子であった 7)。フェロトーシス時には BACH1 タンパク質が分解されることも判明し、BACH1 の分解に伴ってこれらの防御因子の発現が上昇するのだと考えられた。逆に BACH1 には、これらの遺伝子の転写抑制を介して、フェロトーシスを促進する機能があると考えられた(図 1)。
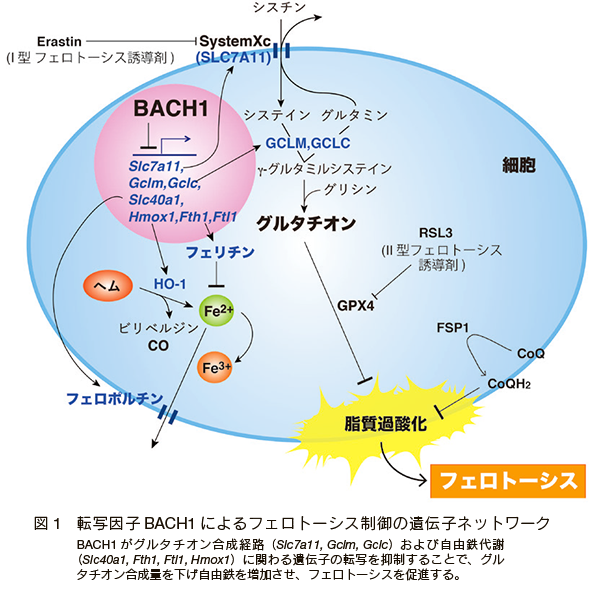
実際に、Bach1 ノックアウトマウス由来の MEFs は野生型と比べて、フェロトーシスへの抵抗性が高いことが判明した。さらに、Bach1 ノックアウトマウス由来の MEFs は野生型よりも細胞内の還元型グルタチオンの濃度が高く、フェロトーシス誘導時に細胞内自由鉄が増加しにくいことがミトコンドリア内鉄イオン検出試薬 Mito-Ferro Green(同仁化学)を用いることで示された 7)。これらの結果から、BACH1 にはグルタチオン合成経路と鉄代謝に関連する遺伝子群をともに転写抑制することで多角的にフェロトーシスを誘導する機能があると考えられた(BACH1 によるフェロトーシス制御の遺伝子ネットワーク:図 1)。
BACH1 によるフェロトーシスの促進機構は生体内でも機能しており、BACH1 がフェロトーシスを促進することによって、マウスの心筋梗塞の重症化に関わることも証明された 7)。心筋梗塞を含む虚血性疾患や神経変性疾患などのフェロトーシス関連疾患の新規治療戦略として、BACH1 を標的として利用できる可能性があり、今後の更なる研究の発展が期待されている。
3. BACH1 の新規標的遺伝子とフェロトーシス制御の新経路
BACH1 によるフェロトーシスの促進機構として、グルタチオン合成経路と鉄代謝のほかにも新経路が存在する可能性が考えられている。 2019 年に、フェロトーシスのもう一つの主要制御経路として、FSP1(ferroptosis suppressor protein 1, 別名 AIFM2: Apoptosis inducing factor mitochondria associated 2)による補酵素 Q(coenzyme Q: CoQ)を介した脂質過酸化の抑制機構(図 1)が存在することが報告された 20, 21)。今後の研究課題として、BACH1 がこの FSP1(AIFM2)の転写を抑制するかどうかが探求される必要がある。グルタチオン合成と鉄代謝に加えて BACH1 が FSP1-CoQ 経路も抑制するのであれば、BACH1 はフェロトーシスの複数の主要制御経路を遺伝子発現レベルで抑制することになり、フェロトーシスの強力な促進因子としての位置づけがますます強くなると考えられる。
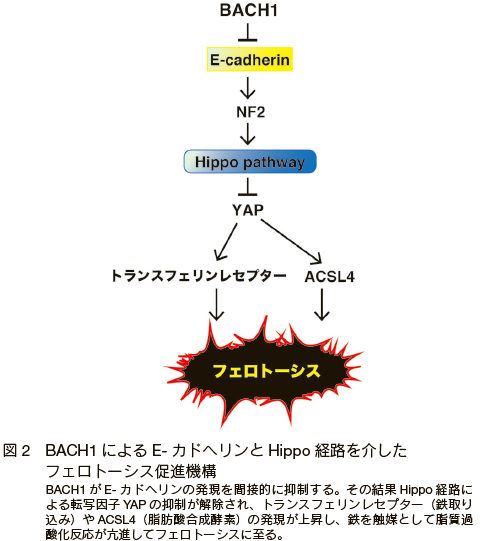
FSP1 と並んで、BACH1 とフェロトーシスの関連性を解き明かすための興味深い点として、近年報告された BACH1 による、がん細胞での上皮間葉転換(EMT: epithelial-mesenchymal transition)の促進機能がある 22, 23)。 BACH1 が膵臓癌や卵巣癌などの様々な癌種において、EMT を促進し、ひいては転移を促進することが分かったが 22, 23)、一方で、がん細胞が分子標的薬治療に耐性化する際にも EMT 様の変化が起こることも報告されている 24, 25)。前記の通り、EMT を起こして分子標的治療に耐性化したがん細胞はフェロトーシスには逆に感受性を示す 14, 15)。そのため、BACH1 は EMT を促進することによっても、フェロトーシスの感受性を増強する可能性がある。実際に BACH1 は EMT の際に、間接的に E- カドヘリンの発現を抑制することが分かっている 22)。E- カドヘリンの低下によって細胞接着が阻害されると細胞内で Hippo 経路が抑制されてフェロトーシスに感受性を示すことも報告されており 26)、BACH1 には E- カドヘリン- Hippo 経路を抑制することで、フェロトーシスを促進する機能もあると考えられる(図 2)。このように多くの知見が、BACH1 が極めて多角的にフェロトーシスを促進することを示唆しており、さらなる詳細な機能の解明が待たれる。
4. 脂質過酸化を介するフェロトーシスの細胞間伝播現象と治療応用の可能性
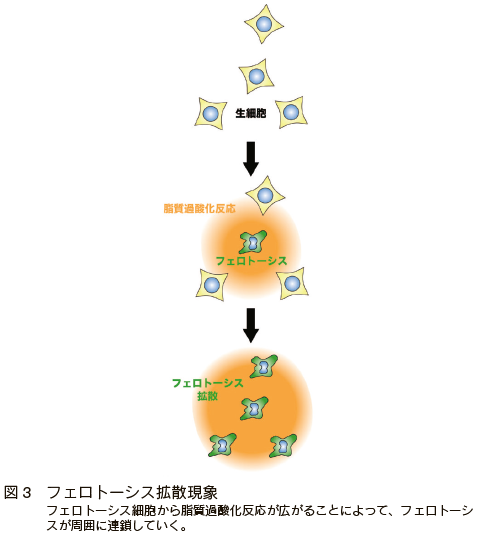
フェロトーシスに関する最近の発見として、フェロトーシス細胞からの分泌物を介した脂質過酸化反応とそれに伴う細胞死の伝播現象がある 16),27)。死細胞は単なる死んで除去されるだけの存在ではなく、炎症や組織再生など生体内の様々な局面において、情報発信体として働くことが近年多数報告されてきた 28-32)。こうした研究はアポトーシスを中心に行われてきたが、フェロトーシス細胞もアポトーシス細胞と同様に、周囲に様々な物質を分泌することで影響を及ぼしていることが予想されていた。以前から、I 型のフェロトーシス誘導剤(Erastin など、シスチンのトランスポーターの阻害薬、 図 1)を細胞に投与したときには細胞死が細胞集団の辺縁部から波のように広がることが分かっており、これがフェロトーシス細胞からの分泌シグナルによるフェロトーシスの伝播だと考えられていた 27,33)。また、生体内でフェロトーシスが生じた部位に、免疫細胞が集まることが腎尿細管やゼブラフィッシュで報告されていた 34, 35)。今回、私達はこれらの知見に加えて、フェロトーシス細胞の培養上清の正常細胞への移乗やフェロトーシス細胞と正常細胞との共培養によって、直接フェロトーシス刺激に曝されていない細胞にも脂質過酸化反応とともにフェロトーシスが伝播することを、過酸化脂質検出蛍光試薬 Liperfluo(同仁化学)とクサビラオレンジのレポーターマウス由来の MEFs を使うことによって示した 16)。これらの発見によって、フェロトーシスが脂質過酸化反応とともに細胞間で伝播する(図 3)ことがより確実になるとともに、実際にこの伝播現象をフェロトーシスによるがん治療に利用できる可能性も示唆された。逆に、この伝播現象が虚血性疾患をはじめとするフェロトーシス関連疾患の増悪の原因になっている可能性があり、これらの疾患の治療ターゲットにもなり得ると考えられた。
5. おわりに
本稿では、転写因子 BACH1 によるフェロトーシスの促進機構とフェロトーシス細胞からの脂質過酸化とフェロトーシスの伝播現象について紹介したが、将来的には、フェロトーシスによる、がん治療としての細胞療法にこの二つの知見が応用できる可能性があると考えている。 BACH1 の過剰発現によってフェロトーシスを誘導するシステムを確立し、腫瘍内に侵入した免疫細胞でフェロトーシスを誘導できれば腫瘍内にフェロトーシスを伝播させることで腫瘍縮小効果を得られる可能性がある。今後、フェロトーシスの誘導システムを洗練させることで、フェロトーシス伝播による細胞療法実現の可能性を探っていきたい。
| [ 著者プロフィール ] | |
| 氏名 | 西澤 弘成(NISHIZAWA Hironari) |
|---|---|
| 所属 | 東北大学大学院医学系研究科 生物化学分野 〒980-8575 仙台市青葉区星陵町2-1 Tel:022-717-7597 |
| 出身学校 | 東北大学 |
| 学位 | 博士(医学) |
| 現在の研究テーマ | フェロトーシスの生体内における意義とフェロトーシス細胞療法の探求 |
| 氏名 | 山中 美慧(YAMANAKA Mie) |
|---|---|
| 所属 | 東北大学大学院医学系研究科 生物化学分野 〒980-8575 仙台市青葉区星陵町2-1 Tel:022-717-7597 |
| 現在の研究テーマ | フェロトーシスにおける BACH family の役割の解明 |
| 氏名 | 五十嵐和彦(IGARASHI Kazuhiko) |
|---|---|
| 所属 | 東北大学大学院医学系研究科 生物化学分野 〒980-8575 仙台市青葉区星陵町2-1 Tel:022-717-7596 |
| 出身学校 | 東北大学 |
| 学位 | 博士(医学) |
| 現在の研究テーマ | 細胞分化を制御する遺伝子ネットワークとその病態 |

