細胞外小胞を介した細胞間コミュニケーションの可視化
近年、細胞から分泌される細胞外小胞(Extracellular vesicle; EV)が細胞間のコミュニケーションに重要な役割を担っており、生体内環境の調節や病態進展に関与していることが明らかとなりつつある。 EV の一種であるエクソソームの内部には分泌した細胞の核酸(microRNA 等)やタンパク質等が内包されており、実際にエクソソームを介して受け取り側の細胞に伝達され影響を与えていることが報告されている 1)。中でも、がんの悪性化や薬剤耐性の獲得にエクソソームが促進的に寄与することが明らかとなり、がん研究の分野で大きな注目を浴びている 2, 3, 4)。 Patel らは膵臓がん細胞が自身の分泌するエクソソームを介して活性酸素種(ROS)を消去する酵素である SOD やカタラーゼの発現を亢進させゲムシタビンに対する耐性を獲得していることを見出している 3)。さらには、オキサリプラチン耐性大腸がん細胞の分泌するエクソソームが非耐性がん細胞の解糖系を亢進(グルコース取り込み量や乳酸、 ATP 産生の増加)させ、薬剤耐性がん細胞へと変異させることが報告されている 4)。このようにエクソソームに代表される EV は自身が内包する伝達物質を介して様々な細胞機能変化を惹起することから、EV の受け渡しを詳細に解析することが様々な病態の解明につながる可能性を秘めている。
研究の進展に合わせて、 EV の伝達をイメージングする様々な解析手法が開発されてきた。最も一般的な手法は EV の脂質二重膜を染める蛍光色素を用いた標識技術であり、精製後の EV と混合するだけで簡便に蛍光標識が可能である。一方で、標識後の色素を除くことで生じるサンプルのロスや色素同士の凝集でミセルを形成するといった問題点があるため注意を要する。 in vivo でのより高感度な解析が可能な発光法を利用した解析手法も多くの研究者が報告している5, 6, 7)。これらの手法はいずれも EV 指向性タンパク質と発光レポータータンパク質ルシフェラーゼの融合タンパク質を EV 産生細胞に発現させることで EV を標識しており、これらルシフェラーゼ標識 EV を用いて体内分布の解析にも成功している。これらの手法に加え、EV 内包物の受け手側への伝達を解析する手法も報告されている。
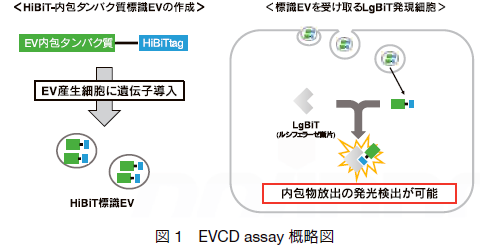
これまでの EV による情報伝達を解析する方法としては ①標識 EV の取り込み+ ②受け手側の表現型変化を確認することで間接的に評価するケースが多く、実際に取り込まれた EV からの内包物放出を直接確認することは困難であった。 Somiya らはこの課題を克服するために、ルシフェラーゼ断片(LgBiT)とそれに結合するペプチドタグ(HiBiT)を組み合わせた EV cargo delivery(EVCD) assay を開発した8)。 EVCD assay ではまず EV 産生細胞に EV 内包タンパク質と HiBiT tag の融合タンパク質を発現させ、HiBiT 標識 EV を作成する。この HiBiT 標識 EV を LgBiT 発現細胞に添加することで、 EV より放出された HiBiT tag 融合タンパク質と細胞質中の LgBiT が結合し、内包物の放出を発光で検出することが可能となる(図 1 参照)。この方法を用いて、Somiya らは EV 内包物の放出が通常条件下ではほとんど起こらないこと、また EV 表面に膜融合を促進するタンパク質(Vesicular stomatitis virus glycoprotein; VSV-G)を修飾することで細胞質中への内包物の放出が促進されることを見出しており、これまで不明な部分が多かった EV 内包物の放出機構の一端を明らかとしている。
本稿では、 EV を介した細胞間コミュニケーションやその研究の進展に伴い開発されてきた様々な解析手法に関して紹介してきた。これらの手法はそれぞれ特徴を有しているため、実験の目的に合った最適な標識手法を選択することが EV を介した細胞間コミュニケーションを正しく理解する上で重要である。今後も EV 研究の発展につれて様々な解析手法が生み出され、それによって EV を介した生命現象が解明されていくことが期待される。

[参考文献]
-
1) H. Valadi et al., Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells, Nat. Cell. Biol., 2007, 9, 654-659.
2) A. Zomer et al., In Vivo imaging reveals extracellular vesicle-mediated phenocopying of metastatic behavior, Cell, 2015, 161, 1046-1057.
3) G. K. Patel et al., Exosomes confer chemoresistance to pancreatic cancer cells by promoting ROS detoxification and miR-155-mediated suppression of key gemcitabine-metabolising enzyme, DCK, Br. J. Cancer, 2017, 116, 609-619.
4) X. Wang et al., Exosome-delivered circRNA promotes glycolysis to induce chemoresistance through the miR-122-PKM2 axis in colorectal cancer, Mol. Oncol., 2020, 14, 539-555.
5) Y. Takahashi et al., Visualization and in vivo tracking of the exosomes of murine melanoma B16-BL6 cells in mice after intravenous injection, J. Biotechnol., 2013, 165, 77-84.
6) C. P. Lai et al., Dynamic Biodistribution of Extracellular Vesicles in Vivo Using a Multimodal Imaging Reporter, ACS Nano., 2014, 8, 483-494.
7) T. Hikita et al., Sensitive and rapid quantification of exosomes by fusing luciferase to exosome marker proteins, Sci. Rep., 2018, 8, 14035.
8) M. Somiya and S. Kuroda, Real-time luminescence assay for cytoplasmic cargo delivery of extracellular vesicles, bioRxiv, doi; 10.1101/2020.10.16.341974.

