エクソソームにかかる期待とエクソソーム研究の難しさ
Hope for Exosomes and Problems in Exosome Research
 |
吉岡 祐亮 東京医科大学 医学総合研究所 講師 |
Abstract
Exosome research has been one of the hottest research fields in the last decade. Exosomes have changed the conventional concept of cell-to-cell communication and have been found to be involved in many biological phenomena. Furthermore, many researchers have entered the field of exosome research, and knowledge has been rapidly accumulated. In this paper, we will discuss the research difficulties and problems of exosome research and the benefits that exosomes bring to our life.
はじめに
現在、エクソソームと呼ばれる細胞外小胞が注目を集めている。もう少し、正確に言うと、 10 年ほど前から現在に至るまで注目されている。研究の世界で 10 年以上注目されて、一つの研究分野としてトレンドを作っていれば、ライフサイエンス研究界の “トップアイドル” と言っても良いだろう。このトップアイドルはアカデミアのみならず大手試薬会社や機器会社、製薬会社、食品会社など様々な産業分野の企業にも影響を与えている。したがって、最近ではエクソソームを用いた臨床応用や化粧品、食品などの産業応用に関する日本語総説もたくさん見かける。このような総説を見慣れた方も多いと思われるので、本稿では通常の総説とは少し異なる視点から、このトップアイドルに寄せられる期待とその実態、そしてその扱いの難しさという点を概説したい。
1. エクソソーム研究の歴史
エクソソームというものが有名になり、多くの研究者・学生に認知されてきているとは言え、その基本情報、特にエクソソームに関する歴史を中心にもう一度確認してみる。
1.1. エクソソーム研究のはじまりとは?
エクソソーム研究のはじまりは少し不明瞭であり、 60 年代後半から 70 年代とすることもあるが、これらの研究は現在でいうエクソソームという言葉の定義から外れている場合が多く、おそらく現在で言う microvesicle に近いものであろう。したがって、エクソソーム研究のはじまりは 1980 年代とされることが多い。 1983 年に Johnstone らが脂質二重膜構造を有する 100 nm ほどの小胞が細胞から分泌されることを発見したことに始まった 1)。 その後、1986 年と 1987 年に発表された論文内で、その小胞が再び「Exosome」と呼ばれて、エクソソームという呼び名が定着していった 2, 3)。ちなみに、上記で “再び” としたのは、Exosome という言葉自体が初めて用いられたのは 1981 年である 4)。しかし、このエクソソームというのは microvesicle を指していた可能性が高く、今で言うエクソソームとは異なっている可能性がある。以上のような背景から、エクソソーム発見の論文として引用されやすいのは Johnstone らのグループが発表した 1983 年 1) もしくは 1987 年3) の論文であるが、研究者によって、引用する論文が異なっており、エクソソーム研究の源流を紐解くのは、やや難解である。また、このエクソソーム研究を理解するのに障壁となっているのが、細胞が分泌する小胞はエクソソーム以外にも存在しているということが挙げられる 5)。エクソソームの定義として、 1980 年代に行われた研究から、エンドソームに由来する膜小胞と定義付けられている。もう少し詳細を述べると、後期エンドソームである multivesicular body(MVB)にエクソソームの前駆体らしき微小小胞が存在することが分かり(ILV, intraluminal membrane vesicle)、その細胞小器官を multivesicular endosomes(MVEs)と名付け、それら MVEs が細胞膜と融合し、分泌されているのが観察された。もちろん、観察結果はスナップショットであるため、これら結果を繋ぎ合わせてエクソソームの分泌過程が考えられたわけである 5)。しかし、エンドソームに由来しない細胞外小胞も存在しており、その代表例として、細胞膜に直接由来する microvesicle や細胞死の際に断片化した核などが細胞膜に内包され、分泌されるアポトーシス小体(apoptotic body)などがある。これら細胞外小胞はエクソソームと比較して大きさに違いがあるとされているが、分泌過程による定義付けがあるにも関わらず、分泌されてしまうと分泌過程に関しては見分けが付きにくく、 60 年代 〜 80 年代の研究においてはエクソソームと microvesicle やアポトーシス小体が混同されている場合がある。また、その大きさについて、きっちりと範囲が定められているわけではなく、研究者によっても小さい方は 40 nm 〜 と表記する場合もあるし、 50 nm 〜と表記する場合もある。 大きい方では 〜 150 nm や 〜 200 nm ということもある。もちろん、この範囲を 1 nm でも超えたらエクソソームではないのか、というとそういうわけではなく、この大きさの定義もエクソソームをややこしくしている一因である。さらに、 80 年代はエクソソームの役割も細胞が放出するゴミ袋として、細胞内、細胞膜の余分なタンパク質を細胞外に捨てることだと考えられていた 3)。 80 年代までのエクソソーム研究を読み解くと、現在、トップアイドルの座にいることが信じられないほど、あまり注目もされない、小さな劇場からのスタートであったことが分かる。
1.2. ブレイクのきっかけは?
前述したように、エクソソームは細胞の不要物を排出するゴミ袋だと考えられていた時代は、あまり注目されなかったが、いくつかブレイクのきっかけとなる研究成果があった。大まかに言えば、細胞間コミュニケーションツールとしての役割を持つことが判明したことがブレイクのきっかけとなっている。これらは何か一つの大きな報告で、説明できるものではなく、多くの研究成果の積み重ねの結果ではあるが、いくつかマイルストーンとなる研究があるので紹介する。一つは 1996 年に Raposo 博士らのグループの報告である 6)。この報告は免疫細胞を用いて行った研究で、エクソソームは他の細胞に対して機能を持つ小胞顆粒であることが示されている。つまり、エクソソームが他の細胞に影響を与えることが示され、ただのゴミ袋ではなく、細胞間でのコミュニケーションツールとして機能しうることが示され、徐々にエクソソームに対する見方が見直されるきっかけとなっている。また、エクソソームの持つ魅力は、多様な内包物にある。多様な内包物が多彩な生理現象や機能を担うのだが、 2000 年代は構成分子の同定が盛んに行われた。 2000 年前後にはプロテオーム解析の技術が普及し始め、エクソソームに含まれるタンパク質が解析されるようになり、今では一般的となっている CD9 や熱ショックタンパク質ファミリー、インテグリンファミリーがエクソソームに含まれることが明らかになった 7, 8)。さらに、タンパク質のみならず核酸、とくに microRNA(miRNA)がエクソソームに含まれることを Jan Lötvall 博士らのグループが報告すると、エクソソームへの注目度がより増した 9)。これらエクソソーム中の miRNA がエクソソーム受容細胞において機能することが判明し、細胞間コミュニケーションの新たな概念を打ち出されると 10~12)、ついにトップアイドルの座に駆け上がった。その後のエクソソーム研究の流れやエクソソームの活躍ぶりなどは最近の多くの総説などでまとめられているので、そちらを参考にして頂きたい。
2. エクソソーム研究のダークサイド
近年のエクソソーム研究において、エクソソームというものが、いかに素晴らしいかという報告はたくさんある。しかし、実際は研究をするために色々と乗り越えないといけない点が多く存在している。本項ではエクソソーム研究を行う際に問題となりうる点を列挙し、その理由を挙げてみる(図 1)。
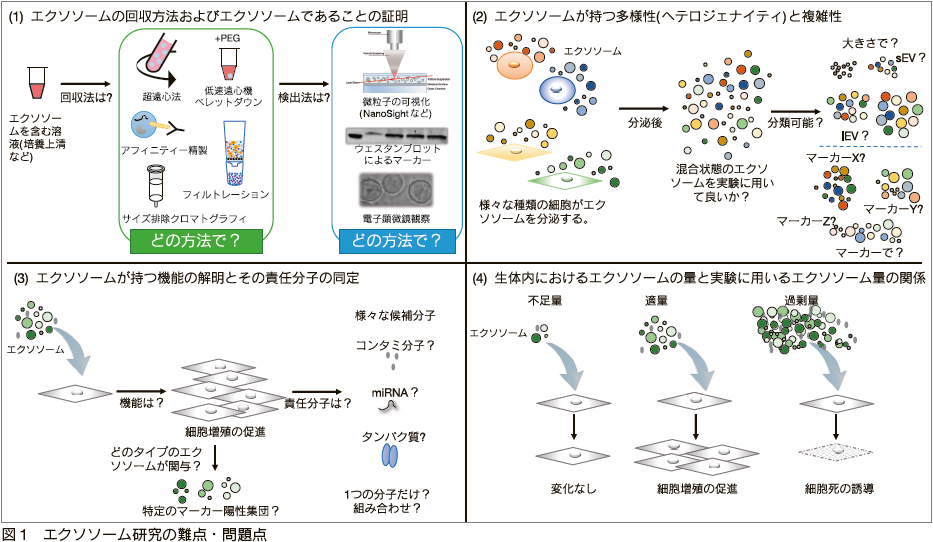
エクソソーム研究における難点・問題点をまとめた。(1)エクソソームの回収方法およびエクソソームであることの証明。エクソソーム研究の基本として、エクソソーム回収実験と回収したエクソソームが、エクソソームであるための証明が必要である。それらは複数の選択肢があり、それぞれの状況や目的にあった方法を選択する必要がある。(2)エクソソームが持つ多様性(ヘテロジェナイティ)と複雑性。エクソソームはあらゆる細胞から分泌されるが、それぞれの細胞から分泌されるエクソソームはそれぞれ異なった機能や内包物を持つ。さらに同一の細胞からも多様なエクソソームが分泌される。しかし、ほとんどの研究において解析されているエクソソームはこれら混合状態のエクソソームを一緒くたに解析し、平均化された結果を見ている。これらを分類し、解析できることがエクソソームのヘテロジェナイティを明らかにする鍵となる。(3)エクソソームが持つ機能の解明とその責任分子の同定。エクソソームを細胞に添加し、エクソソームが持つ機能解析を行う場合、どのようなタイプのエクソソームが機能を担っているのか、もしくはエクソソームに由来しない、夾雑物による影響も考えられる。また、エクソソームは分子の複合体であり、その責任分子の候補はたくさん存在する。複合体であるために、1 分子だけが機能発揮しているわけではなく、複数分子に起因することも考えられる。(4)生体内におけるエクソソームの量と実験に用いるエクソソーム量の関係。実験に用いるエクソソーム量にも注意が必要である。エクソソームの量が少ない場合は、エクソソームの影響が観察されない場合があり、過剰量である場合は生体内では起こりえない現象が起こりうる。ただし、適切な量というのは決まった量があるわけではない。
(1)エクソソームの回収方法およびエクソソームであることの証明
基本的なこととなるが、培養上清および体液などからエクソソームを回収し、それらエクソソームを解析する、という実験の流れが多くの研究で必要となってくる。しかし、この回収作業自体、色々な方法が存在しており、多くの研究者を悩ませるポイントとなっている。結論から言うとベストな方法がないので、その実験や目的にあったベターな回収方法を選択しているというのが現実である。例えば、一般的にエクソソームの回収量を上げようとすると、エクソソームの純度が低くなったり、逆に純度をあげようとすると回収量が減ったりするのが、エクソソーム回収方法の現状である。したがって、どのような実験に使用するエクソソームが欲しいのか、つまり回収量を優先するのか、純度を優先するのか念頭に入れる必要がある。さらに、純度 100%のエクソソームを手に入れるのはなかなか難しく、ある程度エクソソームに由来しない物質のコンタミネーションを許容しなくてはいけない。実は、エクソソームはとても扱いにくいアイドルということになる。大まかであるが、回収方法について表を作成したので、そちらを参考にして頂きたい(表)。また、回収してきたエクソソームがエクソソームであるのかを確認する方法も多様であり、こちらの選択も悩ましい。細胞程度の大きさがあれば、顕微鏡下ですぐにその存在を確認することができるが、エクソソームの場合は細胞の 100 倍以上小さいので通常の光学顕微鏡で確認するというのは難しい。そこで、一般的には電子顕微鏡を用いて形態的な観察から脂質二重膜微粒子を確認する方法やエクソソームマーカーと言われている、エクソソームに濃縮されているだろうタンパク質などを指標にして、その存在を確認する場合がある。近年では、 NanoSight や qNano などの微粒子の数や大きさを簡易的に測定できる機器もよく用いられている。ただし、これらは微粒子であれば検出してしまう、つまり、大きなタンパク質凝集体なども検出してしまうので、エクソソームに特異的な検出方法ではないことに留意する必要がある。会いにいけるアイドル、にはほど遠く、なかなかその存在を確認するのにも苦労するのである。
| 原理 | 特徴 | |
|---|---|---|
| 超遠心法 | 強い遠心力をかけることでエクソソームを沈殿させる。通常のペレットダウン法に加えて、密度で分離する密度勾配遠心法などもある。 | 現在、エクソソーム研究におけるエクソソーム回収法のスタンダードになっている。エクソソームの回収効率、精製度、ともに完璧ではないが、問題も少ない回収法。コストは比較的安い。 |
| 低速遠心によるペレットダウン | 培養上清や様々な体液に試薬(ポリマー)を加え、遠心機を用いてエクソソームを沈殿させることで濃縮する方法。 | 遠心機のみでエクソソームを濃縮できる。操作も容易であり、多検体処理にも優れている。一方、原理的にあらゆるサイズや密度の小胞を回収している可能性があり、精製度も高くないが回収効率は良い。 |
| アフィニティー精製(免疫沈降法) | 抗体などに磁気ビーズを結合させ、特定のタンパク質が表面に存在するエクソソームを捕捉し、マグネティックスタンドなどを使用して精製、回収する。抗体以外の物質(ペプチド など)を使用することも可能。 | エクソソーム膜表面に存在するタンパク質に対する抗体などを用いて、特定の集団を回収するため、興味のあるエクソソーム集団の解析などにも有用である。一方、免疫沈降前に何らかの方法でエクソソームを濃縮する必要があるなど、操作はやや煩雑である。精製度は高いものの、エクソソーム回収量は低くなる傾向にある。また、コストは比較的高くなりやすい。 |
| 粒子のサイズによる分画(フィルトレーション) | 限外ろ過フィルターを使って高分子のエクソソームをフィルター上に留まらせて、小さなタンパク質はフィルターより下に落とす。いくつかのフィルターを使うことで特定のサイズの大きさを持つ粒子だけを分取することも可能。 | サンプルを限外ろ過フィルターに通し、遠心などで 100 nm のサイズ粒子をフィルター上に残す。操作は容易く、一度に処理できるサンプル量も比較的多い。しかし、エクソソームが膜上に吸着し、ロスもしやすいのと、精製度はあまり良くない。 |
| サイズ排除クロマトグラフィーカラム | 担体を充填したカラムを用いて分子サイズでふるいにかける。小さい分子(タンパク質など)はポアに留まりやすいため、溶出が遅れるため、分子サイズの大きいエクソソームが先に溶出され分画することができる。 | 操作は簡便であり、精製度も高いが多検体処理にはあまり向いていない。サイズによるふるい分けを行うため、同じ大きさの顆粒が混入している場合は分離ができないが、夾雑タンパク質などとエクソソームの分離を行いやすい。溶出されるエクソソーム溶液はインプット溶液より希釈されるため、インプットのエクソソームを含む溶液の濃度を上げておく必要があるなど、手間がかかる場合もある。 |
(2)エクソソームが持つ多様性(ヘテロジェナイティ)と複雑性
エクソソーム研究を難しくしている要因の一つに、エクソソームが持つヘテロジェナイティがある。ここで言うヘテロジェナイティとは、エクソソームと一括りにしても、その大きさも内包物も多彩である、ということである。例えば、同じ細胞株を培養していても、遺伝子の発現プロファイルが異なっているように、同じ集団と認識していても、実は少しずつ異なる、ということに似ている。そもそも、人が勝手に細胞外小胞を分類し、それぞれに名前を付けたものに過ぎないから仕方ないことである。最近では、細胞外小胞の中でも遠心分離のスピードでさらに細かく 3 つに分類し、 large EV(lEV)と small EV(sEV)、さらに sEV の中でも特定のタンパク質で分類できることが報告され 13)、われわれが一括りにしていた “エクソソーム” には、やはりヘテロジェナイティがあることが報告されている。つまり、エクソソーム(とわれわれが呼んでいる微粒子)の内包物は一個一個異なっている可能性が大きい。このようなヘテロジェナイティがあるということは、私たちに見えているエクソソームは平均化された姿であり、個々の特徴を捉えていないため、細胞からの本当のメッセージを理解できない場合もあるだろう。このアイドル、実は大きなグループとしてのエクソソームというのがあり、さらにそこから大きさや特定のマーカータンパク質などで小さなグループに分けていっても、またさらに個別に個性をもった粒子たちの集団である。研究が進むにつれ、グループが増えたり、構成メンバーが増えるため、全てを把握し、理解するのにはかなりの労力が必要であろう。しかも、それら個々のエクソソームを解析する技術、すなわちシングルエクソソーム解析の技術は発展途上であり、これら技術の向上が、より深いエクソソーム研究に繋がると期待されている。
(3)エクソソームが持つ機能の解明とその責任分子の同定
エクソソーム研究の醍醐味の一つとして、エクソソームが持つメッセージを読み解き、どのような機能を持つか明らかにすることが挙げられる。そして、その機能を果たす責任分子を同定することである。しかし、これが一筋縄ではいかない。その理由は上記(1)と(2)も関係してくる。エクソソームの機能解析を行うと、まずは、本当にエクソソームが関与している現象なのか?という質問が出てくる。身も蓋もないような質問のように聞こえるが、実際にはかなりの割合でエクソソームではない、別の要素で起こっている現象を見ている可能性がある。それは(1)でも述べたようにエクソソームに由来しない物質も一緒に混入してきてしまい、それらエクソソーム以外の物質が引き起こした現象を見ている可能性がある。実は、エクソソームの機能だと思っていたものが、培地に添加したサイトカインがコンタミしてきたものであった、という場合もある。また、エクソソームの特定の機能に注目し、その機能を果たす責任分子の同定についても難しい点がある。まずは、エクソソームは多種多様な分子の複合体であるがゆえに、候補となる分子が多いという点が一つ挙げられる。注目すべき分子はタンパク質なのか、 miRNA なのか、または代謝産物なのか、という選択から迫られ、さらに、その中から特定の分子に辿り着くまでには、かなりの労力が必要となる。また、1 つの分子ではなく複数分子の関与から果たされている機能である可能性も大いにあり得る。さらに、(2)で述べたようにエクソソームのヘテロジェナイティがあるため、回収してきたエクソソームの中で特定のエクソソームだけが持つ機能を見逃す可能性が高いことも機能解析を難しくしている。個々のアイドルが持つ特徴を分析する際、どのような要因が人気に繋がっているのか、結論付けるの難しいのと似ているのだろうか。また、複数要因の可能性もあり、一つ(ないし一人)に着目するべきではないのかもしれない。
(4)生体内におけるエクソソームの量と実験に用いるエクソソーム量の関係
そして、本稿で取り上げる最後のエクソソーム研究の難題は実験に用いるエクソソームの量が適切であるかどうか、という問題である。別の言い方をすれば、その実験に使用しているエクソソーム量は、本当に生体内のエクソソーム量を反映している量なのですか、ということである。例えば、in vitro の細胞培養系の実験で 10,000 細胞に対して、1012 個のエクソソームを添加する実験を行ったとする。細胞 1 個辺りでは 108 個のエクソソームが一気に添加されたことになる。仮に 1 個の細胞が 24 時間に分泌するエクソソームの量が 1000 個だとすると、105 細胞が 1 日に分泌する量を 1 個の細胞が受け取る計算になる。どう考えてもアンバランスである。ただし、上記の数値はあくまで仮定であり、エクソソームの分泌量などの正確な数値が不明であるが、1 細胞あたりの 1 日の分泌量を正確に測定する技術はなく、結局のところ実験に使用した量が正解か不正解かも分からない状況である。さらに一気に高濃度のエクソソームに晒される状況は生体内ではほとんどなく、通常は常に一定量のエクソソームを受け取るチャンスがあると考えると、一度に大量のエクソソームを添加する実験系も生体内の状況を反映していないだろう。マウスなどの動物を用いた投与実験でも同じようなことが言える。したがって、(3)で述べた機能解析の結果、実は生体内でそのような機能は微々たるもので、エクソソームのオーバードーズによる副作用のようなものを解析しているに過ぎない可能性もある。エクソソームというアイドル、本来は 1 人 1 枚購入すれば十分な CD を 1 人が 1000 枚も購入している、というアンバランスな状況を生み出しているのかもしれない。
3. エクソソーム研究の光明
エクソソーム研究の難題について述べたが、この難題をクリアした先には、私たちの生活を豊かにしてくれる可能性がある。エクソソームに対する理解を深めることで様々な生命現象の解明に役立つだけではなく、冒頭でも述べたが、医療・食品業界に変化をもたらす可能性がある。エクソソームへの理解が深まることで生命現象の解明に役立つと期待される理由は、37 兆個もの細胞が協働して私たちの生命を維持していることを考えれば、必ず細胞間でのコミュニケーションツールが必要となり、そのコミュニケーションツールの一つにエクソソームがあるからである。また、疾患とはこれら細胞間のコミュニケーション不全などから引き起こされるのであろう。実際、エクソソームが多くの疾患に関与することが報告されている 14)。また、エクソソームの役割を逆手に取ることで疾患に対する治療や、エクソソームは疾患が発するメッセージであることから、疾患の有無やその状態を知らせるバイオマーカーになりうる。 2019 年には、オーストラリアで血小板由来の細胞外小胞による安全性と創傷治癒効果を評価する第 I 相臨床試験が始まった。これは Exopharm 社が持つ技術で血小板由来の細胞外小胞を精製し(彼らは PlexarisTM と名付けている)、商品化されたものが被験者に投与されている。この臨床試験では 20 人の被験者が、自身の血小板から精製されたエクソソームを投与され、創傷治癒効果が検証されている。他にも、2020 年 2 月には COVID-19 に対する治療を目的とした間葉系幹細胞に由来するエクソソームを用いた臨床試験が中国で開始された。この臨床試験では間葉系幹細胞エクソソームの吸入による重症患者の肺炎抑制効果を検証している。このようにエクソソームは様々な疾患に対する治療効果、特に抗炎症作用や再生医療に期待が集まっており 15, 16)、実際に上記のようにエクソソームをヒトへ投与する臨床試験も始まっている。このようにエクソソームは私たちの生活に浸透してきており、身近に感じる機会が増えてきてた。お茶の間に浸透してこそトップアイドル、という感覚に近いだろう。
4. おわりに
エクソソーム研究は 2010 年代から脚光を浴びている分野であり、この先も発展する分野だろう。なぜなら、上記のように、未知の部分や改善すべき点がまだ多く残されているため、“研究のやりがい” があるのと、やはり私たちの生活を豊かにする様々な可能性が見出されているためである。しかし、研究トレンドの移り変わりは激しく、ブームがいつ去るかは分からない。どの瞬間が人気絶頂のピークであるかは、過ぎ去ってからでないと分からないことが多く、いつまでエクソソームがトップアイドルとして君臨できるかは誰にも分からない。おそらく、技術的にも成熟し始め、臨床研究なども開始されてきたため、ここ数年が踏ん張り所であるだろう。そのためにも “量” だけでなく “質” の良い研究が求められており、今後のエクソソーム研究の動向から目が離せない。エクソソームは過去のアイドル、と言われないためにも、エクソソーム研究の成果が社会に還元される日が来ることを期待している。
| [ 著者プロフィール ] | |
| 氏名 | 吉岡 祐亮(YOSHIOKA Yusuke) |
|---|---|
| 所属 | 東京医科大学 医学総合研究所 分子細胞治療研究部門 〒160-0023 東京都新宿区西新宿6-7-1 教育研究棟13 階 Tel:03-3342-6111(内線 67136) Fax:03-6302-0265 |
| 出身学校 | 早稲田大学 |
| 学位 | 博士(理学) |
| 専門分野 | 分子腫瘍学、分子生理学 |
| 現在の研究テーマ | エクソソームが関与する病態メカニズムの解明、 エクソソームを用いたバイオマーカーおよび治療薬の開発 |

