小胞体 - ミトコンドリア接触領域の形成因子と細胞機能
The composition and cellular function of ER-mitochondria contact sites
 |
山本 真寿 熊本大学 大学院生命科学研究部 がん生物学講座 助教 |
 |
山口 知也 熊本大学 大学院生命科学研究部 がん生物学講座 准教授 |
Abstract
Eukaryotic cells contain various organelles which are compartmentalized by the intracellular membrane to maintain their identity and specialize biological process. These organelles are not only individual entities but also communicated between other organelles to perform their appropriate function. Such inter-organelle communication is achieved by canonical vesicular trafficking and physical associations between multiple organellar membranes. Here, we briefly review recent findings on the composition of ER-mitochondria contact sites and their cellular function.
1. はじめに
真核細胞内のオルガネラは、生体膜や相分離によって細胞質から区切られ個々の機能に特化した組成・構造を維持している細胞内コンパートメントである。このことは、オルガネラ間の物質輸送には大きな物理化学的障壁が存在することを意味しており、効率的な物質輸送には自由拡散に依存しない物質輸送経路が必要であると考えられる。このような細胞内輸送経路として「小胞輸送経路」が知られているが、ミトコンドリアなど明確な小胞輸送経路を持たないオルガネラの存在から、それ以外の経路の存在が考えられてきた。この小胞輸送に依存しない輸送経路のひとつとして考えられているのが「オルガネラ接触領域」を介した物質輸送が近年注目されている。二つのオルガネラが物理的に近接した接触領域では、イオンなど親水性分子が効率的に輸送されるだけでなく、リン脂質の様な疎水性分子も接触領域の繋留タンパク質を介して輸送されていると考えられている。さらに近年、オルガネラ接触領域は物質輸送だけでなく、オルガネラの形成やオルガネラの形態・動態を制御していることも明らかになってきた。本稿ではこれらオルガネラ接触領域の中でも特に研究の進んでいる「小胞体 - ミトコンドリア接触領域」に注目し、現在までに明らかにされた形成機構や生理機能について概説したい。
2.オルガネラ接触領域
オルガネラ接触領域の定義については議論が進んでいるものの 1)、厳密な定義は定まっていない。現時点における多くの研究者の認識は「繋留タンパク質を介して 2 つのオルガネラ膜が 10〜30 nm 程度に近接した領域」といえるだろう。オルガネラ接触領域は「接触」や「Contact」という言葉が用いられているが、オルガネラ同士の接触は繋留タンパク質を介した相互作用に限定されており、オルガネラ膜の融合は通常見られない。このことは 2 つのオルガネラが混ざり合うのではなく、個を維持したまま物理的に近接し、効率的に物質の輸送を行う「ゾーン」を形成することに接触領域の生理的な意義があるものと考えられる。
近年、細胞膜を含め様々なオルガネラ膜間に接触領域が存在することが相次いで報告されている。その多くは小胞体と他のオルガネラとの接触であり、細胞内の膜を有するオルガネラとの接触のほか 2)- 5)、ストレス顆粒や P 体(processing body)など相分離によって形成される膜を持たないオルガネラとの接触も報告されている 6)(図 1 左)。このことは小胞体が膜を構成するリン脂質分子を合成する場であることから、様々なオルガネラへ生体膜の材料となる脂質分子を効率的に輸送することを反映しているのかもしれない。また、ミトコンドリアも小胞体 7), 8)やペルオキシソーム 9)、エンドソーム 10)、脂肪滴 11)など様々なオルガネラとの接触が報告されており、これらは脂肪酸やトランスフェリンを介した鉄イオンのミトコンドリアへの取り込みなどに関与していると考えられている(図 1 右)。
このように様々なオルガネラ接触領域が報告されるに伴い、そのオルガネラ接触領域を形成する因子群の同定も進められてきた。後述する小胞体 - ミトコンドリア接触領域に関しては複数の繋留分子や調節因子の関与が見出されており、構成分子の異なる接触領域間での機能的な違いなどにも関心が向けられつつある。
その一方で、他のオルガネラ間接触領域の形成因子の同定はあまり進んでおらず、詳細がほとんど不明なままの接触領域もある。これらの新たに発見された接触領域については、単離精製法の開発と形成因子の同定、細胞・個体レベルでの生理的機能の解析が待たれる。
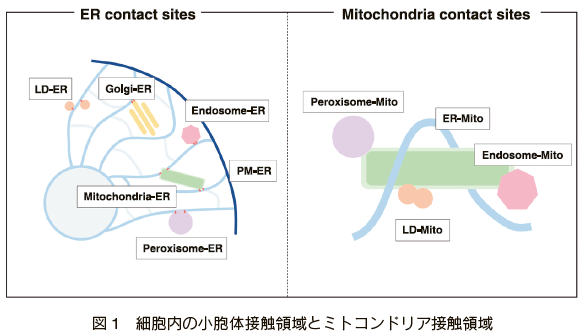
3. 小胞体 - ミトコンドリア接触領域 (ER-Mitochondria Contact Sites, EMCSs)
小胞体とミトコンドリアの接触領域は歴史的に最も早く見出された接触領域であり、1950 年代にラット肝細胞の電子顕微鏡解析において小胞体膜とミトコンドリア外膜の近接が報告された 12)(図2)。
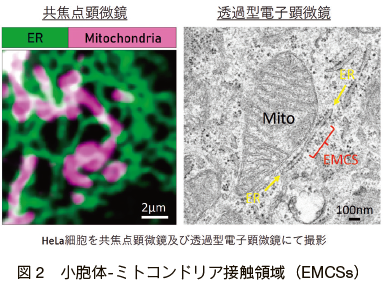
しかし当初は、この小胞体とミトコンドリア膜同士の近接に何らかの機能があるとはあまり考えられておらず、接触領域を単離精製する技術的な困難もあり長らく形態学的な解析に留まっていた。転機となったのは 1990 年の Vance による報告であり、ラットの肝臓から精製した粗ミトコンドリア画分に小胞体を主成分とするミクロソーム画分が含まれていること、この画分を Percoll 密度勾配遠心によって単離精製できることを示した 7)。この画分は現在 MAM (Mitochondria-Associated Membrane)画分と呼ばれるミトコンドリアと近接した小胞体膜画分であり、この発見によりEMCSs の生化学的な解析が可能となった。この MAM 画分にはリン脂質 13)やトリアシルグリセロール 14)、ステロール 15)など様々な脂質合成酵素群が多く含まれていることから、MAM はミトコンドリアと接触した滑面小胞体画分であり、小胞体からミトコンドリアへの脂質輸送を担っていることが予想された。他方、粗面小胞体も EMCSs を形成することが電子顕微鏡で観察されており 16), 17)、リボソームを含むためか膜間の近接距離は 50nm 以上と滑面小胞体の場合よりも大きいということはわかっているが、機能については不明な点が多く残されている。
4. EMCSs の形成機構と細胞機能
細胞内に存在する EMCSs は細胞種により多少の違いがあるが、小胞体とミトコンドリアのそれぞれ 10%程度が接触領域を形成している場合が多い。ミトコンドリアを基準に見てみると、HeLa 細胞では表面積の 10〜20%が 8), 18)、マウス肝臓では 4〜10%程度が小胞体と近接していると報告されている 19)。逆に小胞体は全体の 15%程度がミトコンドリアと近接していることが HeLa 細胞において報告されている 18)。このように細胞内では、想像以上に多くの小胞体とミトコンドリアが接触領域を形成しており、様々な細胞機能にとって重要な場となっていることが予想される。
EMCSs の形成機構は依然として不明な点が多いが、2 つの膜に存在するタンパク質間の相互作用によって形成されていると考えられている。これまでにイオンチャンネルやミトコンドリア融合に関与するタンパク質など、様々な分子が小胞体とミトコンドリア間の相互作用を担う形成因子として同定されている。哺乳動物ではこれら形成因子の 1 つを破壊・抑制しても EMCSs の個数や面積は部分的な減少に留まることが多いため、 EMCSs は一様な構造ではなく、複数の繋留複合体によって形成された多様性のある構造であることが予想される。以下では細胞内において EMCSs の関与が報告されている機能毎に形成分子を概説したい。
4.1. 小胞体 - ミトコンドリア間の Ca2+ イオン輸送
細胞内における Ca2+ イオンは非常に重要なセカンドメッセンジャーであり、 Ca2+ イオン濃度の変動は細胞のエネルギー代謝や細胞死、筋肉の収縮や神経伝達物質の放出など様々な生命現象に重要である。小胞体とミトコンドリアはともに細胞内における Ca2+ イオン貯蔵庫であり、刺激に応じて小胞体から放出された Ca2+ イオンをミトコンドリアが取り込むことで局所的な ATP 合成を促すとともに、過剰な Ca2+ イオンの流入は細胞死を誘導することが知られている 20)。この小胞体からミトコンドリアへの Ca2+ イオンの効率的な輸送が EMCSs の生理的意義の一つであると考えられている 8)。
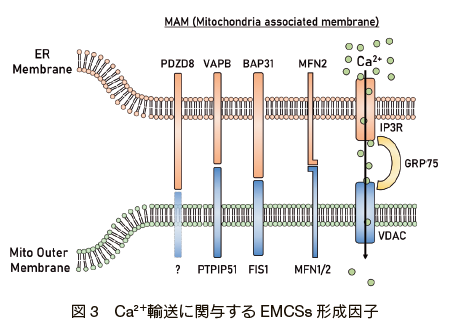
そのことを裏付けるように、小胞体から Ca2+ イオンを放出するチャネルであるイノシトール三リン酸受容体(IP3R)自体が、ミトコンドリア外膜のチャネルである VDAC と細胞質の GRP75 を介して 2 つのオルガネラを繋留する複合体として機能することが見出されている 21)(図3)。さらに IP3R のシャペロンとして安定化に寄与する Sigma-1 受容体も MAM に濃縮されており 22)、間接的に EMCSs の形成に寄与している。 Mitofusin2(MFN2)はミトコンドリアの融合に関与する分子であるが、EMCSs の形成因子としても広く知られている 23)。 MFN2 はその一部が小胞体に局在し、ミトコンドリアに局在する MFN1 及び MFN2 と結合し2 つのオルガネラを繋留するとされている 24)。 Mfn −/−ノックアウトの MEF では EMCSs の間隔が拡がり、ミトコンドリアへの Ca2+ イオン流入の減少がみられたことから Ca2+ イオンの輸送を担う EMCSs の形成因子と考えられる 24), 25) (MFN2 に関しては EMCSs の形成に負に作用するという相反する報告もあり 26), 27)、今後の詳細な検証が待たれる)。このほか BAP31-FIS1 28)、VAPB-PTPIP51 29)、PDZD8 18)など様々な分子が EMCSs の形成に関与し、ミトコンドリアへの Ca2+ イオン流入を促進することが示されている。一方、EMCSs の形成に阻害的に働く因子として FATE1 が知られている。 FATE1 は EMD や MIC60 と結合し小胞体とミトコンドリアの距離を拡げることにより EMCSs の形成を阻害することで、ミトコンドリアへの Ca2+ イオン流入を減弱させることが報告されている 30)。
このように小胞体とミトコンドリアの Ca2+ イオン輸送能については、多くの形成因子の関与が報告されており、水溶性の小分子である Ca2+ イオンの放出や吸収を制御する仕組みとして膜同士の物理的な近接は重要な役割を担っているのかもしれない。
4.2. 小胞体 - ミトコンドリア間の脂質輸送
リン脂質合成は主に小胞体で行われるが、いくつかのリン脂質合成酵素はミトコンドリアにも存在しており、例えばホスファチジルエタノールアミン(PE)の合成経路の一つであるホスファチジルセリン脱炭酸酵素(PSD)はミトコンドリア内膜に局在している 31)。そのため小胞体で合成したホスファチジルセリン(PS)をミトコンドリアへと輸送し、ミトコンドリアで合成した PE を小胞体へ送り返していることになるが、前述の通り小胞体とミトコンドリア間には小胞輸送経路がなく、EMCSs を介して脂質輸送が行われていることが予想されていた 7)。
その分子メカニズムの一端が明らかとなったのは、小胞体 - ミトコンドリアを人工的に繋留するリンカー分子を利用した出芽酵母の遺伝学的スクリーニングにより、 ERMES (ER-Mitochondria Encounter Structure)と呼ばれるタンパク質複合体が EMCSs の繋留因子として同定されたことによる 32)。 ERMES 複合体の欠損株では、PS → PE → PC という変換反応が有意に減少することが報告されており 32)、in vitro においても ERMES 複合体は、ATP などのエネルギーを必要とせずに 2 つのオルガネラ膜間の脂質輸送を担うことが明らかにされている 33)。これら ERMES 複合体を構成する 4 つのタンパク質のうち 3 つ(Mdm12, Mmm1, Mdm34)は SMP(Synaptotagmin-like Mitochondrial lipid-binding Profein)ドメインを有しており、疎水性度が高いポケットにリン脂質の炭化水素鎖が結合することが結晶構造解析から推定されている 34), 35)。このことからリン脂質は ERMES 複合体によって構成された疎水性環境を介して 2 つのオルガネラ間を行き来しているものと考えられている(図4)。
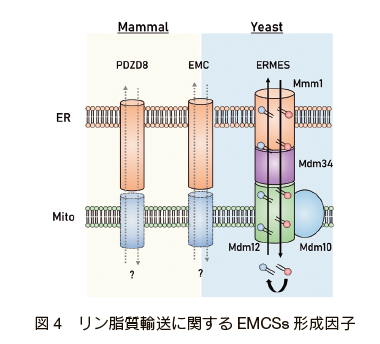
ERMES 複合体は長らく哺乳動物など高等真核生物でのホモログ分子が見つかっていなかったが、近年、ERMES 複合体の 1 つである Mmm1 の哺乳類ホモログ分子として PDZD8 が見出された 18)。PDZD8 は EMCSs の形成と Ca2+ イオン輸送能への関与は明らかにされているものの 18)、脂質輸送能については明らかではなく、他の ERMES コンポーネントのホモログ分子の同定などを含めて今後の研究が待たれる。
また、酵母から哺乳類まで遺伝的に保存された EMC(ER-membrane protein complex)複合体も EMCSs における脂質輸送への関与が報告されている 36), 37)。しかし、 EMC 複合体には脂質輸送に関与するドメインを持つ構成タンパク質がないことから、その詳細なメカニズムについては不明な点が多く残されている(図4)。
4.3. ミトコンドリアダイナミクス
ミトコンドリアは融合と分裂を繰り返す動的なオルガネラであるが、チューブ状の小胞体がミトコンドリアに絡みつくようにして収縮させることで、ミトコンドリアを分裂させていることが報告された 38)。このミトコンドリア分裂開始点に一過的に形成される EMCSs では、まず小胞体に局在する Formin タンパク質の一種 INF2 が集積し 39)、ミトコンドリアに存在する SPIRE1C と結合することでアクチンの重合が促進されることが分かってきた 40)。このアクチン繊維が収縮力となり、ミトコンドリアがくびれた部分にダイナミン様タンパク質の DRP1 や DYN2 が重合することで、最終的にミトコンドリアが分裂するというモデルが考えられている 38), 41)。
4.4. その他の機能
小胞体とミトコンドリアは ER ストレスや ATP 合成などの反応時に ROS を産生することが知られている。FRB-FKBP 二量体化法を用いて ROS センサーを EMCSs に標的化したところ、EMCSs 周辺は H2O2 が局所的に高濃度になっていることが見出された 42)。これは EMCSs において Ca2+ が小胞体からミトコンドリアへ流入することが引き金となり、ミトコンドリアに蓄積された H2O2 が細胞質へ放出されることによって形成される 42)。またこのようにして EMCSs 周辺に形成された酸化的環境は、局所的に p38α を活性化し、MIRO/TRAK 複合体を介したミトコンドリアの移動を阻害することが報告されている 43)。これによりミトコンドリアを EMCSs に留めることで、EMCSs を安定化させるという仮説が提唱されている。
さらに EMCSs はオートファジーとの関連についても報告されている。前述の通り MAM は生体膜の主成分であるリン脂質合成の場であり、特にオートファゴソーム膜や隔離膜のソースとしての役割が注目されている。飢餓刺激時にオートファゴソームの形成に重要な ATG14 や ATG5 が、SNARE タンパク質 STX17 によって EMCSs に集積されることや 44)、EMCSs 形成因子である MFN2 や PACS2 45)の発現抑制によって ATG14 の集積が阻害されることから、EMCSs がオートファゴソーム形成の場であることが示唆された 44)。また、出芽酵母においても ERMES 複合体の欠損によって隔離膜の形成が阻害され、マイトファジーが不全になることが報告されている 46)。その一方で、 Ca2+ 輸送に関与する繋留因子である VAPB と PTPIP51 の結合形成は、恒常的オートファジーに対して阻害的に作用することが報告されている 47)。小胞体からミトコンドリアへの Ca2+ の輸送を阻害すると、この効果は見られないことから、ミトコンドリアの Ca2+ レベルが関与していると思われるが、飢餓誘導によるオートファジーとの違いなど詳細は明らかにされていない。
5. 今後の課題
近年 EMCSs の形成や制御に関わる因子の同定や、様々な細胞機能との関連についての研究が大きく進んだ。しかしその一方で、解決すべき問題も多く残されている。 EMCSs をはじめとしたオルガネラ接触領域の研究に言えるのは、オルガネラ全体に与える影響を最小限にしつつ接触領域のみを操作することの困難さである。現在同定されている形成因子の多くは小胞体やミトコンドリアに広く分布しており、これらの遺伝子破壊や発現抑制によって得られた表現型が、接触領域の形成不全だけに起因すると断言することは難しい。この問題に対するアプローチとして、人工リンカーの発現によるレスキュー実験が行われることもあるがその解釈には議論の余地がある。今後、 EMCSs 形成能や EMCSs への局在能だけを欠損した変異体を探索する必要があると思われる。
また、 EMCSs の生成や崩壊の過程などのダイナミクスも興味深い点であるが不明な点が多い。数十 nm の EMCSs を正確に解析するには超解像ライブイメージングが必要と考えられるが、現在は一般的な研究室での実施は困難である。別のアプローチとして EMCSs のマーカー分子の探索や構築が考えられる。その一例として、最近報告された BRET ベースの EMCSs プローブは EMCSs の定量や動態解析に有効なツールとなる可能性がある 48)。このプローブは、単分子リンカーや二量体化リンカーのように 2 つの膜を人工的に繋留し続けることはなく、より生理的な EMCSs の動態を解析できると考えられる。ただ現時点では光学顕微鏡での観察は感度的に難しく、同報告にある顕微鏡観察用の FRET ベースのプローブは S/N 比が低く今後の改良が期待される 48)。
最後に、疾患など個体レベルの生命現象における EMCSs の意義の解明も今後の大きな課題である。これまでにアルツハイマー病の患者やモデルマウス由来の線維芽細胞においては野生型よりも 2 倍以上の EMCSs が形成されることが報告されているほか 49), 50)、Mfn2 欠損によって EMCSs を減少させた細胞ではγ- セクレターゼの活性が半分程度にまで減少する 49)。また、PTEN 51)や AKT 52)、p53 53)などのがん関連タンパク質が EMCSs に局在していることも知られており、特に小胞体からミトコンドリアへの Ca2+ の輸送を制御することでがん細胞の増殖や細胞死を制御していることも報告されている。このほかにもパーキンソン病など様々な疾患との関連が報告されているが、その病態において果たして EMCSs がどこまで重要な役割を担っているかはよく分かっていない。これまでに蓄積された EMCSs 形成の分子メカニズムや細胞機能の知見を、モデル生物や患者由来サンプルを用いた解析に取り入れることにより EMCSs の生理的な意義について解き明かしていく必要があるだろう。
多様な分野の研究者同士の「接触」がオルガネラ接触領域の謎を解き明かし、新たな発見がなされることを願いたい。
| [ 著者プロフィール ] | |
| 氏名 | 山本 真寿(YAMAMOTO Masatoshi) |
|---|---|
| 所属 | 熊本大学 大学院生命科学研究部 がん生物学講座 〒 860-8556 熊本市中央区本荘 1-1-1 Tel:096-373-5107 |
| 出身学校 | 京都大学 大学院生命科学研究科 |
| 学位 | 博士(生命科学) |
| 専門分野 | 細胞生物学 オルガネラ間相互作用 |
| 氏名 | 山口 知也(YAMAGUCHI Tomoya) |
|---|---|
| 所属 | 熊本大学 大学院生命科学研究部 がん生物学講座 〒 860-8556 熊本市中央区本荘 1-1-1 Tel:096-373-5107 FAX:096-373-5108 |
| 出身学校 | 名古屋大学 大学院医学系研究科 |
| 学位 | 博士(医学) |
| 専門分野 | がん生物学、細胞生物学 |

