
代謝制御による腫瘍免疫の向上
Metabolic intervention facilitates anti-tumor immunity
 |
西田 充香子 岡山大学 大学院医歯薬学総合研究科 免疫学分野 助教 |
 |
鵜殿 平一郎 岡山大学 大学院医歯薬学総合研究科 免疫学分野 教授 |
Abstract :
Tumor microenvironment is a special place characterized by low oxygen, low pH, low nutrient, and high lactate concentration. The unique condition generates metabolic competition between effector immune cells and growing cancer cells, because both cell populations require particularly glucose to survive and exert their function. In this context, the metabolic intervention - elevation of glycolysis of immune cells while decreasing that of tumor cells, would bring about significant shrink of tumors. In this special review, we at first overview the energy metabolism of each immune cell as well as tumor cell, and then present our recent finding with metformin, a first line drug for type 2 diabetes mellitus (T2DM), which might provide useful metabolic intervention in tumors to achieve more effective anti-tumor effects along with the currently ongoing cancer immunotherapy.
1. はじめに
腫瘍局所は低酸素、高乳酸による低 pH に加え、低栄養な環境である。免疫細胞がその機能を発揮するためには栄養とくにグルコースを必要としている。皮肉なことに腫瘍細胞も大量にグルコースを消費し、増大する。このように腫瘍微小環境においてはエフェクター免疫細胞と腫瘍との間にグルコースの奪い合い、すなわち代謝競合が起こっている。競合に負けたエフェクター免疫細胞は次第にその機能を失い、腫瘍は増大へと向かう。このように代謝が腫瘍の運命を決定付けているということは興味深い知見である。見方を変えれば、個々の細胞の代謝を上手く制御することができれば腫瘍退縮へと導くことが可能となり、代謝制御は新たな免疫治療のターゲットとなりうる可能性がある。
本稿では腫瘍免疫に関わる細胞群の代謝について概説し、個々の細胞の代謝を制御する手段や免疫療法への応用についても紹介する。
2.免疫細胞の代謝
細胞は大きく分けて解糖系と酸化的リン酸化(OXPHOS)、脂質酸化(FAO)経路を駆動させることによってエネルギーを得ている 1)。細胞がどの代謝に依存してエネルギーを得るかによって細胞の種類や機能が変化する 2)。この章では個々の細胞の代謝について説明する。
1)CD8 T 細胞
未感作な CD8 T 細胞は FAO、OXPHOS に依存しているが、抗原提示細胞である樹状細胞より抗原刺激を受けると、T 細胞受容体(TCR)および副刺激受容体 CD28 の下流の PI3K-Akt-mTOR 経路が活性化する。 mTOR は様々な代謝経路を調節し、特に mTOR の下流に存在する IRF4 分子がエフェクターCD8 T 細胞を誘導する転写因子である T-bet、Blimp-1 の発現を誘導し、さらに mTORC1 は糖代謝関連因子を調節する転写因子である c-Myc、HIF1αの発現を介して、CD8 T 細胞膜上にグルコーストランスポーターである Glut-1 を誘導し、その結果、グルコース代謝が亢進し、CD8 T 細胞の活性化、分化、増殖を促す 3)4) 。この解糖系の亢進は CD8 T 細胞がエフェクター機能を発揮する上では重要であり、実際に解糖系の律速酵素であるヘキソキナーゼ 2(HK2)をグルコースの類似体である 2- デオキシ -D- グルコース(2-DG)で阻害するとエフェクター機能が低下する 5)。また、解糖系の中間代謝産物であるホスホエノールピルビン酸(PEP)は小胞体内へのカルシウムの再流入を抑制し、細胞外からのカルシウムの流入を亢進させ、転写因子 NFAT を核内へと移行させてサイトカイン産生を誘導する 6)。さらに 3- ホスホグリセリン酸(3-PG)はアミノ酸であるセリンへ変換され、核酸合成に使われる 7)。そして解糖系から派生するペントースリン酸化経路は、核酸合成に必要なリボース 5 リン酸そして脂質合成に必要な NADPH を合成する。また NADPH には抗酸化物質である GSH を還元状態に保つ働きがあり、GSH は NFAT、mTOR 活性化の維持に関与し Myc を介して解糖系を誘導するとの報告もある 8)。また、解糖系酵素である GAPDH はグルコース非存在下すなわち解糖系が抑制された状況では IFNγの翻訳を抑制する 9)。このようにエフェクター CD8 T 細胞は解糖系に依存して機能し、増殖する。また、二次応答の際に重要な記憶 CD8 T 細胞においては局所で抗原に対して速やかに応答するエフェクターメモリー CD8 T 細胞は解糖系に依存しており 10)、二次リンパ組織に存在して長期的に抗原に応答するセントラルメモリー CD8 T 細胞は FAO、OXPHOS に依存している 11)。また、近年同定された末梢組織へ移行後、体内循環せず組織に存在し、抗原に応答するレジデントメモリー CD8 T 細胞(TRM)は脂質の取り込みが高く FAO、OXPHOS に依存している。また TRM では Fatty acid binding protein 4,5(FABP4、FABP5)の発現が亢進しており、 FABP4、FABP5 が欠損すると脂肪酸の取り込みが低下し TRM の生存が阻害され、数が減少する 12)。
2)CD4 T 細胞
CD4 T 細胞は周囲のサイトカインの環境の違いによって異なるサブセットに分化する 。 IL-12、IFNγ存在下では CD4 T 細胞は転写因子 T-bet を発現し IL-2 、IFNγを産生する 1 型ヘルパー T 細胞(TH1 細胞)へと分化する。TH1 細胞はマクロファージ、細胞傷害性 T 細胞(CTL)を活性化し細胞内の病原菌排除に関与しており、解糖系に依存している13)。次に IL-4 存在下では転写因子 GATA-3 を発現し、 IL-4、 IL-5、 IL-13 を産生する 2 型ヘルパー T 細胞(TH2 細胞)へと分化する 。 TH2 細胞は寄生虫の排除や B 細胞の抗体産生を刺激、アレルギー反応にも関与しており、解糖系に依存している 13)。また、 IL-6、TGFβ 存在下では転写因子 RORγt を発現し IL-17A、IL-17F、IL-22 を産生するヘルパー T 細胞である TH17 細胞へと分化する。TH17 細胞は好中球の活性化、炎症性腸疾患などの自己免疫疾患の発症に関与し、解糖系に依存しており、IL-17 の産生を維持している 13)。さらに、TH17 細胞への分化においては脂肪酸合成の律速酵素である ACC1 の活性が重要とされており、ACC1 を阻害すると実験的自己免疫性脳脊髄炎(EAE)において TH17 細胞の分化が抑制され、症状が改善するとの報告もある 14)15)。次にナイーブ CD4 T 細胞は、TGFβ、 IL-2 存在下では転写因子 Foxp3 を発現し TGFβ、 IL-10 を産生する制御性 T 細胞(Treg)へと分化する。 Treg は免疫抑制に関与し、腫瘍免疫においても重要な細胞である。Treg はマスター遺伝子である Foxp3 を発現しており 、Foxp3 がミトコンドリアの電子伝達系を活性化し、ミトコンドリア機能を高め、Treg の代謝を OXPHOS、 FAO の方向へとシフトさせる 16)。さらに Foxp3 は c-Myc の発現を抑制し、解糖系を抑制している。逆に Treg の解糖系が亢進すると mTOR 経路の活性化依存的に Foxp3 の発現は低下し、腫瘍内での数も減少する 17)。このように代謝とマスター転写因子 Foxp3 には密接な関係が存在する。また Foxp3 による OXPHOS の誘導は細胞内の NAD+/NADH の割合を増加させ、乳酸をピルビン酸に変換して、腫瘍局所の高乳酸条件下において乳酸による機能抑制効果から免れている 18)。このように Treg は解糖系を抑制し、 OXPHOS を亢進させることで腫瘍微小環境に適応している。
3)骨髄球性細胞(マクロファージ、MDSC)
炎症型の M1 マクロファージは TNFα、 IL-12 の産生を介した抗腫瘍効果の発揮に重要な細胞であり、 LPS や IFN の刺激によって HIF1α、mTOR の活性化を介して代謝を OXPHOS、FAO から解糖系へとシフトさせる。その一方で免疫抑制に働く非炎症型(創傷治癒型)の M2 マクロファージは FAO、OXPHOS に依存しており、免疫抑制性サイトカインである IL-4、IL-10 を産生する 19)。さらに腫瘍局所に存在し、免疫抑制に働く M2 型腫瘍関連マクロファージ(M2-like TAM)や骨髄由来抑制細胞(MDSC)は OXPHOS、FAO に依存しており、それぞれの代謝が解糖系優位になると M2-like TAM は M1-like TAM に分化し、MDSC はその数が減少し、それぞれ本来の機能を失う 20)。
4)樹状細胞、NK 細胞
抗原提示細胞である樹状細胞は TLR からのシグナルを受けると PI3K-Akt 経路を駆動させ、解糖系が亢進すると、 IL-12 の産生や活性化マーカーである CD86 や MHC class Ⅱ の発現が上昇する。その活性化は解糖系阻害剤である 2-DG 処置によって抑制される 21)。 NK 細胞も抗腫瘍免疫に重要な細胞で解糖系亢進によって IFNγ、グランザイム B を産生し、その機能を発揮する 22)23) 。
3.腫瘍の代謝
腫瘍細胞は有酸素下でも解糖系に依存してエネルギーを得ている(ワールブルグ効果) 24)。さまざまながん原遺伝子はグルコーストランスポーターの発現、そして解糖系酵素誘導し解糖系を上昇させる方向へ導いていることからも腫瘍の解糖系への依存度は大きく 25)、腫瘍細胞が大量のグルコースを消費するため腫瘍微小環境は他の組織と比較してグルコース濃度が極端に低い 6)。 Rathmell らの報告によるとがん抑制遺伝子である VHL 遺伝子に変異のある腎細胞癌では HIF1αが過剰発現し、腫瘍細胞の解糖系を亢進させるが、その一方で腫瘍に浸潤する CD8 T 細胞の解糖系は抑制され、さらに PD-1 の発現が上昇し、増殖や機能が低下していることを見出している 26)。さらに Chang らは主要な拒絶抗原を有する腫瘍(Regressor:R 腫瘍)と拒絶抗原を有さない腫瘍(Progressor:P 腫瘍)を用いて CD8 T 細胞と P 腫瘍を共培養すると CD8 T 細胞の IFNγの産生量が低下し、この作用はグルコースを添加すると解消されることを明らかにした。グルコース消費速度は、P 腫瘍のほうが R 腫瘍よりも高いことも証明している 27)。これらの報告から悪性度の高い腫瘍は解糖系がより亢進しており、低グルコースの腫瘍微小環境下ではエフェクター細胞が十分にグルコースを利用できず、解糖系が抑制され、疲弊状態に陥っていることが示唆されている。また解糖系によって生じた乳酸は免疫細胞を抑制するだけでなく、腫瘍細胞自身がモノカルボン酸トランスポーターである MCT1 を介して乳酸を取り込み、乳酸からピルビン酸へ変換して TCA 回路を回して増殖維持に使用している 28)。興味深いことに腫瘍の転移には OXPHOS、FAO が関与しており転移細胞は PGC1αの発現が高く、ミトコンドリア機能を亢進させて OXPHOS に依存してエネルギーを得ており、腫瘍細胞は置かれた状況に応じて代謝を使い分けることで生存を図っている 29)。
さらに腫瘍組織に存在する脂肪細胞からペプチドホルモンであるレプチンが産生され、このレプチンが CD8 T 細胞の STAT3 を活性化し、代謝を解糖系から FAO へとシフトさせ、IFNγ産生を抑制し、腫瘍モデルにおける CD8 T 細胞を介した抗腫瘍効果を消失させる 30)。
このように腫瘍組織を構成する脂肪細胞も免疫細胞の代謝に影響を与えているという知見は大変興味深い。
ここまで免疫細胞と腫瘍細胞における代謝について概説したが、個々の細胞を代謝で大きく分類すると抗腫瘍効果に必要な細胞(エフェクター細胞)は解糖系、免疫抑制すなわち免疫寛容を起こさせる細胞は OXPHOS、FAO に大部分は依存していることが分かる(図 1)。
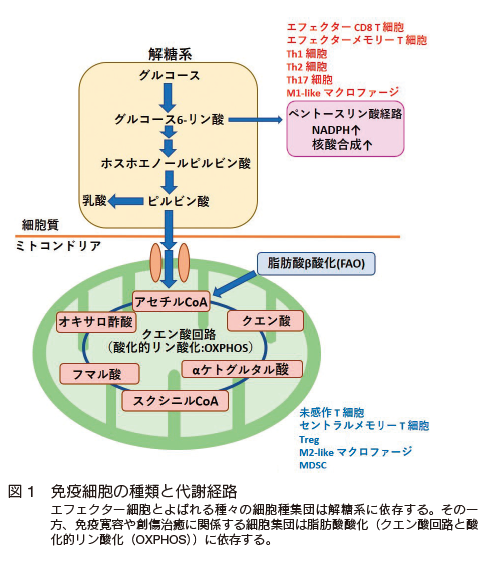
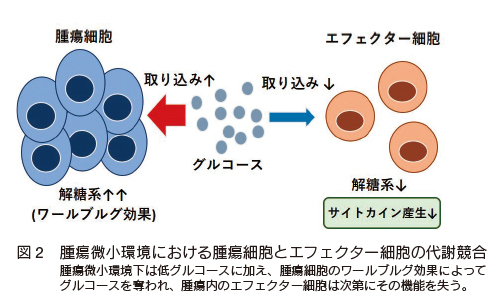
周知のように腫瘍細胞も解糖系に依存しており、抗腫瘍効果に必要なエフェクター細胞との間ではグルコースを巡る代謝競合は必然である(図 2)。しかし、腫瘍局所は粗雑な血管である腫瘍血管が多く造成しており物質交換がうまく機能しない。よってグルコースを始めとした各種の栄養素、および酸素が腫瘍局所に到達できない。さらに、多くの免疫細胞の浸潤も十分にできない。すなわちエフェクター免疫細胞の浸潤、樹状細胞(B7 を発現し、 T 細胞の CD28 と会合)の浸潤も低下する 31)。従い、腫瘍内で如何に効率的にエフェクター免疫細胞がグルコースを利用し解糖系を亢進させることができるか、また、正常な腫瘍血管を構築できるかが抗腫瘍効果の発揮には重要な鍵となってくる。次に代謝制御による抗腫瘍効果の向上について説明する。
3.代謝制御による治療
これまで述べてきた背景から腫瘍細胞の解糖系を阻害するため 2- デオキシグルコース(2-DG)などの解糖系阻害剤を用いたがん治療研究も行われてきた 32)。しかしエフェクター細胞も解糖系を利用しており、腫瘍だけでなくエフェクター細胞の解糖系も低下させてしまう可能性があり、その選択性が問題となった。そのような中、 2018 年に単糖類の D- マンノースがホスホマンノースイソメラーゼ(PMI)の発現が高い腫瘍に限り、その解糖系を抑制するといった報告がなされ、ある特徴を持つ腫瘍に特異的な治療法も出てきた 33)。さらに腫瘍血管内皮の代謝制御も重要との報告もある。腫瘍血管内皮は解糖系活性化酵素の PFKFB3 の発現が高く、解糖系の亢進により血管内皮のバリア機能を低下させ、腫瘍の浸潤・転移を促進する。事実、 PFKFB3 の阻害剤を処置すると血管内皮のバリア機能も正常化し、転移も抑制される 34) 。腫瘍の制圧には腫瘍細胞や免疫細胞だけでなく、腫瘍組織を構成する細胞集団を含めて考える必要がある。
このようにさまざまな代謝制御法が報告される中、免疫細胞の解糖系を上昇させ、その一方で、腫瘍細胞の解糖系を抑制し、腫瘍微小環境全体の代謝を改変させるような代謝制御法は未だ確立されていない。我々はこれまでに 2 型糖尿病治療薬メトホルミンの誘導する抗腫瘍効果の研究からメトホルミンによる解糖系の亢進が、腫瘍局所の CD8 T 細胞の機能を高め 35) 、Treg、 MDSC においては数、機能を低下させ、さらに M2-like TAM を M1-like TAM へとシフトさせることを明らかにしてきた 17) 20)(図 3)。しかしメトホルミンが腫瘍細胞の代謝に及ぼす影響についてはまだ不明な点が多く、現在、検討中であるがこれまでに明らかになってきたことを一部、紹介したい。
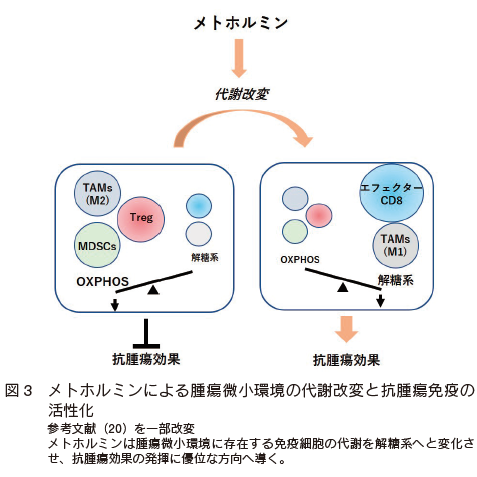
4.メトホルミンによる免疫細胞と腫瘍細胞の代謝改変
メトホルミンを処置したマウスの腫瘍塊から CD8 T 細胞と腫瘍細胞を回収し、解糖能を評価するためグルコースのトランスポーターである Glut-1 の発現そしてグルコースのアナログである 2-NBDG の取り込み能を検討したところ、興味深いことにメトホルミン処置によって CD8 T 細胞の Glut-1、 2-NBDG の取り込みは上昇していたが、腫瘍細胞においては Glut-1、 2-NBDG の取り込みはむしろ低下するということが分かった。さらにメトホルミンと抗 PD-1 抗体併用治療においてはさらにその傾向が強く、驚くべきことにメトホルミンは免疫不全マウスに移植した腫瘍細胞の解糖能には影響を及ぼさないことも明らかとなってきた。すなわちメトホルミンによる腫瘍細胞の代謝改変には免疫系が必要であることを示唆しており、そのメカニズムについては検討中であるが、メトホルミンが如何にして免疫細胞と腫瘍細胞において代謝を逆に制御することが可能なのか、この謎を解明できれば、細胞選択的代謝制御法の開発に繋げることが可能になり、腫瘍を制圧する方法を見出すことができるのではないかと考えている。
5. おわりに
腫瘍局所における免疫細胞の機能不全は従来、慢性的な抗原刺激によるものとされていたが、それに加え、腫瘍微小環境での免疫細胞と腫瘍細胞の代謝競合も重要な一つの理由と考えられる。腫瘍微小環境に存在する異なる細胞集団の代謝を腫瘍退縮に有意な方向へ代謝を制御できれば腫瘍免疫の向上にもつながり、さらに細胞の代謝状態を評価することで免疫療法の効果判定や予後予測にも応用できる可能性がある。また、あらゆる組織、臓器においては、これを構成する細胞集団の代謝はある一定の規律と方向性をもって制御されているはずである。逆にいえば疾患とその病因は、個々の細胞代謝変化(異常)とリンクしているはずである。その意味で腫瘍免疫だけではなく、あらゆる疾患病態を代謝という新たな尺度で見直すという作業は、今後ますます重要になってくると考えられる。
| [ 著者プロフィール ] | |
| 氏名 | 西田 充香子 |
|---|---|
| 所属 | 岡山大学 大学院医歯薬学総合研究科 免疫学分野 〒 700-8558 岡山県岡山市北区鹿田町 2-5-1 Tel : 086-235-7188 |
| 出身学校 | 岡山大学 |
| 学位 | 博士(医学) |
| 現在の研究テーマ | メトホルミンによる腫瘍微小環境の代謝改変 メカニズムの解明 |
| 氏名 | 鵜殿 平一郎 |
|---|---|
| 所属 | 岡山大学 大学院医歯薬学総合研究科 免疫学分野 〒 700-8558 岡山県岡山市北区鹿田町 2-5-1 Tel : 086-235-7187 |
| 出身学校 | 長崎大学 |
| 学位 | 博士(医学) |
| 現在の研究テーマ | 代謝から読み解く腫瘍免疫学 |

