
ハイスループットバイオフィルム薬剤感受性試験法
High-throughput method for the susceptibility testing of microbial biofilm
 |
塚谷 忠之 福岡県工業技術センター 企画管理部 情報交流課 専門研究員 |
Abstract
Biofilms are formed when microorganisms adhere to a solid surface and then encase themselves in a self-produced matrix of extracellular polysaccharides and proteins. Biofilms are extremely difficult to eradicate, and are closely related to various chronic or device-related infections. Therefore, antimicrobial susceptibility testing of microbial biofilm is increasingly important for appropriate patient management and clinical surveillance. A high-throughput method for the susceptibility testing of microbial biofilm using a microbial viability assay based on reduction of a tetrazolium salt WST and the biofilm formation method on 96-pins in the lid of a microtiter plate was developed. The conditions for biofilm formation of Escherichia coli, Porphyromonas gingivalis, Pseudomonas aeruginosa, Staphylococcus aureus, Staphylococcus epidermidis, and Strepotococcus mutans were established. The biofilms formed on the 96 pins were challenged by antibiotics, and the minimum biofilm inhibitory concentration (MBIC), minimum biofilm bactericidal concentration (MBBC), and minimum biofilm eradication concentration (MBEC) were sequentially determined. The MBIC and MBBC were determined from the turbidity of the microplate contents after antibiotic exposure and after further incubation in recovery medium, respectively. Finally, the MBEC was determined from the microbial viability of the biofilms formed on the 96 pins, assessed by the WST colorimetric assay. The MBECs obtained by the proposed and conventional methods favorably agreed. In addition, we clarified that S. aureus biofilm was maximally suppressed by a combination of vancomycin, daptomycin, and teicoplanin. The proposed method yields similar performance to conventional methods, but is faster and more easily implemented. Therefore, the proposed method alleviates the tediousness and time-consuming nature of conventional biofilm susceptibility assay.
キーワード : バイオフィルム、薬剤感受性試験、水溶性テトラゾリウム塩、マイクロプレート
1. はじめに
バイオフィルムは、微生物自身が産生する多糖類やタンパク質を主成分とする細胞外マトリックスにより、界面や生体などの固体表面に付着して存在する微生物の集合体である。 バイオフィルムの形成は、微生物が厳しい環境中で定着し、生き残るための戦略であると考えられている 1)。 身近なところでは口腔内プラークなどが代表例として挙げられるが、近年はカテーテルや人工関節などの人工医療材料を用いた治療の増加に伴い、バイオフィルムに関連した感染症が増加している。ヒトの難治性感染症の多くにバイオフィルム形成微生物が関与していることが報告されており、形成されたバイオフィルムは抗生物質などの治療薬に対して抵抗性を示すことで感染症を難治化させている 2)。
バイオフィルムによる感染症を治療するためには、形成されたバイオフィルムの薬剤感受性を迅速に把握することが非常に重要である。 しかし、従来の planktonic cells を対象とした薬剤感受性試験法(CLSI 法)の結果と治療効果との間には相関性が認められてない。 このため、バイオフィルムを対象とした薬剤感受性試験法が求められており、その開発が進められている 3)。
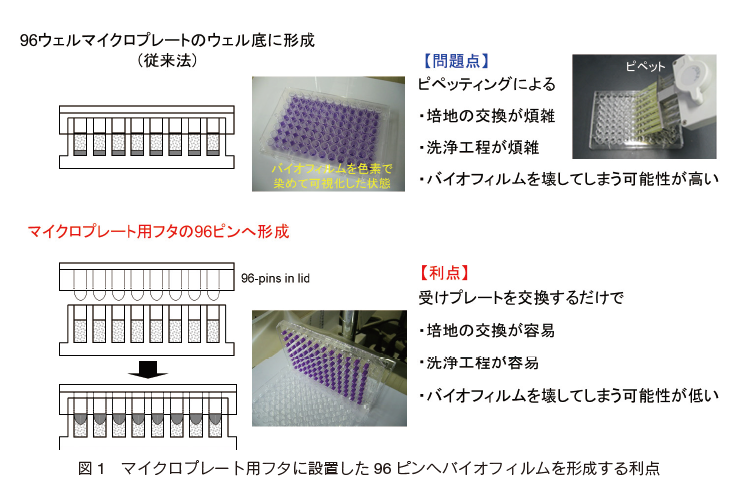
バイオフィルム薬剤感受性試験には、主に 96 ウェルマイクロプレートのウェル底にバイオフィルムを形成させて測定する手法が適用されてきたが、近年、マイクロプレート用フタに設置した 96 ピンへバイオフィルムを形成させて評価する手法が報告され、その活用が進められている 4)。この手法は、従来の手法と比べて培地交換や洗浄の工程が簡便であり、加えてピペッティングなどの操作ミスでバイオフィルムを崩してしまう恐れが格段に低いため有望な方法と考えられる(図 1)。
著者らは、図 1 に示す「マイクロプレート用フタに設置した 96 ピンへのバイオフィルム形成法」と「水溶性テトラゾリウム塩 WST を用いた微生物活性測定法(図 2)」5) を組み合わせることで、操作性と迅速性に優れたバイオフィルム薬剤感受性試験法の開発を行ってきた 6)。 本稿では、本法の操作手順と本法を用いて実施したバイオフィルム薬剤感受性試験の一例について紹介する。
2. 水溶性テトラゾリウム塩 WST を用いた微生物活性測定法
まず、バイオフィルム薬剤感受性試験を迅速・簡便化するために必要となる水溶性テトラゾリウム塩 WST を用いた微生物活性測定法について紹介したい。
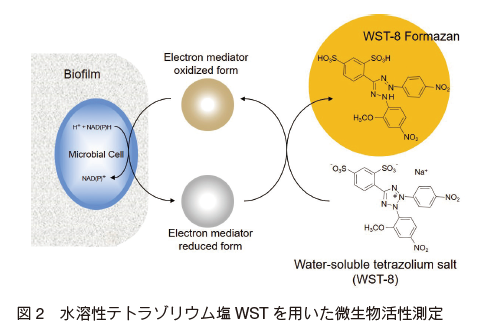
NADH(NADPH)はエネルギー代謝活動に関与する補酵素であり、生命体の活動の一役を担っている。 微生物は細胞内の NADH(NADPH)を利用することで外部から供給された酸化型電子メディエータ(キノン化合物など)を還元し、還元型電子メディエータ(ヒドロキノン化合物など)を生成することが知られている 7)。 ここへ発色還元試薬である水溶性テトラゾリウム塩(Water Soluble Tetrazolium salts, WST)が共存すると、生成したヒドロキノン化合物により還元を受けてホルマザン色素が生成される(図 2)。 この一連の反応は微生物の代謝反応を介して起こることから、生成したホルマザン色素量は微生物の代謝活性に比例することになる。 つまり、生きている微生物細胞では代謝が起こり発色するが、死んでいる微生物細胞では発色は生じない。この測定系では吸光度と生成するホルマザン量との間に比例関係が見られるため、吸光度を測定することで微生物の代謝活性を求めることができる 5, 8)。
図 2 の測定原理を利用した微生物検出試薬は、電子メディエータ及び水溶性テトラゾリウム塩から構成される。 ① 様々な微生物をオールラウンドに検出できること、 ② 感度良く微生物を検出できること、 ③ 培地成分の影響を受けないことを考慮して、電子メディエータと水溶性テトラゾリウム塩 WST-8 の組み合わせが選抜された 5)。 実際の測定では、電子メディエータの DMSO 溶液と WST-8 水溶液を無菌的に混合して検出試薬として使用する。検出試薬は 96 ウェルマイクロプレートに分注し、吸光マイクロプレートリーダを用いて生成したホルマザン色素(オレンジ色)を 460 nm で測定する。 この手法は、バイオフィルム内の微生物活性の測定にも適用可能である。
この測定原理を利用した Microbial Viability Assay Kit-WST は(株)同仁化学研究所より販売されている(図 3)。また、本キットの使用例については別稿を参考にされたい 9)。
3. マイクロプレート用フタに設置した 96 ピンへのバイオフィルム形成法
図 1 に示す 96 ピンへバイオフィルムを形成するには、形成条件の最適化が必須である。ここではその一例について紹介する。
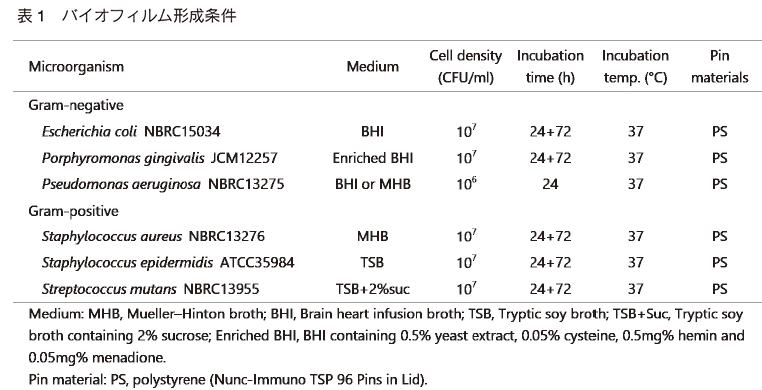
まず、最適な形成用培地で調製した微生物懸濁液を 96 ウェルマイクロプレートへ 180 μl ずつ分注し、これに 96 ピン付きマイクロプレート用フタ(Nunc-Immuno TSP 96 Pins in Lid; Thermo Fisher Scientific Inc.)を被せて 37℃で一定時間静置培養して 96 ピンへバイオフィルムを形成させる。 大腸菌 Escherichia coli、歯周病菌 Porphyromonas gingivalis、黄色ブドウ球菌 Staphylococcus aureus、表皮ブドウ球菌 Staphylococcus epidermidis、う蝕菌 Strepotococcus mutans は、 24 時間静置培養した後、新鮮培地を分注した 96 ウェルマイクロプレートへ 96 ピン付きマイクロプレート用フタを移し、さらに 72 時間静置培養する。 ここでのポイントは培地交換をすることである。 培地交換なしで 96 時間連続培養してもバイオフィルムの形成はあまり促進されない。培地交換することでバイオフィルムの形成を大幅に促進することができる。一方、緑膿菌 Pseudomonas aeruginosa は、培地交換しないで 24 時間静置培養することでバイオフィルムを形成させる。 緑膿菌は培養時間を長くすると逆に形成量が減少する傾向がみられる。ピン素材にはすべてポリスチレンを用いた。ここには示していないが、ピン素材にポリプロピレンを用いたほうがバイオフィルムを形成する菌種もある。 表 1 へ上記 6 菌種のバイオフィルム形成条件を示す。
4. バイオフィルム薬剤感受性試験法
次に、「水溶性テトラゾリウム塩 WST を用いた微生物活性測定法」と「96 ピンへのバイオフィルム形成法」を組み合わせたバイオフィルム薬剤感受性試験法について述べる。 図 4 に測定手順を示す。
バイオフィルムに対する薬力学的パラメーターとしては、様々な指標が提唱されている 3)。 バイオフィルム外への微生物の増殖阻害濃度を示す最小バイオフィルム発育阻止濃度(Minimum Biofilm Inhibition Concentration, MBIC)、バイオフィルム内微生物を 99.9 %以上殺菌する濃度を示す最小バイオフィルム殺菌濃度(Minimum Biofilm Bactericidal Concentration, MBBC)、バイオフィルム内微生物の完全殺菌濃度を示す最小バイオフィルム撲滅濃度(Minimum Biofilm Eradication Concentration, MBEC)などが挙げられる。 Qu らは、 MBIC、 MBBC 及び MBEC の測定の重要性を説いている 10)。ここでは、本法を用いた MBIC、MBBC 及び MBEC の逐次測定について紹介する。
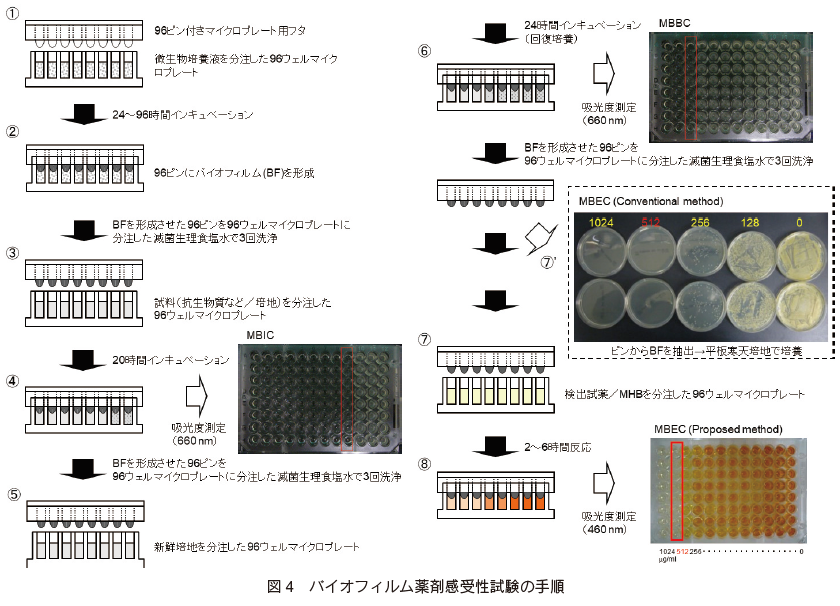
まず、 表 1 の条件に従って、マイクロプレート用フタに設置した 96 ピンへバイオフィルムを形成させる(図 4:①〜②)。 次に、96 ピン付きマイクロプレート用フタを滅菌生理食塩水で 3 回洗浄後、 2 倍希釈系列濃度の抗生物質/培地 200 μl を分注した 96 ウェルマイクロプレートへ被せ、 20 時間インキュベーションする(図 4:③)。インキュベーション後、受けプレートの吸光度測定(660 nm)を行い、吸光度が 0.1 以下のウェルを阻止と判定し、MBIC を測定する(図 4:④)。次に、抗生物質に接触させた 96 ピン付きマイクロプレート用フタを滅菌生理食塩水で 3 回洗浄後、新鮮培地 200 μl を分注した 96 ウェルマイクロプレートへ移し、24 時間インキュベーションする(回復培養)(図 4:⑤)。 回復培養後、同様にして受けプレートの吸光度測定(660 nm)を行い、MBBC を測定する(図 4:⑥)。 さらに、96 ピン付きマイクロプレート用フタを滅菌生理食塩水で 3 回洗浄後、検出試薬含有 Mueller-Hinton broth を 200 μl 分注した 96 ウェルマイクロプレートへ移し、一定時間反応させる(図 4:⑦)。 2〜6 時間反応後、マイクロプレートリーダを用いて受けプレートの吸光度測定(460 nm)を行う(図 4:⑧)。コントロール(抗生物質処理なしのバイオフィルム)が吸光度 3.0 以上に達した際、サンプル(各種濃度の抗生物質処理後のバイオフィルム)とブランク(バイオフィルムなし)の吸光度差が 0.1 以下を示す濃度を MBEC とする 6)。
5. 本法を用いた抗生物質の評価とその併用効果
本法を用いて、黄色ブドウ球菌 S. aureus NBRC13276 のバイオフィルムを対象として、代表的な抗生物質とその併用効果について評価を行った 6)。
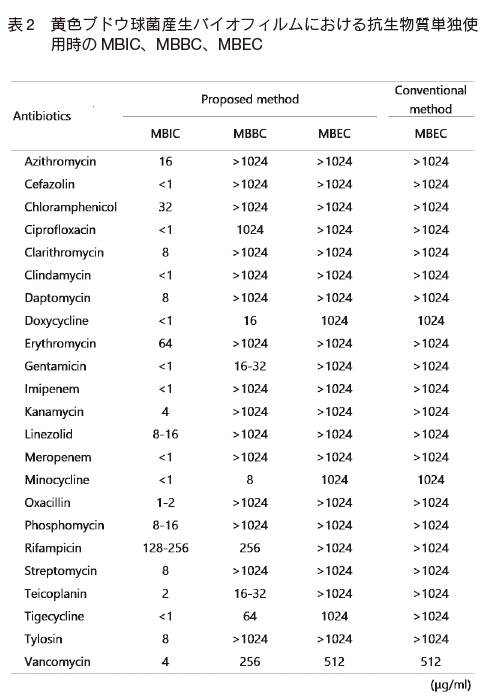
まず、抗生物質単独での MBIC、MBBC 及び MBEC の逐次測定を行ったところ、いずれの抗生物質においても MBIC < MBBC < MBEC の傾向を示した。 また、いずれの抗生物質もバイオフィルム外への微生物の増殖阻止は可能であった(MBIC)。 バイオフィルム内の微生物殺菌の指標となる MBEC に関しては、ほとんどの抗生物質が無効(> 1024 μg/ml)であったが、Doxycycline、Minocycline、 Tigecycline、 Vancomycin は高濃度ではあるが有効性を示した(表2)。
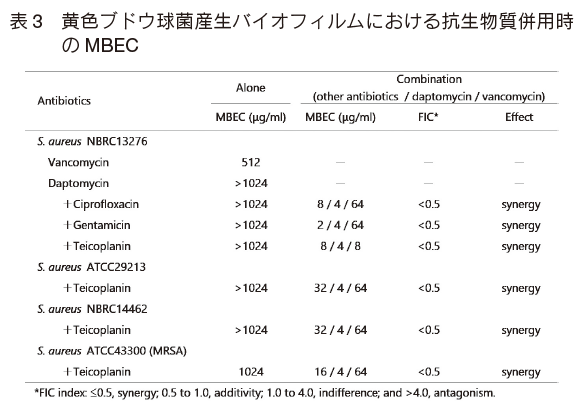
次に、S. aureus バイオフィルムに対する抗生物質の併用効果を検討した。 単独では Vancomycin(MBEC = 512 μg/ml)が最も有効であったため、Vancomycin と他の抗生物質の併用効果を検討した。その結果、 Ciprofloxacin、 Daptomycin、 Gentamicin、 Teicoplanin との組み合わせにおいて相乗効果がみられた(データ未掲載)。 さらに、 Vancomycin、 Daptomycin と第 3 の抗生物質の組み合わせを検討したところ、 Teicoplanin との組み合わせにおいて最も高い相乗効果がみられた(表 3)。 Vancomycin 単独では MBEC = 512 μg/ml であるのに対して、 Vancomycin = 8、Daptomycin = 4、Teicoplanin = 8 μg/ml と低い濃度で殺菌効果を示す ことが明らかとなった。 さらに、この組み合わせは MRSA を含む他の S. aureus バイオフィルムへも有効であった。
抗生物質の併用効果を検討する場合、数十〜数百通りの組み合わせが必要となる。従来法により正確な MBEC 値を求めるためには、まずピンからバイオフィルムを滅菌綿棒等で物理的に回収し、さらに超音波処理でマトリックスから微生物細胞を抽出・分散後、抽出液を平板寒天培地で培養して生菌数を測定しなければならない。 したがって、従来法では多大な労力と時間を要するため、大量の試料の測定は実質不可能である。 筆者らが行った従来法による実験では、 96 ピン(プレート 1 枚分)を処理するのに約 5 時間、さらに培養に 24 時間が必要であった。従来法では実験者 1 人で 1 日に処理可能なプレートは 1 枚が限界であるのに対して、本法では 10 枚以上の処理が可能であり、測定の操作性及び迅速性が格段に向上したと考えられる。 また、本法で得られた MBEC 値を、従来法(図 4:⑦’)で測定した MBEC 値と比較したところ、両者は良好に一致した(表 2)6)。この結果から本法による MBEC 測定の信頼性が確認された。
6.おわりに
本稿では、バイオフィルム薬剤感受性試験法について実施例を交えて紹介した。従来の方法では、測定に多大な労力と時間を要していたが、「水溶性テトラゾリウム塩 WST を用いた微生物活性測定法」と「 96 ピンへのバイオフィルム形成法」を組み合わせることで、測定の操作性及び迅速性を格段に向上させることができた。しかし、バイオフィルム薬剤感受性試験法による結果とバイオフィルム感染症の治療効果との相関性に関しては未だ検討段階であり、今後の進展が期待される 11)。
近年、安全性の高い食材を中心にバイオフィルム内の微生物に対して殺菌活性を有する素材を探索する研究も活発化している 12)。 本法は、抗バイオフィルム素材のスクリーニングにも適用可能であり、筆者らも食材を中心とした天然素材からのスクリーニングを進めているところである 13)。 医療分野ではバイオフィルム薬剤感受性試験法の結果が治療に適用できるか検討されている段階であるため、食品、化粧品、生活・サニタリー、環境などのバイオフィルム制御が必要となる分野で先行して本法が使用されることが期待される。
また、著者らは、これまでに得られた知見に基づき、「クリスタルバイオレットを用いたバイオフィルム染色法」と「 96 ピンへのバイオフィルム形成法」を組み合わせたバイオフィルム形成阻害活性測定法の確立にも取り組んでいる 14)。 予防的観点からバイオフィルムによる感染症を未然に防ぐには、まずバイオフィルムの形成を抑制することが効果的である。食材を中心にバイオフィルム形成阻害活性を有する素材の探索は広く行われているが、本法を用いることでそのスピードが飛躍的に高まると考えられる。近い将来、今回紹介した手法が様々な分野でバイオフィルムの評価に利用されることを期待したい。
| [ 著者プロフィール ] | |
| 氏名 | 塚谷 忠之(Tadayuki Tsukatani) |
|---|---|
| 所属 | 福岡県工業技術センター 企画管理部 情報交流課 専門研究員 〒 818-8540 福岡県筑紫野市上古賀 3-2-1 Tel : 092-925-5977 Fax : 094-925-7724 |
| 出身学校 | 九州大学大学院農学研究科食糧化学工学専攻 |
| 学位 | 博士(農学) |

