個体老化、細胞老化研究の最近の進歩
Recent progress of aging research − Integration of systemic aging and cellular aging −
 | 鍋島 陽一 公益財団法人神戸医療産業都市推進機構 先端医療研究センター センター長 京都大学名誉教授 科学技術振興機構研究開発戦略センター (JST/CRDS) 特任フェロー 東京大学ニューロインテリジェンス国際研究機構 PO |
Abstract
Aging can be generally defined as the functional deterioration of physiological mechanisms which are strictly dependent on the passage of time. Aging is the greatest risk factor for dysfunction and disease onset and is extremely problematic in the world. Indeed, functional decline constitutes the key risk for age-related diseases such as cancer, cardiovascular diseases and neurodegenerative disorders. Therefore, humankind has been interested in understanding the processes of aging to achieve healthy aging and long life since ancient times. Today, aging is the biggest challenge that mankind has to deal with in this century.
Aging has long been considered to be a process of degradation occurring in a random fashion that would lead to the accumulation of cellular damage in a stochastic fashion and, consequently, tissue decline and death. However, it is now known that aging can be modulated by genetic pathways and biochemical processes which are evolutionarily conserved.
In this paper, recent progresses of aging and longevity research are summarized. The first topic is A) the gene cascade that delays in mortality and age-associated pathologies in animals. This contains (1) caloric restriction, the first evidence that delays disease onset and mortality in diverse species, (2) the role of insulin/IGF-1 signaling in the longevity and aging disease onset, (3) the role of sirtuins and NAD+ in the longevity and aging associated pathologies, and (4) the role of mTOR signal in the longevity and aging disease onset. The second topic is B) the role of cellular senescence in aging and SASP in aging associated pathologies. This includes (1) the stimuli which can provoke irreversible cell-cycle arrest, (2) accumulation of senescent cells in various tissues and organs with aging, (3) cell-cycle arrested cells have two fates; Apoptosis and Senescence, (4) senescent cells secrete SASP (senescence associated secretory phenotype) factors, and (5) the accumulation of senescent cells drives age-related pathology through the harmful effects of SASP factors. The third topic is C) the methods for counteracting aging and rejuvenation. This includes (1) the elimination of senescent cells can prevent or delay tissue dysfunction and extend health span, and (2) the effects of parabiosis suggest the presence of unknown soluble factors involving rejuvenation and aging acceleration.
The recent achievements of aging research created new directions/goals that were (1) delaying aging; (2) realization of the healthy longevity; and (3) suppression of dysfunctions caused by aging. To achieve these goals, it is necessary to elucidate the fundamental mechanisms of aging and longevity at systemic and organ/tissue/cell levels.
1 .はじめに―老化研究の変遷―
有史以来、若さを保ち、老化を免れることは人類の夢であった。しかし、何人も老い、死から逃れることはできない。ちなみに、旧約聖書に「彼の歳は 120 年である。私は長く彼の中に留まらない、彼は肉に過ぎないのだ」とある。人類は老いと死、 120 年の寿命をどのように受け入れ、どのように立ち向かってきたのだろうか。
2015年、本邦における平均寿命は男性 80.21 歳、女性 86.61 歳であり世界一の長寿国となった。老化はガン、血管障害、認知症、サルコペニア、フレイルなどの加齢に伴う疾患群の最大の要因であり、老化のメカニズムを解明し老化を制御することは、多くの老化関連疾患の治療につながると期待される。高齢化は先進国のみならず発展途上国においても急速に進行しており、老化は人類が 21 世紀に対処すべき最大の課題と言える。
老化は加齢に伴う生理機構の減退と定義されている 1) 。老化は、多年にわたりストカスティックにおこる細胞障害の蓄積が結果として組織機能の減退、個体の死をもたらすランダムな現象と捉えられてきた。研究が停滞した要因は老化現象に潜む隘路である。すなわち、 (1) 老化は、遺伝的(先天的)要因、環境的(後天的)要因が絡み合う複雑な現象であること、 (2) 老化にともなう変化が徐々に起こり、しかも個体差が大きく、 (3) 老化による機能低下(生理的老化)と疾患による機能低下(病気)の切り分けが困難であること、また (4) 老化は分子、細胞、組織、臓器、個体の各階層におよび、かつ (5) 長期的解析、集団の解析が必要であることの困難性である。ところが、 90 年代後半から今世紀にかけての分子遺伝学的研究により(1)寿命、老化遺伝子が同定され、突破口が切り開かれた。次いで (2) 同定された遺伝子(進化的に保存された)を共通言語として酵母、線虫、ハエからほ乳類、ヒトへと研究が展開され、同時に(3)分子と組織・器官、個体老化を繋ぐ統合的な理解が進み、老化研究は急速に進展した。即ち、カロリー制限 2) による老化遅延、寿命延長のメカニズムが種を超えて確認され、また、インスリン様増殖因子 3) 、サーチュイン 4) 、mTOR 5) などの老化制御シグナルが発見され、同時にクロトー変異マウスの発見 6) 、引き続く遺伝子改変技術によって開発された老化(疾患)モデルの解析が進み、老化研究は著しく進展した。一方、個体老化における細胞老化の意義が見直され、SASP (senescence associated secretory phenotype) の発見など、新たな発展を遂げている。さらに老化がゲノム、エピゲノム、腸内細菌叢や環境などの影響を受けていることも明らかにされつつある。これらの最近の知見から老化は進化的に保存された遺伝学的、生化学的な過程であり、その分子機構は酵母、線虫から霊長類に至るまで保存されていると考えられるに至っている。さらに最近の老化研究の進展は、老化を遅らせ、寿命を延ばすことも夢ではないことを示唆しており、今や健康長寿は実現可能な目標となっている。
2 .個体老化・寿命研究の進展
2.1. カロリー制限による老化遅延、寿命延長
1935 年、 McCay 7)は、カロリー制限により平均寿命、最長寿命を延ばし、加齢関連病変の発症を遅らせることができると報告した。驚くべき事実であったが、分子機構の解明が進まず、長らくこの研究は顧みられなかった。 90 年代に入り、分子遺伝学的手法により老化遺伝子が発見され、この発見がカロリー制限による寿命延長機構解明に結び付き、研究は急展開し、カロリー制限は老化遅延/寿命延長を解析するための最も広く利用されるモデルシステムとなった。例えば、 70% カ ロリー制限食でサルを飼育すると外見上の若さの保持のみならず、加齢による死亡率が減少し、糖尿病、ガン、心血管障害、神経変性疾患などの加齢疾患の発症年齢が明らかに遅れる 8)(図 1)。また、ヒトの長期的観察研究によりカロリー制限は慢性加齢性疾患の発症・増悪抑制をもたらした。よって、カロリー制限はヒトを含む多様な生物の加齢疾患の発症遅延、寿命延長をもたらすと推定される。近年、カロリー制限の老化遅延、寿命延長に関わるシグナル経路の解析が進められ、インスリン/ IGF-1、サーチュイン、mTOR シグナル経路とのオーバーラップが浮かび上がっている(図 4)。
| 図 1 | カロリー制限は寿命延長、老化遅延をもたらす |
| サル、マウス、ラットなどのほ乳類のカロリー制限の効果を取りまとめている。 詳細な解析については進行中であり、今後、多様な現象とその分子メカニズムが解明されると期待される。文献 8 を参照 |
2.2. 老化遅延、寿命延長をもたらすインスリン/ IGF-1 シグナル
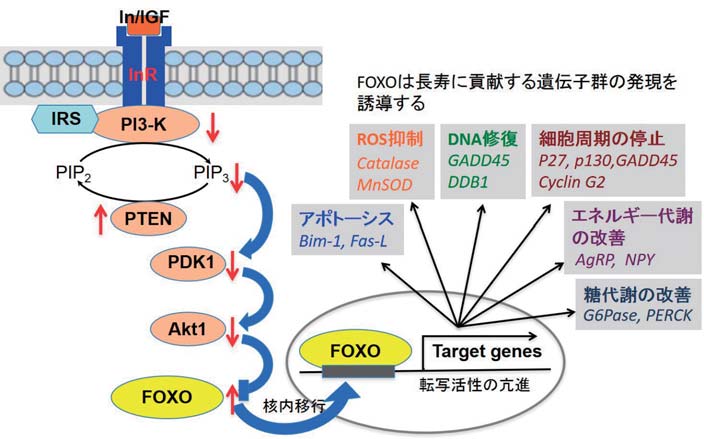
線虫の寿命延長変異体(Daf2 9) )の解析でインスリン/ IGF 受容体の機能低下が同定された 9) 。インスリン様増殖因子は受容体に結合し、そのリン酸化を誘導するが、 Daf2 変異では受容体と基質との結合が低下し、 PI3-Kinase (PIP2 を PIP3 に変換) の機能の低下により PI3 レベルが低下する。 PIP3 レベルの低下は PDK1、 AKT1 の機能低下をもたらし、フォークヘッド型転写因子である DAF16/FOXO の機能上昇、核内への移動を誘導する 10) (図 2) 。核内に移動した DAF2/FOXO は、アポトーシス (Bim-1、 Fas-1)、 ROS 活性の抑制 (Catalase、 MnSOD)、DNA 修復 (GADD45、 DDB1)、細胞周期の停止 (P27、 P130、 GADD45、 CyclinG2)、糖代謝の改善 (G6Pase、 PERCK)、エネルギー代謝の改善に繋がる遺伝子群、すなわち長寿に貢献する遺伝子群の発現を誘導し、老化遅延、寿命の延長をもたらす(図 2) 11)。なお、この経路は進化的に保存されており、ヒトの成長ホルモン (GH)、 IGF-1 受容体の機能、並びにこれらの遺伝子のポリモルフィズム/遺伝子変異と老化、寿命との関連を解析したデータは、インスリン受容体、あるいはその下流因子群がヒトの寿命制御に関わるとの考えを支持している 12) 。
| 図 2 | 老化遅延、寿命の延長をもたらすインスリン/ IGF1シグナル経路 |
| インスリン様増殖因子は受容体のリン酸化を誘導、 PI3-Kinase を活性化し、PI3 の合成亢進、 PDK1、 AKT1 の機能亢進をもたらし、フォークヘッド型転写因子である DAF16/FOXO の機能を抑制する。長寿命変異体はこの経路が抑制されており、DAF16/FOXO の核内移動を誘導し、長寿に貢献する遺伝子群の発現を誘導し、老化遅延、寿命の延長をもたらすと推定されている。文献 9、10、11、12 を参照。 |
2.3. 加齢疾患の発症、寿命制御におけるサーチュイン/ NAD+ の役割
2000 年、 Imai らは酵母より NAD+ に依存した脱アセチル化酵素、 Sir-2 を同定し、 Sir2 の発現増加は酵母の寿命延長をもたらすと報告した 13) 。ついで、ほ乳類の Sir-2 ホモログとして 7 個のサーチュイン遺伝子(SIRT1-7)が同定され、現在、その発現組織、細胞内局在、ターゲット蛋白の違いなど、個体における機能の解明が進められている 4) 。 Imai は老化遅延、寿命制御における SIRT1/NAD+ の機能を解析、その基本概念を NAD+ World 2.0 として提唱している 14) 。 “NAD+ World 2.0” では、 SIRT1 と NAMPT (nicotinamide phosphoribosyl transferase、 NAD+ 合成の主要酵素)が担う全身性の NAD+ 合成系が、視床下部、脂肪組織、骨格筋からなる臓器連関の中核を担う。即ち、視床下部(コントロール・センター)は交感神経系を介して骨格筋にシグナルを送り、脂肪組織(モジュレーター)は全身性の NAD+ 合成系を調節することにより(NAMPT の発現臓器)視床下部の機能を遠隔的に制御し、そして骨格筋(エフェクター)はマイオカインなどを分泌することでさまざまな組織・臓器の代謝応答の制御に関わる。なお、 NAMPT による NAD+ 合成は各種の組織・臓器において加齢とともに低下し、サーチュインの活性低下を介してさまざまな生理・病理学的変化、老化、加齢関連疾患発症のトリガーとなると推定される。とりわけ、膵 β 細胞と、中枢性ニューロンは、 NAMPT の発現が低く全身性の NAD+ 合成の減弱が大きな機能障害となる 15) 。例えば、膵 β 細胞特異的に SIRT1 遺伝子の発現を誘導すると膵 β 細胞の機能は一旦顕著に改善するが、その効果は老化とともに減弱、消失する15) 。ところが上記の SIRT1 発現増強マウスに NAD+ の前駆体である nicotinamide mononucleotide (NMN) を投与すると機能改善が持続する 16) 。この事実は、たとえ SIRT1 の機能を高めても回復には限度があり、 NAD+ 合成能の維持が重要であることを示唆している。一方、脳特異的に SIRT1 を強制発現したマウスは雌雄ともに顕著な老化遅延と寿命延長を示した 17) 。また老齢となっても身体活動量、体温、酸素消費量、骨格筋ミトコンドリアの機能、睡眠の質などの生理学的形質がコントロールに比べて高く保たれていた。更に、 Imai ら、 Cai らは、脳の部位特異的に SIRT1 を活性化したマウスを解析し、視床下部が哺乳類における老化・寿命制御のコントロール・センターであることを示唆した 18、 19) 。上記の結果に基づき、 Imai らは 1 年間にわたる NMN の飲水投与の効果を解析、加齢に伴う体重増加の抑制、エネルギー代謝の促進、身体活動の上昇、インスリン感受性の亢進、脂質代謝の改善、骨格筋ミトコンドリア機能の改善、老化に伴う遺伝子発現変化の抑制、眼機能の改善、骨密度の上昇、免疫細胞の数の改善などの多様な効果をもたらすことを見いだした 20) (図 3)。また、毒性、副作用は認められず、 NMN 投与による老化遅延が現実の課題となり、日米で臨床試験が開始されている。
| 図 3 | NAD+ の前駆体、 NMN の投与の抗老化作用 |
| マウスに NMN を 1 年間、投与し、コントロールと比較検討し、 NMN の抗老化作用を示す。 |
2.4. 老化、寿命制御における mTOR 経路の機能
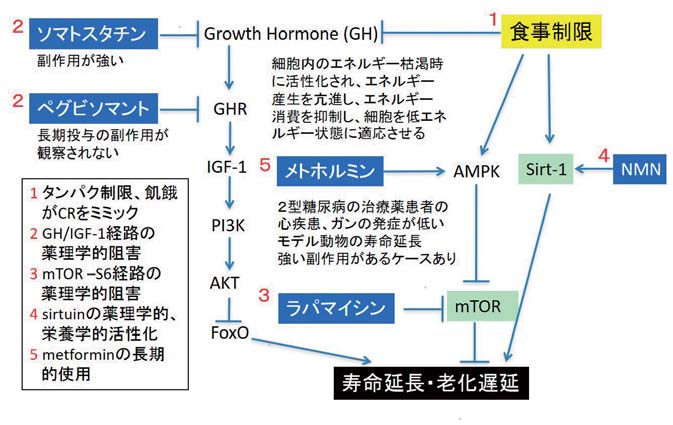
mTOR (mechanistic Target of Rapamycin) はラパマイシンによって阻害される serine/threonine protein kinase である。 mTOR は細胞内の栄養状態を感知する分子センサー経路のキー因子として機能しており、蛋白合成や脂質合成を亢進させ、オートファジーを阻害する 5) 。 mTOR には mTORC1、 mTORC2 の 2 つの複合体があり、異なるターゲットをリン酸化する。なお、ラパマイシンは mTORC1 を強く阻害するが、 mTORC2 に対する阻害活性は極めて低い。遺伝子操作による mTOR の機能阻害が線虫、ショウジョウバエの寿命延長をもたらすことが発見され、老化における mTOR シグナルの役割が注目されることとなった 21) 。次いで、 mTOR の阻害剤であるラパマイシンを投与すると酵母、線虫、ショウジョウバエ、そしてマウスの寿命が延長することが明らかとなり、同様に mTOR シグナルが低下するマウス、すなわち、 S6K1 遺伝子欠損マウス、機能が低下した mTOR を発現するマウス、 mTOR、 mLST8 のダブルヘテロマウスにおいても寿命の延長が確認された 5) 。これらの結果は、 mTOR シグナルの活性を低下させると種を越えて寿命が延長することを示している。カロリー制限、インスリン/ IGF1 シグナルの下流で誘導される mTORC1 の機能低下が寿命延長、老化遅延をもたらすとの多くの報告があり、 mTORC1 は老化遅延・寿命制御の重要なターゲットと言える 22) (図 4)。なお、ラパマイシンの投与は寿命の延長のみならず、ガンやアルツハイマー病、加齢に伴う認知障害などの加齢疾患モデルの発症を予防、あるいは遅延させるとも報告されているが、ラパマイシンには免疫抑制作用(ウイルス、カビに感染し易くなる)や、高脂血症、インスリン感受性の低下などの副作用が起こるとの報告があり、抗老化剤としての利用は疑問である。一方、カロリー制限は、 AMP-Kinase の機能亢進は mTOR の機能低下を介して寿命延長、老化遅延をもたらすと考えられており、 AMP-Kinase の機能を高めるメトホルミンの抗老化作用が注目されている 23) 。メトホルミンは長期間にわたり 2 型糖尿病の治療薬として多数の患者が服用しており、服用患者では心疾患、ガンの発症率が低いと報告されている。現在、老化・寿命制御のシグナル伝達経路の制御分子をターゲットとする抗老化方法論の開発が注目されている(図 4)。
| 図 4 | 栄養/食事制限のシグナル経路に作用する既存の薬物は有効か? |
| カロリー制限、インスリン/ IGF1シグナル、サーチュインのシグナル経路の解明が進み、 mTORC1 などのシグナル経路分子が老化遅延・寿命制御のターゲット分子として注目されている。これらの分子に作用する薬剤が開発されており、 mTORC1 の阻害剤であるラパマイシン、 mTORC1 の機能低下をもたらす AMP-Kinase の機能を高めるメトホルミン、成長因子とその受容体に作用するソマトスタチン、ペグビソマントなどの抗老化作用の解析が進められている。この図は宇野雅晴、西田栄介の総説;寿命制御シグナル(Medical Science Digest 2016 年 12 月臨時増刊号)を参考に改変した |
3.老化細胞、SASP/液性因子による老化制御
3.1. 分裂寿命による細胞老化
ヘイフリックは、ヒトより採取した細胞を培養し続けることにより、細胞の分裂回数には限界があり、一定の回数になると増殖を停止すると報告した。また、胎児、若い個体、老齢個体から採取した細胞の分裂回数を比較し、採取した個体の加齢に伴い分裂回数が減少することを見いだし、個体、試験管内で同じ仕組みで分裂回数が数えられているのではないかと推定した。いわゆる「ヘイフリックの分裂限界」である 24) 。このコンセプトはなかなか受け入れられず、紆余曲折の末、分裂毎に染色体末端のテロメア配列が短くなることが一種の寿命時計/細胞分裂の回数券として機能していることやテロメア配列がある長さ以下になると分裂が停止することなどが明らかとなって、ようやく受け入れられることとなった 25) 。なお、限界まで分裂し、増殖を停止した細胞を老化細胞と捉えている。
テロメア長の短縮が個体老化を促進するかを検討する目的でテロメアの延長に関与する遺伝子のノックアウトマウスが解析されたが老化促進を示唆する現象は観察されなかった。しかし、マウスのテロメア長がヒトより長く、また、マウスは寿命が短いことから、 F1 ではテロメア長短縮の影響が現れないのではとの議論があり、 F2、 F3、 F4、 F5 と飼育を続けたところ、 F5 において老化促進を示唆する結果が得られた 26) 。この事実の評価は難しいが、細胞老化は個体老化に関わらないとの主張が支配的となった。しかし、最近の知見は個体老化における細胞老化の位置づけの見直しを支持している。
3.2. 不可逆的に増殖停止した細胞の運命
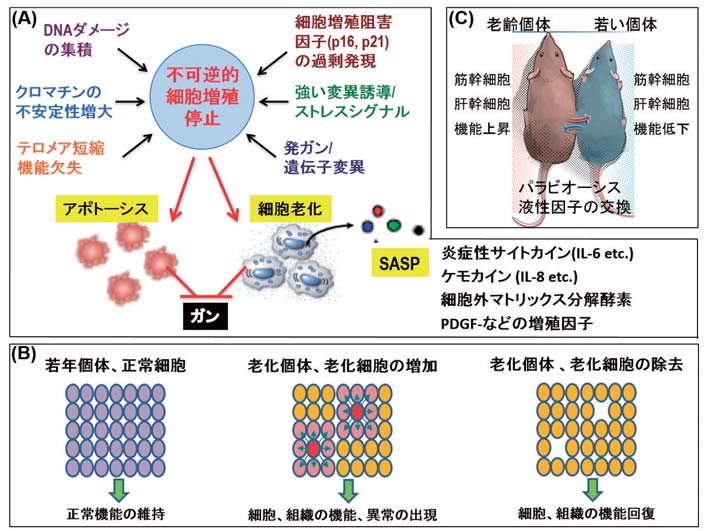
細胞老化はヒトの正常な体細胞を継代培養した際に起こる不可逆的な増殖停止状態として発見されたため、生体内でも起こりうる現象なのか懐疑的な意見も多かった。しかし、細胞老化の特徴を示す細胞が加齢に伴って様々な組織や臓器に見られるようになることや、様々なストレス(DNA ダメージの集積、クロマチンの不安定性増大、テロメア短縮/機能欠失、発ガン遺伝子変異/異常活性化、酸化ストレス、細胞増殖阻害因子(p16、 p21)の過剰発現、放射線など)によっても細胞は不可逆的細胞増殖停止状態となることが示され、現在では、細胞老化は個体でも起こる現象と考えられている。なお、不可逆的に増殖を停止した細胞はアポトーシスを起こすか、細胞老化への運命を辿る 27) (図 5A)。
| 図 5 | 老化細胞、SASP/液性因子による老化制御 |
| 老化細胞は加齢に伴い見られるようになる。また、様々なストレスによって細胞は不可逆的細胞増殖停止状態となり、細胞はアポトーシスを起こすか、細胞老化への運命を辿る。さらに老化細胞は炎症性物質などの SASP 因子を分泌し、ガン、老化関連疾患の発症を促進していると推定されている(5A)。遺伝子改変技術により老化細胞を取り除くとマウスの健康寿命が延伸することが報告され、老化細胞の除去を目指す開発的研究に凌ぎを削っている(5B)。液性因子による個体老化の制御はパラビオーシスによっても示されている(図5C)。 |
3.3. SASP因子/液性因子による個体老化の制御
合目的論的見地から、アポトーシスは修復困難な細胞を除去し、細胞のリサイクル、組織リモデリングを導く仕組みとして理解され、細胞老化は細胞の異常増殖を防ぎ、ガンの発生を予防する生体の防御機構と考えられてきた。しかし、 (1) 老化細胞が加齢により様々な組織や臓器で見られるようになることや (2) 老化細胞が炎症性物質などの様々な分子を分泌し(SASP 因子と言う) 28) 、ガンを含めた老化関連疾患の発症を促進している可能性が高いことが明らかとなり、さらに、 (3) 遺伝子改変により老化細胞を取り除くとマウスの健康寿命が延伸することが報告され 29) 、加齢に伴い体内に老化細胞が増えることが個体老化と老化関連疾患の発症を促進する重要な要因と考えられるようになった(図 5B)。
上記の観察は老化細胞から分泌される液性因子が老化を促進することを示唆しているが、パラビオーシスによっても液性因子の重要性が示された 30) 。パラビオーシスとは、例えば若い個体と老齢個体の腹部を切開し、腹部どうしを繋ぎあわせて体液を相互に行き来させ、その影響を解析する実験手法である。驚いたことに、パラビオーシスにより若い個体の老化が促進し、老齢個体の機能回復/若返り?が観察された(図 5C)。この現象は以前より解っていたが、その分子機構が全く解らず、長らく放置されてきた。しかし、最近のマス解析などの分析技術の発達により老化促進、機能回復に関与する分子の解析が可能となり、ケモカインとして知られている CCL11 が老化促進因子の候補と報告された 31) 。とは言え、解析は緒についたところであり、今後の展開が興味深い。
4.終わりに―我が国の老化研究の展開―
老化・寿命の制御機構の理解は大きく進展した。とはいえ、分子機構の解明は依然として限定的であり、細胞老化との関係についても多くの解明すべき課題が残されている。一方、 NMN の投与や老化細胞の除去、 SASP 現象の制御、老化促進分子の解析など、抗老化方法論の開発を巡って凌ぎを削っており、健康長寿は実現可能な目標となってきたことを示唆している。
欧米では多年にわたり老化疾患の病態解明と治療法の開発と共に老化の基本メカニズムの解明に取り組んできたが、近年の老化・寿命制御研究の急速な進展を背景に新たな方向、すなわち、 “老化遅延、健康長寿を実現し、老化疾患の発症、老化に伴う機能低下を抑える” との方向性を打ち出した。一方、我が国においては、これまで老化関連疾患研究は支援されてきたが、基盤となる老化研究の振興とその成果に根ざした健康長寿の実現を支援するプロジェクトは支援されてこなかった。老化メカニズムの解明・制御プロジェクトが立ち上がったのは昨年(2017 年)のことである 32) 。老化は、各種要因が複雑に絡み合う現象であり、徐々に起こり、しかも個体差が大きい。また、研究対象が分子、細胞、組織、臓器、個体の各階層におよび、しかも長期的解析、集団の解析が必要である。全ての研究者の叡智を結集し、長期的な視点に立って総合的に研究を推進し、健康長寿を実現しなければならない 33) 。
| 著者プロフィール | |
| 氏名 | 鍋島 陽一(Yo-ichi Nabeshima) |
|---|---|
| 所属 | 公益財団法人神戸医療産業都市推進機構先端医療研究センター センター長 京都大学名誉教授 科学技術振興機構研究開発戦略センター (JST/CRDS) 特任フェロー 東京大学ニューロインテリジェンス国際研究機構 PO |
| 専門分野 | 分子生物学、分子病態学 |
| 研究テーマ | 生物の形成原理の解明、時間軸の生物学 |
| 略歴 | |
| 1972 年 3 月 | 新潟大学医学部卒業 |
| 1976 年 3 月 | 新潟大学大学院医学研究科博士課程修了 医学博士 |
| 1976 年 4 月 | 新潟大学医学部助手(生化学) 78 年 同講師 |
| 1984 年 9 月 | 癌研究会癌研究所研究員 87 年 主任研究員 |
| 1987 年 11 月 | 国立・精神神経センター 神経研究所遺伝子工学研究部長 |
| 1998 年 4 月 | 大阪大学細胞生体工学センター 教授 |
| 1998 年 11 月 | 京都大学大学院医学研究科 教授 |
| 2005 年 10 月 | 日本学術会議第 20 期会員、 21 期会員 |
| 2005 年 10 月 | 京都大学医学研究科副研究科長 (2007 年 9 月まで) |
| 2005 年 10 月 | 京都大学付属ゲノム医学センター長 (2007 年 9 月まで) |
| 2007 年 4 月 | 京都大学生命科学系キャリアパス形成ユニット長 |
| 2010 年 3 月 | 京都大学医学研究科 定年退職 京都大学名誉教授 |
| 2010 年 4 月 | 現職 |