ヒストンコード解明のための発蛍光プラットフォームの開発
真核生物の DNA は、核内においてヒストンタンパク質とその複合体であるクロマチンの状態で存在する。塩基性タンパク質であるヒストンはカチオン性であり、アニオン性の DNA と静電的に相互作用している。ヒストンの N 末端側の 50 残基程度のアミノ酸配列をヒストンテールと呼び、メチル化、アセチル化、リン酸化などの様々な化学修飾を受ける。例えば、ヒストンがアセチル化やリン酸化などの化学修飾を受けると、 DNA の相互作用が弱まり転写が活性化する。一方で、 DNA のメチル化は遺伝子発現を抑制する場合が多い。このような DNA の塩基配列の変化を伴わない遺伝子発現の変化をエピジェネティクスとよぶ。
ヒストンテール上の様々な修飾(アセチル化、メチル化、リン酸化など)の組み合わせが、細胞の機能に重要な役割を果たすというヒストンコードが提唱されている。例えば、ヒストン 3 の N 末端から 4 番目リジンのメチル化(H3K4me)は遺伝子発現の活性化、 H3K9me は遺伝子発現の抑制となる。さらに、 H3S10ph (ph はリン酸化) は H3K9me3 の効果を抑制し、 H3T11ph は H3K4 のメチル化を促進し、遺伝子活性化を促す。これらのヒストンコードの解明は基礎研究のみならず、臨床的に重要な創薬の標的の創出に結び付く可能性を秘めている。
エピジェネティクスの分野の中で、ヒストンの修飾位置や種類の組み合わせであるヒストンコードと生命現象の関係性は近年活発に研究されてきている。従来からヒストンコードを解析する手段として、質量分析法と抗体を用いたクロマチン免疫沈降法が使用されてきたが、スループット性の低さや、修飾の正確な位置を解析することが困難であることが課題となっていた。続いて、それらの課題を克服したマイクロアレイ技術が開発された。様々な抗ヒストン修飾抗体をガラススライドに固定化し、蛍光標識したヒストンタンパク質を結合させ解析する手法である。この手法では、一つ一つのヒストン修飾に対する抗体を準備することが困難であること、認識部位以外の周辺の修飾内容によっての抗体の結合能力にばらつきがあることが欠点となる。本稿では、ペプチドと小分子を用いたヒストンコードを解明するための最新のアレイ技術を報告する 1)。
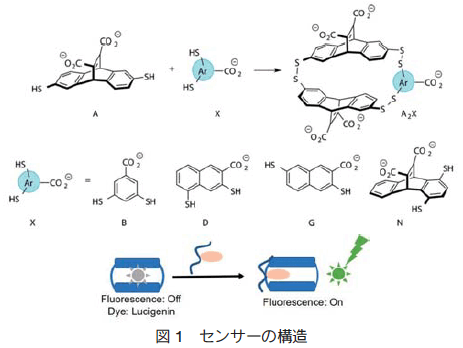
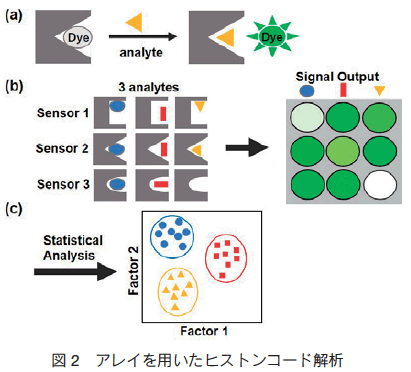
本技術は、 4 種類の蛍光センサー(図 1の B,D,G,N)と様々な修飾ヒストンテールペプチドを混合して得られる蛍光強度を解析し、ペプチドのどの位置がどの様な化学修飾を受けているかを判別するものである。具体的な実験内容は図 2 の通りである。(a)蛍光物質をセンサーに包接し、消光させる。次にペプチド(analyte)を混合し、センサーがペプチドを包接して蛍光物質が脱離すると蛍光を発する。(b)センサーとペプチドは、その組み合わせにより相互作用が異なり、得られる蛍光強度が異なる。(c)各組み合わせの蛍光強度を基に統計的解析を行い、グラフを作成する。この結果から、サンプルのペプチドの修飾位置や修飾の内容(ヒストンコード)を知ることができる。
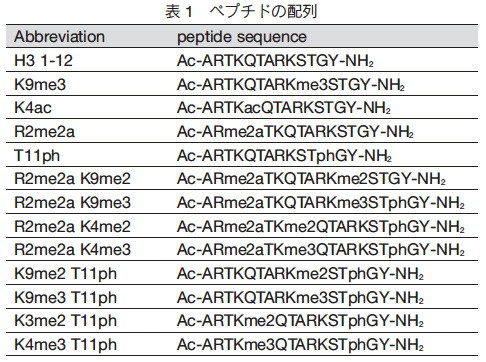
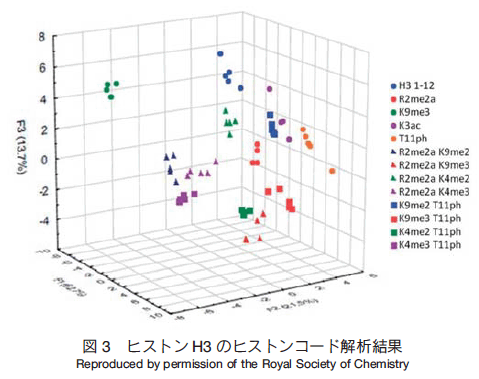
センサー(図 1)とヒストン H3 のペプチド配列(表 1)を用いて、本アレイ技術で解析した結果を示す(図 3)。センサーは二つの分子 A と一つの分子 X と架橋した構造(A2X : X = B,D,G,N)となっている。 A2X は、図 1 の通り、中に空間があり蛍光物質やメチル化したリジンやアルギニンが包接される性質を有する。この性質は、X の構造やペプチド配列中のリン酸化やアセチル化など環境要因によって変化する。次に、センサー 4 種類とペプチド 13 種類をそれぞれの組み合わせで混合し、蛍光強度を測定後、統計的解析を行うと図 3 に示す結果が得られている。各データは一定の領域に集まっており、 96% の正確度で判別可能であった。
この結果より、リジン、アルギニンのメチル化、アセチル化、リン酸化といった様々な修飾を判別し、さらに複数の修飾に関しても適用可能であることが報告されている。
本技術は、リジンメチル化数の判別、酵素反応のモニタリング(data not shown)なども報告しており、 in vitro でのヒストンコード研究の有用なツールになることが期待される。
[参考文献]
1) Peacor, B. C.; Ramsay, C. M.; Waters, M. L., Chemical Science, 2017, 8, 1422-1428.