レシオメトリックに観察できる過酸化水素の蛍光検出化合物
生体内の酸化ストレスを議論する上で、ミトコンドリアは重要なオルガネラの一つである。ミトコンドリアは、酸素を利用し ATP を合成することで生体内のエネルギーを生産しており、その際、酸化力の強い活性酸素種 (ROS) が発生する。通常、発生した ROS は SOD やカタラーゼにより生体内で無毒化されるが、ROS が残存した場合、その強い酸化力にて様々なタンパク質を酸化し、多様な生理機能に異常をきたす。また、ミトコンドリアはシグナル伝達、細胞分裂、細胞死などにも深く関与していることが示唆されており 1)、ミトコンドリアを研究するための新しい技術の開発は、酸化ストレスと生理現象の関わりを解明する上で非常に重要である。
比色アッセイなど従来の分析技術と比較して、蛍光プローブを用いたリアルタイムイメージング技術は高い感度と選択性、空間分解能の高さ、操作の簡便さ、非破壊検出、という利点があり、最も有効な検出ツールとして認知されている 2)。
現在、ミトコンドリア内 ROS の検出用蛍光プローブの開発は化学、生物学、医学などの研究分野において重要性が増しており、近年でも多くの論文が報告されている。今回のトピックでは ROS の中でも ATP 産生時に副次的に発生する過酸化水素へ的を絞り、報告された論文の中で特に興味深い蛍光プローブを二例ご紹介したい。
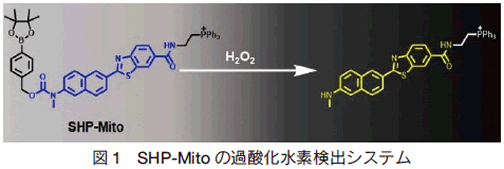
一例目は、2012 年に Cho らが報告した、ミトコンドリアに局在し、過酸化水素をレシオメトリックに検出する SHP-Mito である 3)。メカニズムとしては、構造内のトリフェニルホスフィン基のカチオン性によりミトコンドリアに集積し、過酸化水素への応答によって、蛍光発色団の電価移動相互作用が増加し蛍光波長が青色から黄色にシフトする(図 1)。
SHP-Mito は既存の過酸化水素検出試薬の様な off-on の検出方法とは異なり、蛍光波長の変化によって過酸化水素を検出するため、過酸化水素が存在しない条件でも蛍光を捉えることができ、ネガティブデータとの比較が容易である。また、マウスの海馬組織を染色した実績があり 3)、臓器ごとの過酸化水素レベルのモニタリングに有用であることが期待される。さらに、過酸化水素の検出限界が 4.6 μ mol/l と報告されており、微量の過酸化水素の定量にも期待できる。
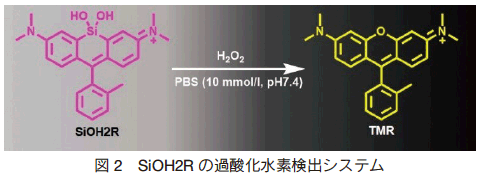
二例目は、2017 年に Stains らが報告した、ミトコンドリア内過酸化水素のレシオメトリック蛍光検出用プローブの SiOH2R である 4)。メカニズムとしては、構造内のジメチルアミノ基のカチオン性によりプローブがミトコンドリアに集積し、過酸化水素への応答により蛍光団骨格が構造変化し励起蛍光波長が紫色から黄色にシフトする (図 2)。
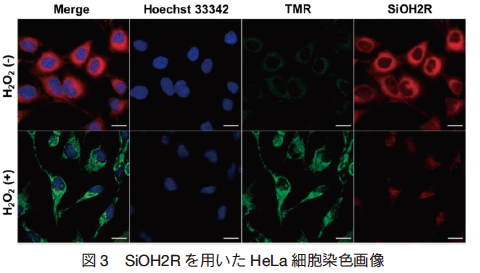
この化合物の最大の利点は蛍光特性であり、応答前後の蛍光特性が大きく変化していることである(SiOH2R λ ex/ λ em:663/681 nm、TMR λ ex/λ em:550/570 nm)。この大きな蛍光特性の変化により、過酸化水素添加時の蛍光強度比(TMR/SiOH2R)が 5000 倍と報告され 4)、既存の過酸化水素検出試薬に比べ圧倒的に高感度であり有用である (図 3)。
SHP-Mito と同様、蛍光波長の変化による過酸化水素非存在下時の画像取得の容易さも利点として挙げられる。
酸化ストレス、ミトコンドリア、及び細胞機能は密接な関係があるが、その全容は未だ解明されていない。そのため、より簡便で高感度なミトコンドリア内の ROS 検出プローブの開発は重要な課題の 1 つである。蛍光波長変化による検出メカニズムを用いたこれらの ROS 検出試薬はそれらの条件をクリアする有用なツールであり、化学、生物学、医学などのさまざまな領域での研究をさらに加速させることが期待できる。
[参考文献]
1) H. M. McBride et al., “Mitochondria: More Than Just a Powerhouse”, Curr. Biol., 2006, 16, R551.
2) L. Xu et al., “Fluorescent probe for the selective detection of chemical species inside mitochondria”, Chem. Commun., 2016, 52, 1094.
3) B. R. Cho et al., “A Mitochondria-Localized Two-Photon Fluorescent Probe for Ratiometric Imaging of Hydrogen Peroxide in Live Tissue”, Chem. Commun., 2012, 48, 3518.
4) C. I. Stains et al., “Chemoselective Alteration of Fluorophore Scaffolds as a Strategy for the Development of Ratiometric Chemodosimeters”, Angew. Chem., 2017, 56, 4197.