臓器置換を目指すオルガノイド研究の新展開
State of the art of organoid based research
 |
武部 貴則 横浜市立大学大学院 医学研究科 臓器再生医学 准教授 シンシナティ小児病院 消化器部門・発生生物学部門 准教授 シンシナティ小児病院 オルガノイドセンター 副センター長 |
Abstract
The self-organizing tissue-based approach coupled with induced pluripotent stem (iPS) cell technology is evolving as a promising field for designing organoids in culture and is expected to achieve valuable practical outcomes in regenerative medicine and drug development. Organoids show properties of functional organs and represent an alternative to cell models in conventional two-dimensional differentiation platforms; moreover, organoids can be used to investigate mechanisms of development and disease, drug discovery and toxicity assessment. Here, we review characters of emerging organoid technology focusing on liver bud as an example, and discuss their promise and challenges for the use regenerative medicine.
1. はじめに
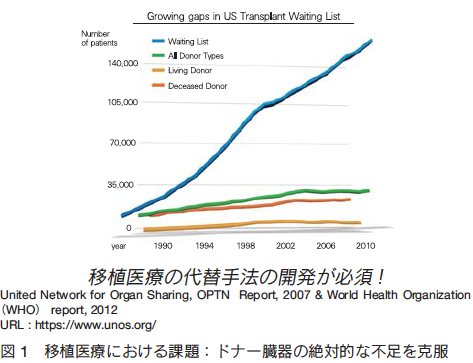
臨床的有効性が明確である移植医療において、その最重要課題がドナー臓器の絶対的不足への対応であることは明らかである。例えば、米国における臓器移植の実施件数と待機人数との乖離は、1989 年には数千名の範囲内に収まっていたにもかかわらず、その後の乖離状況は悪化の一途をたどっており、 2013 年には 10 万人近くに顕著に増大しているのが現状である(United Network for Organ Sharing;UNOS)。すなわち、米国だけで、毎年、なんと 10 万人近くの臓器不全患者が移植手術を待ちながら移植を受けることが出来ない状況が厳然として存在しているのである(図 1)。致死的な重症肝不全患者を対象とする肝臓移植においては、米国における 1 年間に新規発生する待機リスト登録者約 17,000 名のうち、じつに約 4,000 名の患者が臓器移植を待ちながら、ドナー肝臓が届くことなく死亡している。
このような臨床的な重要課題を解決するためには、進歩の著しい発生生物学(developmental biology)や幹細胞生物学(stem cell biology)の新知見を駆使して、臓器移植の代替治療法を実現するべくヒト臓器の人為的構成を可能とする革新的な細胞操作技術を開発する必要がある。特に近年、ヒト iPS 細胞などの多能性幹細胞からオルガノイドと呼ばれる複雑組織を創出し、医療応用を目指す試みに注目が集まっている。
2. オルガノイドとは?
オルガノイド(Organoid)とは、人為的に創出された器官に類似した組織体といえる。一般にオルガノイドは、器官形成に寄与する前駆細胞の集合体から、生体内における発生や再生過程で生じる頑健な生物学的プロセスを人為的に模倣することにより創出される。オルガノイド形成は、多くは自己組織化(Self-organization)と称される半自律的なプロセスをたどることにより創出されるものが多いが、自律性を引き出すためには「人為性」が重要な要素となる。後述するように、特にこの自律性を再現性良く引き出すためには、各種細胞材料のバリデーションが極めて重要となる。
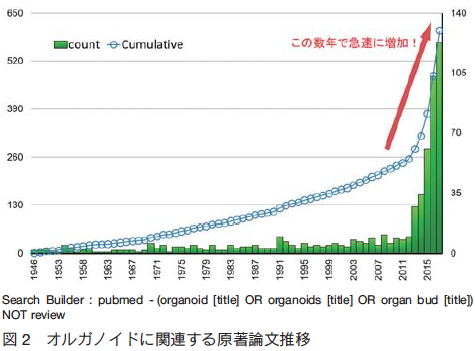
近年の研究では、多能性幹細胞(ES、iPS 細胞)や、生検サンプルを活用したプライマリ細胞などを活用し、ヒトを対象とした生物学研究(Human Biology)が隆盛を極めている(図 2)。これにより、研究対象とすることが比較的困難であったヒトにおける様々な生命現象に迫ることが可能となった。また、疾患患者に由来するオルガノイドを用いることで、臨床試験に至る以前にヒトにおける反応を予測するための技術としての期待も膨らみつつある。一方、内分泌器官や、腸、肝臓などいくつかの代表的な臓器分野においては、オルガノイドを直接移植することにより治療応用を目指す有望な報告が広がりつつある。
3. 肝臓における発生機構
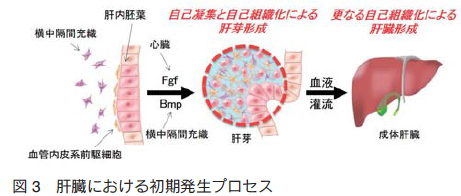
肝臓発生の最も初期の段階は、胚体内胚葉(definitive endoderm)より分化誘導した腹側前腸内胚葉(ventral foregut endoderm)が周辺からの Fgf や Bmp シグナルからの刺激をうけることで予定肝臓領域(肝内胚葉、hepatic specified endoderm)が運命決定されることにより開始する 1), 2)。その後、肝内胚葉は血管内皮系前駆細胞と協調的に働きつつ、横中隔間充織と呼ばれる間葉系組織方向へと浸潤し、やがて立体的な肝芽(liver bud)を形成する(図 3) 3)。一度、肝芽が形成されると、後に続く血液灌流を契機としてさらなる成熟刺激を受け、最終的に肝細胞索や胆管に加えて、門脈、肝動脈、中心静脈などの階層的な小葉構造をもったいわゆる肝臓へと発生が進展してゆく 1)。このように、肝臓は最終的には極めて複雑な構造を構成するものであるが、その初期段階である肝芽形成段階においては比較的シンプルな細胞間相互作用にもとづき発生が進行すると考えられる。
4. 肝芽オルガノイド創出
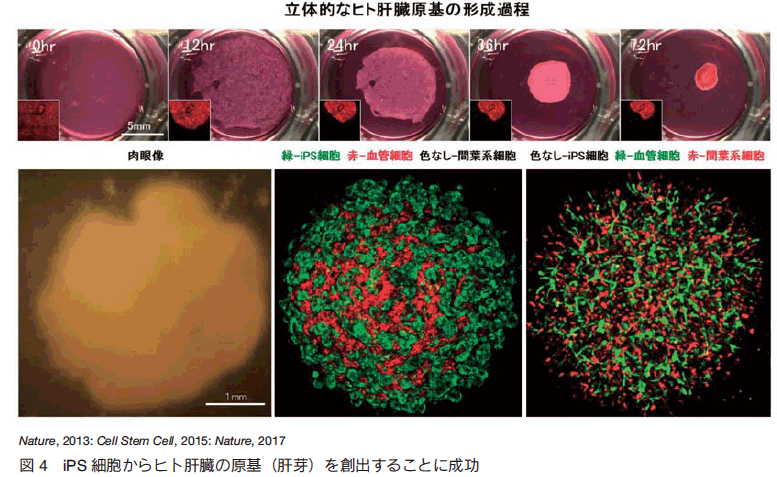
このように肝発生の初期プロセスの進行には、前腸内胚葉細胞と未分化血管内皮細胞と間葉系幹細胞との細胞間相互作用が必須である。そこで、我々は前腸からの肝臓原基(肝芽)の出芽(budding)という、肝発生において極めて重要なイベントを人為的に再現することを目指し、さまざまな培養条件を検討した結果、肝芽形成を模倣した新たな三次元培養系を確立することに成功した。すなわち、ヒト iPS 細胞由来肝内胚葉細胞、ヒト血管内皮細胞、ヒト間葉系細胞を至適な支持体上で共培養することにより、直径数 mm 大のボール状の 3 次元的立体組織が僅か 48 時間以内に自律的に形成されることを見いだした(図 4) 4), 5)。さらに、微細構造の形態学的な解析、およびシングル・セル解析による包括的遺伝子発現プロファイルの解析などの結果から、形成された 3 次元構造体が、妊娠後期及び成体肝臓とは異なり、発生初期で形成される肝芽組織と極めて類似する特徴を有することが明らかとなったことから、試験管内で組織・臓器の元となる立体的な肝芽オルガノイド(Human iPSC-derived liver bud)を人為的に作製することに成功したと考えられた 6)。従来のオルガノイド技術の多くは上皮構造のみからなる事例がほとんどであったが、本手法により、血管等を含むより複雑な多細胞相互作用を実現することの可能な全く新たなオルガノイドの創出手法が確立されたといえる。
5.肝芽オルガノイド移植という治療原理の確立
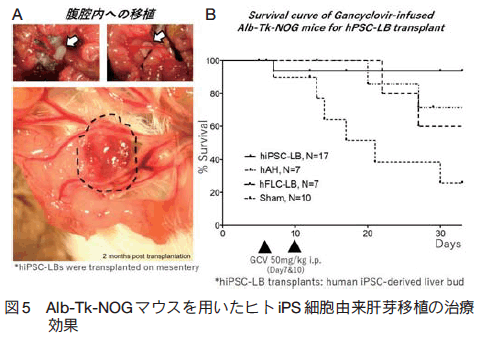
iPS 細胞からヒト肝臓を創出するための第一のマイルストーンである肝芽オルガノイド(臓器の芽、肝芽、liver bud)を誘導するという開発目標が達成されつつあるいま、移植治療技術としての活用に期待が集まっている。我々のグループでは、ヒト iPS 細胞より作出した肝芽オルガノイドを免疫不全マウス体内へ移植することにより、血液灌流を通じたヒト臓器の分化誘導が可能であるか検証をすすめている。その結果、驚くべきことに移植後の極めて早い時期(48 〜 72 時間以内)に、移植肝芽全域に血液灌流が効率良く生じることが判明した(図 5A) 4)。移植片の辺縁部においては、マウス・ヒト血管が直接吻合し、内腔では血液が交通していることが示された。さらに、移植 45 日時点において、移植マウス静脈より血液を採取し、ヒト特異的にアルブミン検出を行った結果、成体肝細胞移植などの従来手法と比較して有意にアルブミン検出量が上昇することが確認された。これにより、ヒト iPS 細胞由来肝芽オルガノイドが異所的な移植部位の中でも、腹腔内において血液供給を受けることがその生着や機能発現において重要であることが示された。
以上の検討を踏まえ、この肝芽オルガノイド移植(liver bud transplantation)による治療効果を検証することを目的として、亜急性肝不全モデルに対する移植実験を実施した。免疫不全マウスを用いて作製した亜急性劇症肝炎モデルに移植肝芽を門脈近傍の腸間膜上へ移植した結果、30 日後の生存率は、非移植群では約 30% であったのに対し、移植群では 90% 以上であり、著明に生存率が改善効果することが判明した 5)。すなわち、肝芽オルガノイド移植という新しい治療概念が極めて有効であることが明らかとなった(図 5B)。
6.治療用オルガノイドの超大量製造工程へ向けて
このようにオルガノイド研究は、急速な広がりを見せつつある一方で、実際の臨床応用に先立っては、ヒト肝芽オルガノイドの大量製造工程の構築が実用化上最大の課題となる。なぜならば、例えば肝不全症患者の治療に際しては、ヒト肝細胞に換算して 1 × 108 〜 10 個に相当する超大量のヒト肝芽オルガノイドを再現性良く製造可能とすることが必要となるからである。これらを実現するためには、GCTP(Good Gene、Cellular、and Tissue-based Products Manufacturing Practice)に適合したプロトコールの作製が重要となるわけであるが、とりわけオルガノイド創出に用いる細胞材料の均質化を担保する努力が重要となる 7)。当研究室では、オルガノイド形成に用いるもっとも重要な成分である肝臓内胚葉細胞の均質化を目指し、胚体内胚葉段階での培養上清中から Cerberus 1-ELISA 8)を検出することによりバリデーションが可能であることを見出しつつ有る。このような非侵襲的な細胞材料の品質保証手法を今後も充実させていくことで、均質な肝オルガノイドの超大量製造を実現する製造工程を実現していく。
7.おわりに
1963 年に故・Starzl らによって切り拓かれた臓器移植に基づく臓器置換術は、現在に至るまで末期臓器不全症に対する唯一無二の優れた治療法として実施されている。しかしながら、年々増大する臓器移植のニーズに対し、置換用臓器の供給は絶対的に不足しており、それらに代わる治療法の開発は多くの患者救済のために急務である。筆者らは、組織・臓器再生を指向する研究の先に、その突破口が見いだせるものと確信している。ヒト iPS 細胞の開発以後、産官学民が一体となって研究が推進されている今、本稿で紹介した様な組織や臓器を誘導する技術開発は急速な展開を見せている。臓器再生に基づく治療技術が次世代の医療技術として産声をあげ、臓器移植を待つ患者を救済する日はそう遠くないのかもしれない。
| 著者プロフィール | |
| 氏名 | 武部 貴則(Takanori Takebe) |
|---|---|
| 所属 | 横浜市立大学大学院 医学研究科 臓器再生医学 シンシナティ小児病院 消化器部門・発生生物学部門 シンシナティ小児病院 オルガノイドセンター |
| 連絡先 | 〒236-0004 神奈川県横浜市金沢区福浦 3-9 TEL, FAX: 045-787-8963 E-mail: ttakebe@yokohama-cu.ac.jp |
| 出身大学 | 横浜市立大学 |
| 学位 | 医学士 |
| 専門分野 | 再生医学・発生生物学・広告医学 |
| 現在の研究テーマ | iPS 細胞、オルガノイド、移植 |