|
| トップページ > 薬物代謝酵素発現酵母を用いたヒト代謝物生産システム |
 |
||||||||||||||||||||||||||||||||||||||||||
薬物代謝酵素発現酵母を用いたヒト代謝物生産システム
|
||||||||||||||||||||||||||||||||||||||||||
 |
西川 美宇 株式会社 TOPU バイオ研究所 代表取締役社長 |
 |
生城 真一 富山県立大学工学部 生物工学科機能性食品工学講座 准教授 |
 |
榊 利之 富山県立大学工学部 生物工学科機能性食品工学講座 教授 |
Abstract
Xenobiotic phase I and II reactions generally render a compound more water soluble and pharmacologically
inactive, thereby eliminating the need for further evaluation. Conjugation in phase II process is the most common
pathway for detoxification and elimination of hydrophobic xenobiotics in mammals. However, if the metabolite
forms a toxic compound such as acyl glucuronide, additional safety assessment may be needed. In 2008, FDA
provided a new guidance for safety testing of drug metabolites. Generally, synthesis of enough amounts of
metabolites for safety testing is often difficult in conventional methods. Thus, development of the efficient system
for metabolite production often becomes critical during studies of xenobiotic metabolism undertaken in the
development of a new pharmaceutical product. We have established whole cell-dependent production systems for
human drug metabolites using genetically engineered Saccharomyces cerevisiae cells. We constructed the expression
systems of 20 cytochrome P450 (CYP), 38 UDP-glucuronosyltransferase (UGT), and 6 sulfotransferase (SULT)
isoforms, and we successfully produced a few hundred milligram-quantities of metabolites from
several drug substrates in 1 L reaction. Efficient production of acyl-glucuronides which are chemically reactive was
attained by using not only human but also other mammalian UGT isoforms. We also constructed co-expression systems of phase I and phase II enzymes combined with CYP and UGT isoforms, resulting in the reconstruction of sequential metabolism in humans. These systems would be useful for production of drug metabolites and prediction of drug metabolism for pharmaceutical candidates.
1. はじめに
医薬品は体内に取り込まれたのち肝臓をはじめとする種々の組織において複数の代謝酵素による変換を受ける。これを薬物代謝というが、通常、代謝物は水溶性が増し、体外へ排泄されやすい形へと変換される。薬物代謝経路には酸化、還元、加水分解等を行う第Ⅰ相反応と、極性の高い置換基を付加する第Ⅱ相反応に大別される。第Ⅰ相及び第Ⅱ相反応は連続的に行われる場合が多く、第Ⅰ相を担う代表的な薬物代謝酵素にはシトクロム P450(CYP)があり、第Ⅱ相酵素には UDP-グルクロン酸転移酵素(UDP-glucuronosyltransferase, UGT)や硫酸転移酵素(sulfotransferase, SULT)などが挙げられる。多くの医薬品 は代謝によって不活化されるが、近年、一部の医薬品が代謝により毒性を増し、副作用などを引き起こすことが明らかになってきた。これを受けて、 2008 年には米国食品医薬品局(FDA)から「医薬品代謝物の安全性に関するガイダンス」が出され、医薬品開発における基礎研究の段階から代謝物の安全性試験を実施する必要が出てきた 1)。安全性試験ではヒトが医薬品を摂取した際に体内で生じる代謝物を合成し、実験動物に投与して毒性を評価する必要がある。
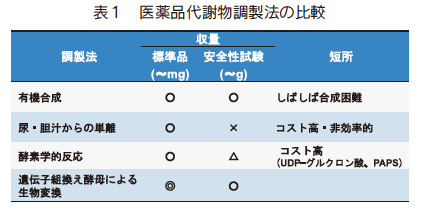
医薬品代謝物の調製法には有機合成の他、医薬品を投与した実験動物の胆汁や尿からの代謝物の単離、および肝臓ミクロソームなどの粗酵素画分を用いた生合成法などがある(表 1)。一般に実験動物を使用した安全性試験にはグラム単位の代謝物が必要であり、有機合成法による調製が有用であるが、位置および立体選択的な水酸化あるいは抱合化は困難であるため、多くの場合、医薬品自身とは全く異なる合成ルートを考案する必要があり、多大なコストと手間がかかる。また、生体試料からの単離や酵素合成法により調製可能な量は数十 mg 程度であり、グラム単位の代謝物調製は技術的およびコスト的に困難である。そこで、筆者らは出芽酵母 Saccharomyce scerevisiae に種々の薬物代謝酵素を発現させ、医薬品代謝物の効率的な生産システムを構築した。本稿では、薬物代謝酵素発現酵母による代謝物合成の特徴と、医薬品や食品由来成分からの代謝物合成例について紹介する。
2.出芽酵母を用いた薬物代謝酵素発現システムの構築
1985 年、 らは出芽酵母 Saccharomyces cerevisiae を宿主として薬物代謝に関与する P450 および NAPDH-P450 還元酸素を発現させることに成功し、ヒト由来 P450 分子種発現酵母を用いてさまざまな医薬品代謝物を調製することが可能となった2)3)4)。さらに生城らは P450 と UGT を酵母に同時発現させることにより、医薬品の連続的な代謝反応を再現した5)。これらの酵素が局在するミクロソーム画分を使用した代謝物調製が可能になったが、 UGT によるグルクロン酸抱合反応には補酵素として高価な UDP-グルクロン酸(UDP-glucuronic acid, UDP-GA)を添加しなければならず、安全性試験に必要な代謝物の大量調製にはコスト面での課題があった。同様に、 in vitro での SULT による硫酸抱合反応には、 UDP-GA よりもさらに高価な補酵素である活性硫酸(3’-phosphoadenosine-5’-phosphosulfate, PAPS)の添加が必要であり、安全性試験に必要な量の代謝物調製には補酵素の添加を必要としない生産システムの確立が必要であった。そこで、補酵素供給系を含んだ酵母菌体を用いたバイオコンバージョン法による代謝物生産システムの確立を試みた。
らは出芽酵母 Saccharomyces cerevisiae を宿主として薬物代謝に関与する P450 および NAPDH-P450 還元酸素を発現させることに成功し、ヒト由来 P450 分子種発現酵母を用いてさまざまな医薬品代謝物を調製することが可能となった2)3)4)。さらに生城らは P450 と UGT を酵母に同時発現させることにより、医薬品の連続的な代謝反応を再現した5)。これらの酵素が局在するミクロソーム画分を使用した代謝物調製が可能になったが、 UGT によるグルクロン酸抱合反応には補酵素として高価な UDP-グルクロン酸(UDP-glucuronic acid, UDP-GA)を添加しなければならず、安全性試験に必要な代謝物の大量調製にはコスト面での課題があった。同様に、 in vitro での SULT による硫酸抱合反応には、 UDP-GA よりもさらに高価な補酵素である活性硫酸(3’-phosphoadenosine-5’-phosphosulfate, PAPS)の添加が必要であり、安全性試験に必要な量の代謝物調製には補酵素の添加を必要としない生産システムの確立が必要であった。そこで、補酵素供給系を含んだ酵母菌体を用いたバイオコンバージョン法による代謝物生産システムの確立を試みた。
3.バイオコンバージョン法による医薬品代謝物の生合成
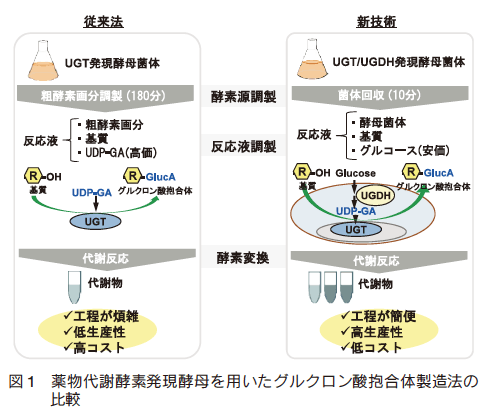
酵母菌体内で薬物代謝反応を再現するためには、前述の補酵素供給系が予め酵母内に備わっていることが必要である。酵母においては硫酸抱合反応に必要な補酵素である PAPS 合成系を有しているが6)7)、 UGT の補酵素である UDP-GA 合成に必要な UDP-グルコース脱水素酵素(UDP-glucose dehydrogenase, UGDH)を持っていない。そこで、 UGT および UGDH の同時発現酵母を構築し、菌体内でのグルクロン酸抱合反応を可能にした。 UGT および UGDH 同時発現酵母の構築により、酵母培養液中に基質となる医薬品を添加するだけで容易に代謝物を生産することが可能になり、代謝物生産コストの大幅な削減に成功した。また、菌体をそのまま反応に用いるため粗酵素画分調製の時間も不要になり、容易に大量の代謝物を調製することが可能となった(図 1)。
4.薬物代謝酵素発現酵母を用いた代謝物生合成
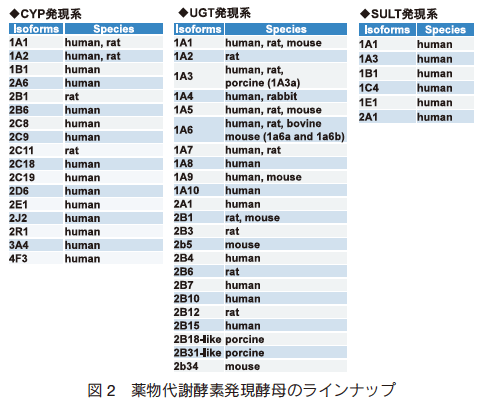
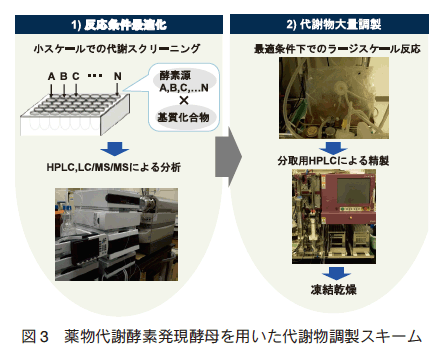
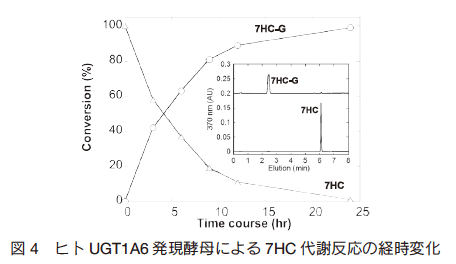
P450、UGT および SULT はいずれも遺伝子ファミリーを形成し、多くの分子種が存在する。我々はヒトおよび動物由来の薬物代謝酵素発現系を構築し、これまでに 19 種類の CYP、38 種類の UGT および 6 種類の SULT 発現酵母を揃えている(図 2)。多様な分子種の品揃えにより、幅広い化合物への対応が可能となり、これまでに多くの医薬品や食品成分の代謝物を調製した。方法は以下の通りである。遺伝子組換え酵母は予め 10 L スケールで培養して集菌し、使用時まで冷凍保存することが可能である。代謝物調製に際し、まずは小スケールにおける代謝スクリーニング試験により最適分子種を選定し、0.1 ~ 1 L スケールで反応を行うことで、容易に代謝物を調製することができる(図 3)。モデル化合物である 7-ヒドロキシクマリン(7HC)を基質とした場合、 UGT 発現酵母によるグルクロン酸抱合体への変換反応は概ね 24 時間で終了する(図 4)。生合成反応後の代謝物精製は反応液と菌体双方を抽出するが、菌体外に代謝物が多く存在するケースが多く、遠心分離で菌体を沈殿させ、代謝物を精製することも可能である。 現在、 1 リットルの反応系あたり数十~数百 mg の代謝物合成が可能となっている。本法の特長として、酵素源調製にかかる工程が遺伝子組換え菌体の大量培養と回収のみであり、酵素源の調製と管理が非常に容易であるため、反応をさらにスケールアップすればグラム単位の代謝物調製が可能となる。
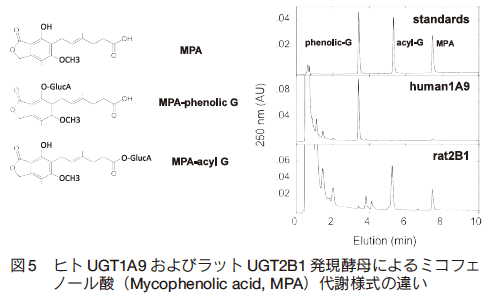
また酵素法による代謝物調製の特長として、特異的代謝物の取得が容易であることが挙げられる。免疫抑制剤として使用されるミコフェノール酸はその構造中にフェノール性水酸基とカルボキシル基を持ち、両方の官能基が UGT によるグルクロン酸抱合反応を受ける。そのうちカルボキシル基における抱合は反応性の高いアシルグルクロン酸抱合体を生じ、炎症反応を介した肝障害などの副作用を起こすことが懸念されている。 UGT 発現酵母を用いてミコフェノール酸の代謝スクリーニングを行った結果、ヒト UGT 分子種においてはフェノール性水酸基が抱合されたエーテル型グルクロン酸抱合体のみが合成されたが、ラット UGT2B1 はアシルグルクロン酸抱合体を選択的に合成した(図 5)。同様にカルボキシル基を有する複数の医薬品で代謝スクリーニングを行った結果、ラット UGT2B1 は効率的にアシルグルクロン酸抱合体が生成した(表 2)。このように、ヒト由来 UGT での生合成が困難な場合でも、他の動物種由来 UGT を使用することにより目的代謝物を特異的に調製することが可能である。これらの医薬品のアシルグルクロン酸抱合体はヒト体内においても合成されることが知られているが13)14)15)16)17)、ヒト UGT 発現酵母での合成効率は極めて低かった。 UGT に限らず他の薬物代謝酵素においても、ヒト以外の動物由来の酵素を幅広く取り揃えることは重要である。
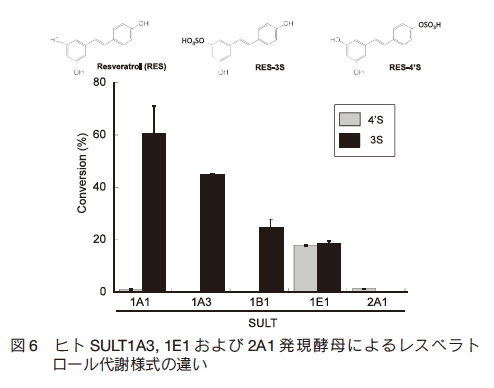
ポリフェノールは複数のフェノール性水酸基をもつ植物由来成分の総称であり、フラボノイドをはじめとしたポリフェノール類は速やかに薬物代謝酵素による代謝を受け、不活化・排泄されることが知られている9)。 近年の報告では、体内に残存したフラボノイド代謝物が炎症部位に蓄積し、加水分解酵素による脱抱合を受けることで生じたアグリコンが局所的な生理作用を及ぼす可能性が示され10)11)12)、食品成分の機能性評価においても代謝研究の重要性が高まっている。多くのポリフェノールは構造中の水酸基が UGT 、 SULT や COMT などの第Ⅱ相酵素により代謝され、複数の代謝物を生じる。 SULT 発現酵母を用いてブドウ果皮やそれを使用したワインに多く含まれるポリフェノールであるレスベラトロールを代謝させた結果、 SULT1A3 は 3 位硫酸酸抱合体を、 SULT2A1 は 4’ 位硫酸抱合体をそれぞれ選択的に合成した。一方で SULT1E1 は 3 位および 4’ 位における両抱合反応を触媒した(図 6)。このように、薬物代謝酵素発現酵母の最適分子種を選定することにより位置選択的に抱合化を受けた代謝物を合成することが可能であった。
5.連続代謝反応による複数代謝物の調製
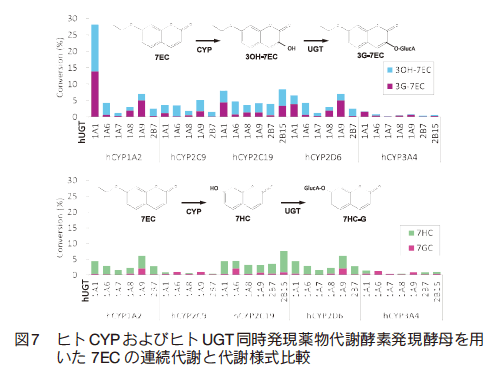
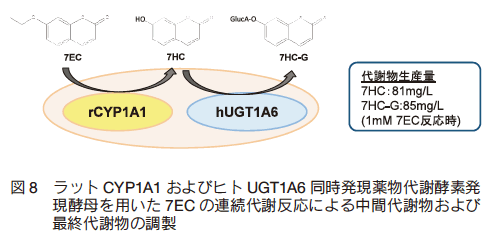
前述の通り、薬物代謝反応は複数の酵素が関与する多段階の代謝反応により成り立つものが多い。我々は、前述の P450 電子伝達成分系とグルクロン酸抱合反応系の同時発現系を構築し、第Ⅰ相および第Ⅱ相反応の連続的な代謝反応を酵母内に再構築することに成功した。 CYP/UGT 同時発現系については 5 種のヒト由来 CYP と 7 種のヒト由来 UGT の組み合わせにより 35 種類のヒト CYP/UGT 同時発現酵母株を構築した。モデル化合物として使用した 7-エトキシクマリン(7EC)に対する CYP による代謝経路は、脱エトキシ反応により 7HC を生じる経路と 3 位水酸化反応の二通りがある。 35 種類の CYP/UGT 同時発現酵母による 7EC 代謝解析を行ったところ、全ての分子種で脱エトキシ反応と 3 位水酸化反応から始まる連続代謝反応を確認した(図 7)。また、 7EC の連続代謝による 7HC と 7HC-グルクロン酸抱合体の同時調製には、ラット CYP1A1/ ヒト UGT1A6 同時発現酵母の使用が有用であった(図 8)。
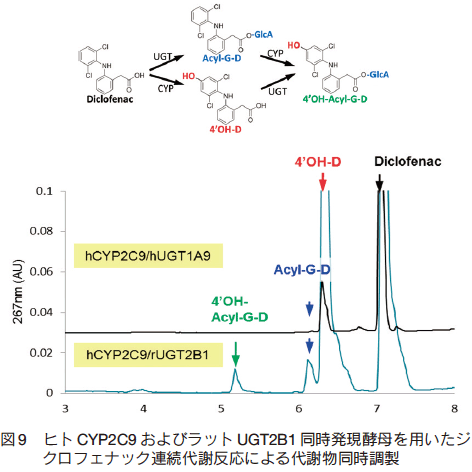
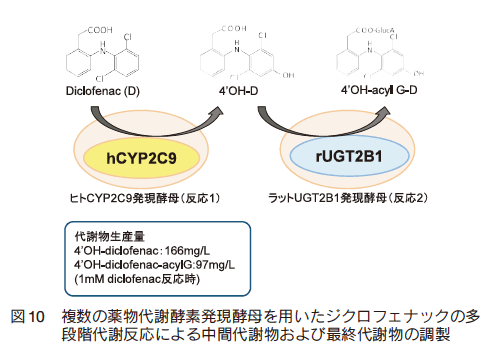
代表的な非ステロイド系抗炎症剤(non-steroidal anti-inflammatory drugs, NSAIDs)であるジクロフェナックは、 CYP および UGT により連続的に代謝される17)。ヒト CYP2C9/ ラット UGT2B1 発現酵母を用いることで、単回反応により酵母内で連続的な代謝反応を行い、水酸化体とグルクロン酸抱合体を同時調製することに成功した(図 9)。また、ジクロフェナックとヒト CYP2C9 発現酵母との反応液上清をラット UGT2B1 発現酵母との反応に用いることにより、 2 ステップでの代謝物調製に成功した(図 10)。
6.おわりに
これまで薬物代謝反応はその多くが不活化反応と考えられ、代謝物自体の活性は見過ごされがちであったが、近年医薬品の活性代謝物による毒性だけでなく、食品成分由来代謝物の機能性に関する報告も相次いでいる。また、薬物代謝酵素は肝臓の他、腸粘膜にも高発現しており、腸管における代謝は医薬品や機能性食品成分のバイオアベイラビリティを考慮する際の重要なファクターとなる。したがって、これらの代謝研究を行うに当たり代謝物の需要はますます高まってくることが予想される。
平成 23 年 4 月に富山県立大学発ベンチャー企業、(株) TOPU バイオ研究所が設立され、薬物代謝酵素発現酵母による代謝物製造が事業化された。現在も酵素源の拡充を図っており、調製可能な代謝物数は飛躍的に増加している。本技術が医薬品や食品成分の代謝研究推進の一助となれば幸いである。
| 著者プロフィール | |
| 氏名 | 西川 美宇 (Miyu NISHIKAWA) |
|---|---|
| 所属 | 1)株式会社 TOPU バイオ(トップバイオ)研究所 2)富山県立大学 |
| 連絡先 | 〒939-0398 富山県射水市黒河 5180 TEL : 0766-56-0155、FAX : 0766-56-0155 E-mail: nishikawa@topubio.co.jp |
| 出身学校 | 酪農学園大学大学院獣医学研究科 |
| 学位 | 博士(獣医学) |
| 現在の研究テーマ | 医薬品・食品成分の代謝様式および作用メカニズムの解明 |
| 氏名 | 生城 真一 (Shinichi IKUSHIRO) |
| 所属 | 富山県立大学 |
| 連絡先 | 〒939-0398 富山県射水市黒河 5180 TEL : 0766-56-7500(内線602)、FAX : 0766-56-2498 E-mail : ikushiro@pu-toyama.ac.jp |
| 出身学校 | 広島大学総合科学部 |
| 学位 | 博士(学術) |
| 現在の研究テーマ | 異物代謝酵素による食品中機能性成分の代謝研究 |
| 氏名 |  (Toshiyuki SAKAKI) (Toshiyuki SAKAKI) |
| 所属 | 富山県立大学 |
| 連絡先 | 〒939-0398 富山県射水市黒河 5180 TEL : 0766-56-7500(内線601)、FAX : 0766-56-2498 E-mail : tsakaki@pu-toyama.ac.jp |
| 出身学校 | 京都大学大学院理学研究科 |
| 学位 | 博士(理学) |
| 現在の研究テーマ | 医薬品・食品成分の代謝様式および作用メカニズムの解明 |
| Copyright(c) 1996-2016 DOJINDO LABORATORIES, ALL Rights Reserved. |