 |
| トップページ > 蛍光プローブを用いたヒストン脱アセチル化酵素の活性検出 |
 |
蛍光プローブを用いたヒストン脱アセチル化酵素の活性検出株式会社同仁化学研究所 吉村 晶大
クロマチンの構造変化や遺伝子発現において、ヒストンのアセチル化やメチル化、リン酸化などの化学修飾が重要な役割を担っていることが明らかとなっている。その中でヒストンのアセチル化/脱アセチル化はそれぞれヒストンアセチルトランスフェラーゼ(HAT)およびヒストンデアセチラーゼ(HDAC)が関与している。特に HDAC は、遺伝子発現抑制に寄与しており、癌や精神疾患にも関与していることから創薬分野で注目を集めている。そのため、効率的かつ簡便な HDAC の活性検出方法が求められている。 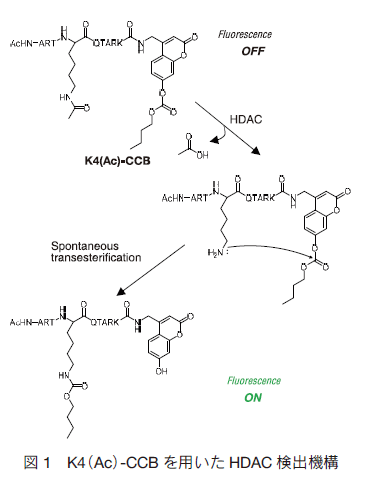 このエステル置換反応は自発的に生じるため、蛍光プローブと HDAC を混合するだけで酵素活性を簡便かつ経時的に検出することが可能である。最近 R. Baba らは、基質ペプチドとヒドロキシクマリンの距離の最適化を図ることによって、非常に有用な蛍光プローブの開発に成功している 2) 。 一方 M. Minoshima らは、DNA 結合能の変化を利用した蛍光プローブ(BOXTO-GK(Ac)G)について報告している(図 2) 3) 。このプローブは、基質ペプチドと DNA 染色用蛍光色素(BOXTO)から形成されている。基質ペプチドがアセチル化されている状態ではプローブの総電荷はゼロであるため、測定系内に存在する DNA と結合せず、ほとんど蛍光は検出されない。しかし、 HDAC によって基質ペプチドが脱アセチル化されるとプローブの総電荷がプラスに転じるため、DNA 結合能が回復し、蛍光を発するのである。これにより本プローブは、DNA 存在下で HDAC 活性をリアルタイムモニタリングすることが可能である。また細胞内 DNA を用いることで HDAC 活性の細胞内イメージングへの応用が期待できる点で本プローブは興味深い。 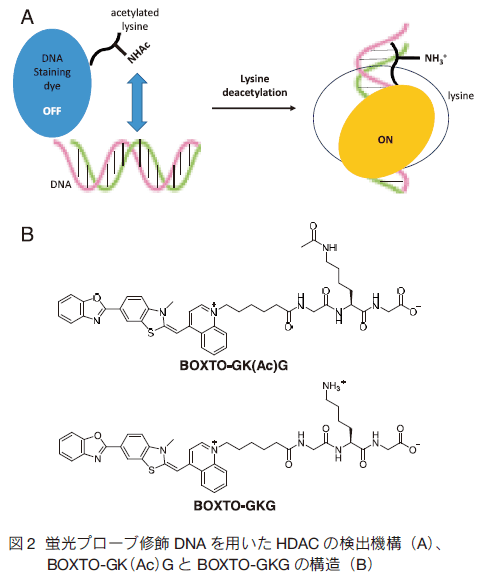 エピジェネティクス研究は今後も重要な研究分野の一つとして活発化していくと考えられる。今回紹介した蛍光プローブのように新しい研究ツールを利用することで研究が加速化されるだけではなく、これまで得られなかった知見が得られるものと期待する。
参考文献1) R. Baba, Y. Hori, S. Mizukami and K. Kikuchi, “Development of a Fluorogenic Probe with a Transesterification Switch for Detection of Histone Deacetylase Activity”, J. Am. Chem. Soc., 2012, 134, 14310. 2) R. Baba, Y. Hori and K. Kikuchi, “Intramolecular Long-Distance Nucleophilic Reactsions as a Rapid Fluorogenic Switch Applicable to the Detection of Enzymatic Activity”, Chem. Eur. J., 2015, 21, 4695. 3) M. Minoshima, T. Matsumoto and K. Kikuchi, “Development of a Fluorogenic Probe Based on a DNA Staining Dye for Continuous Monitoring of the Histone Deacetylase Reaction”, Anal. Chem., 2014, 86, 7925.
|
| Copyright(c) 1996-2016 DOJINDO LABORATORIES, ALL Rights Reserved. |