「蛍光生物学」の最前線 8-2
生活習慣病と生体イメージング
西村 智
東京大学医学系研究科循環器内科
東京大学システム疾患生命科学による先端医療技術開発拠点
特任准教授
|
要旨
最近の研究により各種生活習慣病の背景には、慢性炎症を基盤とした異常な細胞間作用が生体内で生じていることが明らかになっている。我々は、一光子・二光子レーザー顕微鏡を用いた「生体分子イメージング手法」を独自に開発し、生活習慣病にアプローチしてきた。著者らは、本手法を肥満脂肪組織に適応し、肥満脂肪組織で、脂肪細胞分化・血管新生が空間的に共存して生じ、また、脂肪組織微小循環では炎症性の細胞動態を生じていることを明らかにした。また、肥満脂肪組織には CD8 陽性 T 細胞が存在し肥満・糖尿病病態に寄与していた。さらに、本手法を用いて生体内の血栓形成過程の詳細も明らかになり、iPS 由来の人工血小板の機能解析も可能となっている。
▲ページのトップへ
1.緒言 生体イメージングとは
最近の研究により、心筋梗塞や脳卒中などの原因となるメタボリックシンドロームと慢性炎症病態に密接な関連があることが示唆されている。メタボリックシンドロームでは、遺伝子素因と、内臓肥満・加齢・喫煙などの外的誘因の両者が病態形成に関わっていることは、多くの臨床データから明らかである。しかし、慢性炎症そのものの動態が不明であることから、基礎病態に対する特効薬的な治療が存在せず、それに伴う生活習慣病病態については、多くの有疾患患者と高い死亡率を生んでいるのが現状である。 そして、病態理解のためには、慢性炎症に伴う生体内での細胞動態の異常、特に免疫細胞の局所での生体内応答について、直接画像化して知見を得ることは必須であると言える。
我々は、独自に開発した「生体分子イメージング手法」を、肥満した脂肪組織に適応し、メタボリックシンドロームの病態にアプローチを行ってきた。我々の開発したイメージングは、従来の手法ではアプローチできなかった細胞間相互作用を生体内で直接可視化するものであり、多くの研究領域において今後重要な役割を果たすと考えられる。本稿では、我々の生体イメージングより明らかになった、肥満脂肪組織の再構築(リモデリング)と炎症性細胞の関与、さらに血栓形成過程についての知見を紹介したい。
▲ページのトップへ
2.肥満と慢性炎症 生体イメージングで見る肥満脂肪組織
2-1.肥満脂肪組織における生体分子イメージングの意義
近年、動脈硬化・心血管疾患の原因として、末梢組織(骨格筋・脂肪組織)の機能異常が重要であると考えられるようになっている。特に、脂肪組織は、長年、脂肪を蓄積するのみの「何もしない臓器」と考えられてきたが、近年のライフスタイルの変化(食生活の欧米化)に伴う肥満・メタボリックシンドロームの蔓延により、脂肪組織は様々な病気を引き起こす「活発な代謝臓器」として一躍注目を浴びるようになった。内臓脂肪はアディポサイトカインや炎症性サイトカイン等の液性因子を分泌することからも、肥満に伴うインスリン抵抗性や動脈硬化の発症に必須の役割を担っていると考えられる。しかし、脂肪組織の肥満における役割は必ずしも明らかではなく、脂肪組織が臓器としてどのように機能異常を起こすのか、いかに全身のインスリン抵抗性に寄与するか、その分子機構は十分に解明されているとは言えなかった。
近年の Weisberg らによる肥満脂肪組織に炎症性マクロファージが浸潤しているという報告 1) を初めとして、肥満脂肪組織における慢性炎症の関わりについては複数のグループが報告しており、現在では肥満脂肪組織のリモデリングの背景に慢性炎症が存在することは明らかであると考えられている 2)。実際に、脂肪組織の間質を解析すると、その大半が免疫細胞である。痩せ型マウスでも、間質(stromal vascular fraction, SV fraction と略称される)の 30%が血管内皮細胞、30%が線維芽細胞で残りはすべて免疫系の細胞であり、末梢臓器としては免疫細胞を多く含んだ特異な組織であると言える。さらに、この免疫細胞の比率は肥満において増大する。非免疫組織としては異例に多い比率であり、脂肪組織における活発な免疫・炎症性細胞のクロストークが存在することが示唆される。現在、我々は脂肪組織を一種の免疫組織として捉えている。
▲ページのトップへ
2-2.「生組織イメージング」でみる肥満脂肪組織リモデリング
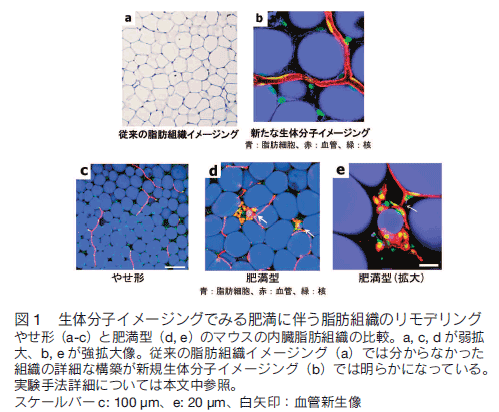
我々はまず、「脂肪組織をよりよくみるために」、レーザー共焦点顕微鏡を用いて、生きたままの組織をそのまま染色する、「生組織イメージング手法」を開発した。通常の固定した組織切片標本では、脂肪組織は白く抜けた脂質と、細胞質・核の集合体として漠然としか組織構築が捉えられなかったが、我々の手法では組織構築の詳細が可視化された 3)。青色の脂肪酸で脂肪細胞が、赤色のレクチンで血管内皮が、緑色の核染色色素で核構造が可視化されている。この生組織イメージングは多くのラボで追試が行われており、脂肪組織のイメージング手法としての地位を確立しつつある。非常に簡便に多くの情報を得ることができる方法であり、詳細な手法については引用文献を参照して頂きたい。
この手法を用いて検討した肥満動物モデルの脂肪組織では、多くの脂肪細胞は肥大していたが、加えて分化・増殖した小型脂肪細胞が新たに出現していた(図 1)3)。さらに、小型脂肪細胞分化と共存して血管新生像(血管網より枝分かれした新生血管の断端)が観察され、その周囲には活性化マクロファージ浸潤が認められた。我々は、この細胞集団を 「adipo/angiogenic cell clusters」と名付けた。さらに、これらに対する介入実験として、血管新生の阻害薬(VEGF 中和抗体)を肥満動物に投与したところ、脂肪組織のなかの血管新生部位のみならず、脂肪細胞分化そのものが抑制された。さらに、血管新生の阻害に伴い、全身の内臓肥満やインスリン抵抗性が改善したことより、肥満脂肪組織の病態形成に血管新生が必須であることが示唆された。
以上より、血管新生と脂肪細胞分化が密接な関連をもって、肥満脂肪組織のリモデリングを形成し、新規抗肥満・糖尿病治療の標的となり得ることが明らかになった。
▲ページのトップへ
2-3.生体内の脂肪組織の可視化 生体分子イメージングの開発
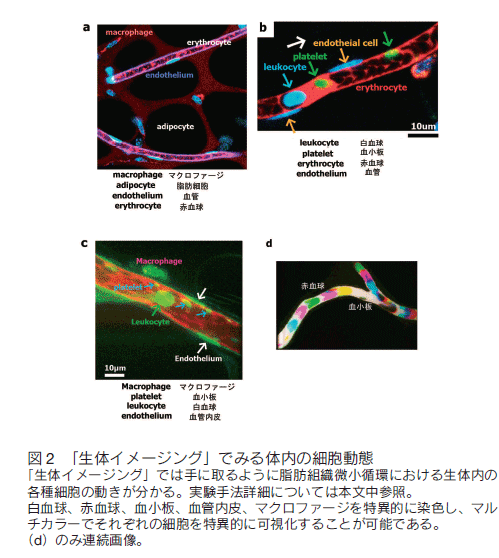
従来、様々な臨床研究等によって、肥満に伴って脂肪組織内で慢性炎症が起きていることが示唆されていたが、その詳細な機序は不明であった。そこで、我々は本イメージング手法を生体に応用し「生きた動物の体内の脂肪組織を手に取るように可視化すること」に成功した。そして、本手法により、肥満組織において炎症性の細胞動態が臓器特異的に生じていることを明確に示している(図 2) 4)。
▲ページのトップへ
2-4. 肥満脂肪組織と慢性炎症
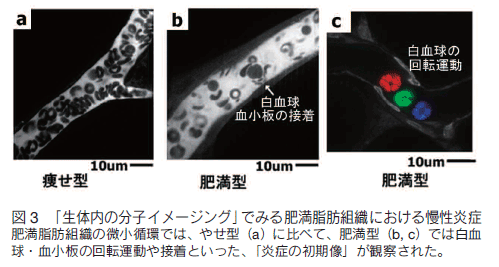
我々は生体内分子イメージング手法を肥満内臓脂肪組織に応用することにより、脂肪組織内の微小血管で炎症性変化が起きていることを明らかにした。すなわち、肥満動物の白色脂肪組織内微小循環の観察で、炎症の最前線である細静脈レベルにおいて、血管壁への白血球の接着・回転・血管外漏出運動が有意に増加していることをイメージングにより示した 4)。すなわち、動脈硬化病変で知られているような炎症性の細胞動態が、肥満した脂肪組織の微小循環でも認められており、「肥満脂肪組織そのものが炎症の場である」ことが可視化手法により明確に示された(図 3)。
▲ページのトップへ
2-5. CD8 陽性 T 細胞の重要性 肥満病態の最も初期のトリガーは何か?
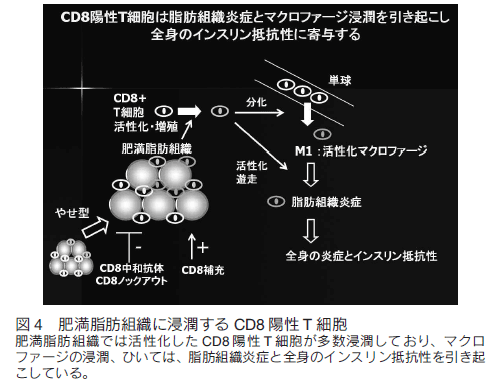
我々は、分子イメージング及び FACS を用いた解析から、脂肪組織の間質に多くのリンパ球が存在することも明らかにした。前述の通り脂肪組織は多数の免疫細胞を含んでいる。痩せ型マウスでも間質細胞の約 10%は T 細胞であり、肥満に伴ってその数は増加する。 T 細胞サブセットの解析では、肥満に伴い、CD8 陽性 T 細胞の増加、CD4 陽性 T 細胞・制御性 T 細胞の減少が認められた 5)。我々以外のグループでは、Winer らは T 細胞を標的とした免疫療法によりマウスの肥満が改善することを示している 6)。また、脂肪組織にはマスト細胞・制御性 T 細胞といった特有の T 細胞が存在し、局所免疫や脂肪組織炎症をコントロールし、肥満に伴うインスリン抵抗性に寄与していることも明らかになっている 7, 8)。その後、多くのグループが脂肪組織の T 細胞の役割についてマウス及びヒトレベルで解析を行っているのが現状である。このように、脂肪組織局所においてはマクロファージや T 細胞をはじめとする多様な細胞が相互作用し、メタボリックシンドロームの病態を形成していると考えられた。我々の検討では、肥満脂肪組織では CD8 陽性 T 細胞がポリクローナルに活性化・増殖しており、この CD8 陽性 T 細胞は骨髄由来の単球からマクロファージへの分化、及び、マクロファージの肥満脂肪組織への遊走・活性化を促進していた。さらに、この CD8 陽性 T 細胞の大部分は骨髄由来であることが骨髄移植実験により確かめられている(図 4)。つまり、肥満脂肪組織における炎症性マクロファージ浸潤の初期のトリガーが CD8 陽性 T 細胞の浸潤であることが示唆された。異常な肥満脂肪組織における局所免疫異常が、全身及び肥満脂肪組織の炎症、さらに糖尿病の病態を引き起こしていることが示された。ヒトサンプルにおいても、肥満者の皮下脂肪組織において CD8 遺伝子が高発現となることから、CD8 陽性 T 細胞はマウスのみならず、ヒトにおいても重要な役割を持つことが示されている。
▲ページのトップへ
2-6. 脂肪組織イメージング手法 方法論を中心として
我々の開発した「生組織イメージング」手法について概説する。我々はまず、「脂肪組織をよりよくみるために」、スピニングディスク方式の一光子レーザー共焦点顕微鏡を用いて、生きたままの組織をそのまま染色する、(生体外での)「生組織イメージング」手法を開発してきた。手法としては、脂肪組織をマウスより取り出し、未固定のまま細かく切り出し、蛍光色素の入った培養液中でインキュベートし、生きたまま蛍光標識を行う。従来の手法、すなわち、固定した組織切片標本では、脂肪組織は白く抜けた脂質と、細胞質・核の集合体として漠然としか組織構築が捉えられなかったが、我々の手法では組織構築の詳細が可視化されている(図 1 参照)。
さらに、新たに開発した「生体分子イメージング」手法を概説する。現在、光学機器の進歩に伴い、高速レーザー共焦点顕微鏡を用いて、血流の方向と平行にごく狭い断面に焦点を合わせて画像取得し、高速に血管内を変形しながら流れる赤血球・白血球・血小板に各々フォーカスを合わせて観察が可能となった(図 2、3 参照)。血管内の細胞動態を明らかにするために、我々は主に多数のピンホールを有する円盤を高速回転させて画像を取得するニポウ式の共焦点ユニット(横河電機、CSU X1)、及び、シングルビームで組織をスキャンするレゾナンス型高速共焦点システム(Nikon A1R)を組み合わせて用いることにより、高速イメージングを行っている。
▲ページのトップへ
3.血小板機能の生体イメージングを用いた可視化
本邦の死因の上位を占める脳・心血管イベントの多くは血管の動脈硬化性変化を基盤としている。例えば、血栓性疾患(アテローム血栓症)では慢性炎症病態を基盤とした動脈硬化巣の形成と、それに引き続いて起こる、粥腫(アテローム)の破綻が病態形成に重要である。破綻部位においては、血小板は活性化され、血小板血栓が形成される他、凝固系も病態に関与する。しかし、動脈硬化巣の破綻は偶発的かつ高速に進行する病態であり、実験的にこれらを ex vivo 、 in vitro で再現することは不可能であった。
実際に、これら一連の過程には血小板のみならず、各種炎症性細胞、血管内皮細胞とその障害、局所の血流動態変化(血流とずり応力)が関わっている。このような多細胞からなる複雑病変とそのダイナミクスが血栓性病態の本質であり、これらを生体内で検討する手法が、病態理解の上で求められている。その検討を可能にしたのが我々の開発した「生体分子イメージング」手法である。
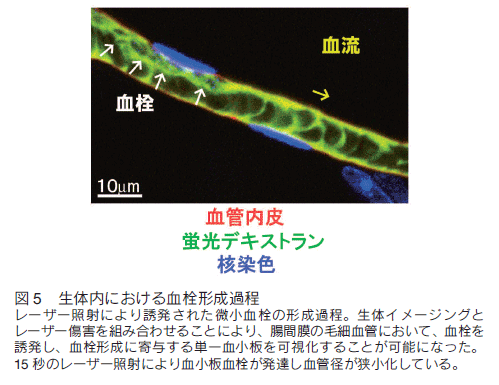
血小板を FITC - デキストラン及び抗 CD41 抗体により可視化したところ、定常状態においては、細動脈・静脈では主に血管壁近傍に沿って血小板は運動していた。一方、流速の遅い毛細血管のレベルでは、血小板は血管内皮と相互作用して「stop and go」を繰り返しており、血流に乗って回転運動している様が可視化された。さらに、レーザー照射・傷害と組み合わせることで血栓形成を誘発し、生体内での単一血小板を捉えながら、血栓形成のメカニズムの詳細が可視化された(図 3)。
我々は、レーザー傷害による ROS 産生を伴う血栓形成モデルと生体イメージングを組み合わせ、血小板機能に異常を来す各種遺伝子改変動物における血栓形成過程を観察し、生体内での血小板機能との関係を明らかにした。我々のモデルでは楕円形を伴った血小板のみが血栓形成しており、一方、血管内皮の構築は保たれていた。炎症性サイトカインのノックアウトマウス、キメラマウスの解析の結果、TNF-αをはじめとする炎症性サイトカインが、 ROS 刺激下での vWF 因子の血管内皮表面への表出に関わっていることが明らかになった。さらに、IL-1、IL-6 等の因子も血栓性を促進しており、これらの炎症性サイトカインは血管内皮に作用し、インテグリンシグナルと協同して、血栓の安定化に寄与していた。従来、炎症と血栓については多様な報告によりその関連が示唆されていたが、本解析により血栓形成過程のうち、血管内皮における炎症性サイトカインのシグナリングが血栓形成に関わっていることが示された 9)。
我々の血栓形成モデルでは、まずレーザー照射により活性酸素の産生が誘発されて血管内皮に血小板が付着する。活性酸素は血管内皮細胞に直接働き、パイエル小体中の von Willebrand 因子を、細胞膜表面上に移動させる。一方、活性酸素は血小板にも直接作用し、P-selectin、GPⅡbⅢa といった機能蛋白が血小板表面に誘導される。その結果、血管内皮の von Willebrand 因子と血小板表面の GPⅠb が結合し、血栓が誘発される。その後、血小板はその数を増やし積み上り、血管内腔を狭小化し、血液の流速は遅くなる。最終的には、赤血球、もしくは、白血球により血管は閉塞する。我々のモデルが特徴的なのは、血栓形成の全過程が数十秒で終わり、時間的に経過が極めて早いことと、画像が高解像度であることである。本モデルではレーザー照射後に血栓形成に寄与した血小板数を数えることによって血栓形成能を明確に定量可能である。従来の頸動脈に対する塩化鉄傷害モデルにおける血栓による閉塞時間とも強い相関を示しており、生体内の血小板機能を極めて鋭敏に反映していると考えられる。それだけでなく、従来の止血時間の計測では分からなかった、血栓形成の素過程が可視化されており、遺伝子改変の効果がどの過程に影響を及ぼしているかを明らかにすることができる。
我々は本手法を用い、Lnk というアダプター蛋白に注目して実験を進めた。 Lnk は血球系幹細胞の維持に重要な蛋白であるが、巨核球・血小板にも発現しているが、その機能は不明であった。興味深いことに、 Lnk の欠損した遺伝子改変動物では、流血中の末梢血小板数が野生型の 5 倍になるにも関わらず血栓性を示さず、むしろ止血時間が延長しており、Lnk の欠損が血小板機能に影響をもたらしていると考えた。骨髄移植を行い作成した Lnk キメラマウスを用い、生体イメージングにより血栓形成過程を観察したところ、血球系でのみ Lnk が欠損した Lnk キメラマウスではレーザー傷害により血小板は一過性に血管内皮に付着するものの、血栓は安定化せず血流に崩され、血小板血栓の発達が阻害されているさまが可視化された。すなわち、Lnk が血小板血栓の安定化に寄与していることが示された。分子生物学的機序としてはリン酸化した Lnk が、c-Src、Fyn と協同してインテグリンのシグナリングに関与していた 10) 。以上より、Lnk が生体内血栓の形成・安定化に寄与していることが明確に示された。
さらに Lnk の遺伝子変異がヒトにおいては、多血症・血小板無力症や骨髄増殖性疾患を引き起こすことも報告されている 11, 12)。多血症では血小板数は増加するものの、血小板機能は低下していることが多く、今回、Lnk ノックアウトマウスでみられた表現型にきわめて近いと言え、Lnk の血小板機能における重要性がマウスだけでなく、ヒトにおいても示されている。
今後は、さらに様々な血小板機能に異常を来す遺伝子改変動物における血栓形成過程・血小板動態を観察することにより、「生体内の血栓形成の各過程における遺伝子・物質の関与」が明らかになると思われる。
 ▲ページのトップへ
4. iPS 由来人工血小板の体内イメージング
近年の、多能性幹細胞 (ES, iPS)の研究の進歩により、細胞療法を含む再生医学での広い範囲での臨床応用が期待されている。しかし、これらの幹細胞を用いた基礎研究を臨床現場に繋げるためには、in vitro での知見をヒトを対象とした研究に応用する前に、実際に試験管内で作成した細胞が、実際の個体(マウス及び大動物)の中でどのように機能しているか、どのように病変に働くかを明らかにすることは必須である。しかし、今までこれら iPS 由来の分化誘導細胞の体内での細胞動態を検討する手法は存在しなかった。我々は、京都大学 iPS 研究所江藤教授チームとの共同研究の結果、 iPS 細胞を誘導するのに必要な山中四因子の中の c-Myc の発現をコントロールすることにより、飛躍的かつ効率的に、ヒト iPS 由来の人工血小板を作成する手法を確立した。我々は生体イメージングを用いて、こうして得られたヒト iPS 由来血小板の体内動態の可視化を行った。観察に用いた免疫不全マウス(NOG マウス)の体内では、iPS 由来人工血小板の細胞動態が捉えられた。 iPS 由来血小板がマウス体内を循環しているだけでなく、レーザー傷害により誘発された血栓形成部位においてはホスト血小板と iPS 由来血小板が相互作用しながら血栓を形成するさまが観察された。つまり、「人工血小板は体内を循環し、血栓も作る」ことが証明されたわけである。このように、本イメージ手法は iPS 分化誘導細胞を用いた細胞療法の臨床応用に向けて、安全性・有用性を評価する上できわめて有用性が高い手法と言える 13)。さらに、最近では、人工血小板の作成を飛躍的に改善する分子メカニズムがより明らかになりつつあり、臨床応用も近いと考えられる。
▲ページのトップへ
5. 次世代のイメージング 深部を照らす機能イメージング
我々は今まで主にニポウ式レーザー共焦点、一光子励起の組み合わせで画像取得を行ってきた。しかし、深部臓器・臓器内部の構造に関しては可視化できず、遺伝子機能も不明であった。生体の各種病態下での細胞連関・情報伝達異常をより明らかにするためには、形態と機能とを組み合わせた深部の光イメージングが今後必要になると考えられる。例えば、遺伝子改変動物を用いた遺伝子機能の光による解析を、二光子フェムト秒レーザーと高速スキャニング共焦点システムで行うというものであり、既に多くの生体内深部の知見が得られている。二光子励起による生体イメージングについては、脳組織を用いたイメージングが先行し、それ以外の臓器での知見についてはあまり研究されてこなかったのも実情である。しかし、今後は光学機器の改良に伴う画像の改善・操作性の改善・扱いやすさ使いやすさの向上、顕微鏡システムの価格の一般化、光学プローブの開発改良、が総合的に進むと考えられ、初心者の研究者でも、これらの手法が今後可能になると考えている。
| 著者プロフィール |
|
| 氏名 |
西村 智 |
| 所属 |
東京大学医学系研究科循環器内科
東京大学システム疾患生命科学による先端医療技術開発拠点 特任准教授 |
| 所在地 |
東京都文京区本郷 7-3-1
TEL: 03-3815-5411 FAX: 03-3814-0021
|
| E-mail |
snishi-tky@umin.ac.jp |
| 出身学校 |
東京大学医学部医学科
|
| 学位 |
医学博士(東京大学) |
| 現在テーマ |
内科学、生活習慣病と慢性炎症の関わり、免疫細胞、イメージング |
▲ページのトップへ
|