 |
| トップページ > 「蛍光生物学」の最前線 8-1 |
 |
|||||||||||||||||||||||||||||||
「蛍光生物学」の最前線 8-1
はじめに 全身に張り巡らされた血管は、組織や細胞に酸素や栄養を供給し、二酸化炭素や老廃物を回収することで、生命維持に重要な役割を果たしている。血管ネットワークは胎生期に、血球・血管前駆細胞から原始血管叢がつくられる脈管形成、次いで、既存の血管から血管枝が発芽・伸長し、新たな血管網を構築する血管新生のプロセスを経て形成される。成体では通常、血管新生は、子宮内膜や創傷治癒など限られた部位でしか見られないが、癌や糖尿性網膜症などの疾患では、病的な血管新生の誘導により、未熟で異常な血管が形成され、病態が悪化する。血管新生において、内皮細胞は血管内皮増殖因子(vascular endothelial growth factor: VEGF)などの血管新生因子に反応して、血管から出芽、遊走、増殖することで新たな血管を形成する。血管新生におけるこのような複雑な内皮細胞の振る舞いは、これまで主に、2 次元環境下の培養内皮細胞を用いて、解析されてきた。それにより、血管新生に関わるシグナル分子が同定され、また、それら分子の生化学的な性質等が明らかにされてきた。しかし、血管新生は生体という 3 次元環境下で起こる現象であり、図 1 に示すように、培養皿上の内皮細胞と生体の血管新生過程の内皮細胞は、全く異なった形態、挙動を示す。従って、血管新生における内皮細胞の振る舞いを制御する分子機序を理解するには、生きた個体の血管新生過程の内皮細胞を研究する必要がある。 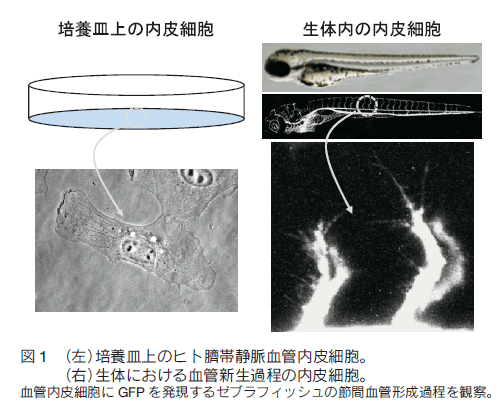 1.蛍光イメージングをするための遺伝子改変ゼブラフィッシュの樹立 ゼブラフィッシュ個体で分子や細胞の機能情報を解析するため、これら情報を可視化するための蛍光バイオセンサーを発現するトランスジェニックゼブラフィッシュを樹立する必要がある。そのために、筆者らは、遺伝研の川上浩一博士らが開発した Tol2 トランスポゾン転移システムを用いている。川上博士らは、メダカゲノム中から発見されたトランスポゾン Tol2 が、ゼブラフィッシュの生殖細胞でも転移酵素として機能することを明らかにし、ゼブラフィッシュにおいて簡便で非常に効率のよいトランスポゾン転移システムを開発した 1, 2)。 Tol2 がコードしている転移酵素遺伝子の mRNA と発現させたい遺伝子をコードした Tol2 ドナープラスミド DNA をゼブラフィッシュ受精卵に微量注入することで、目的遺伝子を染色体ゲノムに効率的に組み込ませることができる。 また、 BAC のような 100 kb 以上の大きな Tol2 ドナープラスミド DNA も転移反応により、ゲノムに挿入することができる。 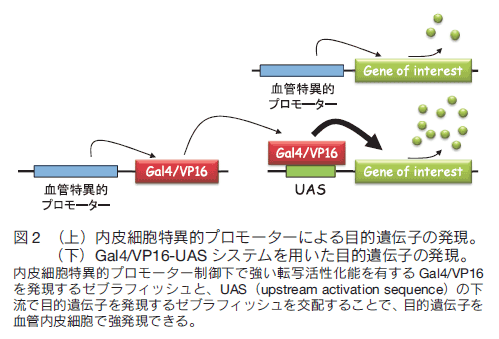 2.内皮細胞の “形態・運動” を制御する細胞内シグナル伝達系の解析血管新生において、伸長する血管の先端に位置する内皮細胞を Tip 細胞という。 Tip 細胞は、先導端にフィロポディア(糸状仮足)を伸ばしながら、血管新生因子を感知し、血管が伸長する方向を決定する 7)。著者らは、血管新生過程の Tip 細胞の形態・運動能を制御する分子メカニズムの解析を行った。細胞の形態・運動能の制御には、アクチン細胞骨格系の再編成が重要である。そこでまず、血管新生過程の内皮細胞におけるアクチン細胞骨格系を可視化するため、アクチンバイオセンサー Lifeact-mCherry を内皮細胞で発現するゼブラフィッシュを樹立した。Lifeact は、酵母の Abp140 に由来する 17 アミノ酸からなるアクチン結合ペプチドであり、蛍光タンパク質に付加して細胞に発現させることで、生細胞におけるアクチン動態のライブイメージングが可能になる 8)。 図 3 に示すように、血管新生過程の Tip 細胞は、先導端で活発にアクチン重合を促進することで、フィロポディアを形成することが分かった。 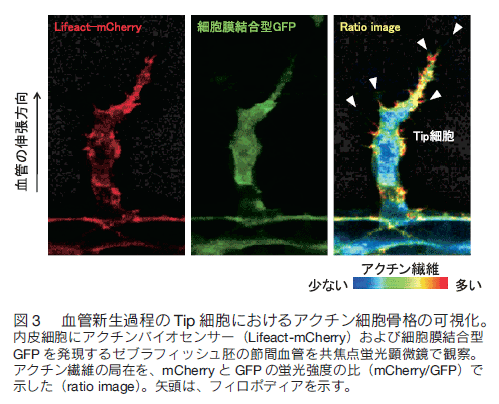 Rho ファミリー低分子量 G タンパク質は、アクチン細胞骨格系の制御で中心的な役割を持つ細胞内シグナル分子である。哺乳動物には、 20 種類以上の Rho ファミリーメンバーが存在するが、なかでも Cdc42 はフィロポディア形成能を有することが知られている 9)。そこで、 Tip 細胞におけるフィロポディア形成が Cdc42 によって制御されているか検討を行った。そのために、京都大学松田道行教授が、蛍光(またはフェルスター)共鳴エネルギー移動 (fluorescence/förster resonance energy transfer: FRET)の原理を基に開発した Cdc42 FRET バイオセンサーを血管内皮細胞で発現するトランスジェニックゼブラフィッシュを、Gal4/VP16-UAS システムを用いて樹立した。 FRET とは、励起されたドナー分子から、近傍のアクセプター分子にエネルギーが遷移する現象である。 Cdc42 FRET センサーでは、ドナーに CFP を、アクセプターに YFP を用い、 Cdc42 とそのエフェクターである p21-activated kinase の Cdc42 結合ドメイン(PakCRIB)を YFP と CFP で挟んだ構造をしている 10, 11)。 Cdc42 は不活性化状態では PakCRIB に結合せず、YFP-CFP 間の距離が離れているため FRET が検出されないが、 Cdc42 が活性化すると PakCRIB と相互作用し、それに伴って YFP-CFP 間の距離が近まり FRET が起こる。この FRET を測定することで Cdc42 活性を可視化することができる。松田教授は 、 Cdc42 以外にもシグナル分子活性を可視化する FRET バイオセンサーを多数開発しており 12)、その詳細は、松田研究室のホームページに記載されているので、是非一読を勧める。 この Cdc42 FRET バイオセンサーを内皮細胞で発現するゼブラフィッシュを用いて、血管新生過程の内皮細胞における Cdc42 活性をライブイメージングにより観察したところ、 Tip 細胞の先導端で形成されるフィロポディアで Cdc42 活性が高いことが示された(図 4)。さらに、 Cdc42 阻害蛋白質 ACK42 を血管内皮細胞に発現させると、 Tip 細胞のフィロポディア形成および血管新生が顕著に抑制された 13)。これらの結果から、血管新生因子が Tip 細胞に作用することで Cdc42 依存的にフィロポディアを形成し、血管新生を誘導することが示された。現在、 Cdc42 の下流因子についても解析を行い、フォルミンファミリーに属するアクチン制御蛋白質の関与を示唆する知見を得ている。 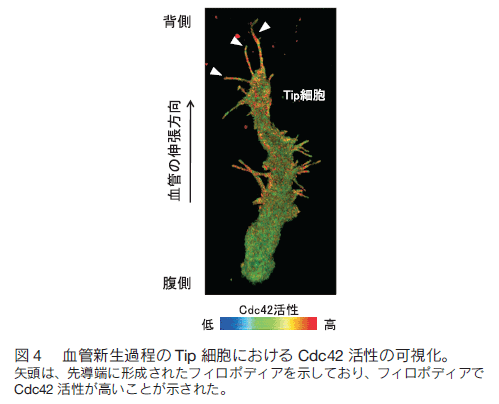 著者らはさらに、血管新生過程の内皮細胞の形態・運動能制御におけるホスファチジルイノシトール(phosphatidylinositol: PI) 3 キナーゼの役割を検討した。PI3 キナーゼは、PI4, 5 -二リン酸(PIP2)をリン酸化し、PI-3, 4 ,5 -三リン酸(PIP3)を産生することで、形態、運動、生存、分化など様々な細胞機能を制御する細胞内シグナル伝達分子である 14)。血管新生過程の内皮細胞における PI3 キナーゼの活性化部位を知るため、 PI3 キナーゼの産物である PIP3 の局在を可視化するバイオセンサー Akt-PH-mVenus を内皮細胞で発現するゼブラフィッシュを樹立し、解析した。その結果、先導端に形成されるフィロポディアで PIP3 の産生が観察され、その領域での PI3 キナーゼの活性化が示唆された。そこで、血管新生における PI3 キナーゼの役割を知るため、血管新生が活発な受精後 24 〜 30 時間のゼブラフィッシュ胚を PI3 キナーゼ阻害剤で処理したところ、背側大動脈から背側に向かって伸びる節間血管の形成が顕著に抑制された(図 5)。また、アクチンバイオセンサーを発現するゼブラフィッシュを用いて Tip 細胞の形態を詳細に解析したところ、コントロールの胚では、 Tip 細胞は遊走方向に多数のフィロポディアを形成したのに対し、PI3 キナーゼ阻害剤で処理した胚では、 Tip 細胞は、血管が伸長する方向だけでなく、側方にも多数のフィロポディアを形成し、背側への一方向性の細胞運動が抑制されていた(図 5)。以上の結果から、PI3 キナーゼは Tip 細胞の極性形成に関与することで、 Tip 細胞の一方向性の細胞運動を制御している可能性が示唆された。 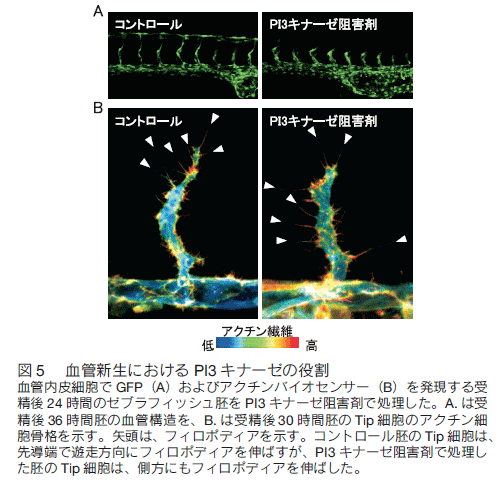 3.血管形成における内皮細胞の細胞周期の可視化血管形成における内皮細胞増殖の意義を明らかにするため、血管形成における内皮細胞の細胞周期を観察した。そのため著者らは、理化学研究所の宮脇敦史博士らが開発した、細胞周期バイオセンサー Fucci(Fluorescent, ubiquitination-based cell cycle indicator)を血管内皮細胞で発現するゼブラフィッシュを樹立した 15, 16)。 Fucci は、細胞周期制御に関わる Geminin と Cdt1 の二つのタンパク質をもとに開発された細胞周期バ イオセンサーである。Geminin は、DNA 複製から細胞分裂に至る S/G2/M 期に蓄積し、G1 期にはユビキチン-プロテアソーム系により分解される。一方、Cdt1 は、分裂をおえた細胞が DNA 複製の準備をする G1 期に蓄積し、 S/G2/M 期では、ユビキチン-プロテアソーム系により分解される。Fucci バイオセンサーは、Geminin と Cdt1 の分解に関わる領域に、異なる蛍光タンパク質を融合した 2 種類のタンパク質で構成される。そこで、flk1プロモーター制御下で mVenus-Geminin および mCherry-Cdt1 を発現するトランスジェニックゼブラフィッシュを樹立し(Tg(flk1:mVenus-Geminin; Tg(flk1:mCherry-Cdt1))、血管発生の各ステージにおける内皮細胞の細胞周期を、共焦点蛍光顕微鏡を用いて観察した(図 6)。血管発生初期の受精後 24 時間胚の血管では、多くの内皮細胞が S/G2/M 期であったのに対し、血管形成が進行した受精後 72 時間胚の血管では、ほとんどの内皮細胞の細胞周期は G1 期で停止していた。 以上の結果から、血管新生過程の内皮細胞は、活発に増殖することで新たな血管を形成するが、血管構造が構築されると、内皮細胞は細胞周期を停止し、増殖を止めることで、新生血管の安定化に寄与すると考えられる。現在、血管形成過程および血管構築後の内皮細胞の細胞周期が、どのような分子メカニズムで制御されているか検討を行っている。 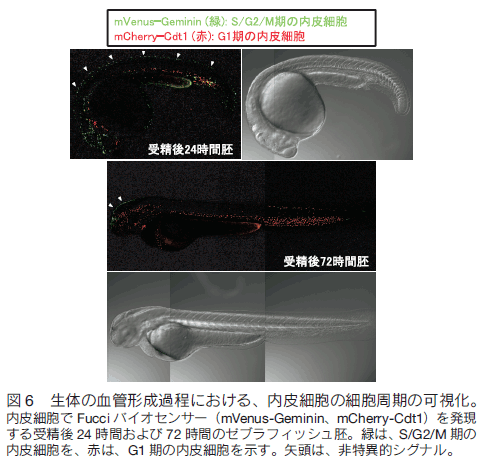 4.今後の展開 今回、ゼブラフィッシュの蛍光イメージングによる血管形成メカニズムの解析について紹介した。これまでの分子生物学研究の進歩により、血管で機能する遺伝子やそれら遺伝子がコードするタンパク質に関する分子レベルの知見が飛躍的に増大した。今後、ゼブラフィッシュの蛍光イメージング解析により、これら分子の生体における機能の解明が進むことが期待される。
|
|||||||||||||||||||||||||||||||
| Copyright(c) 1996-2012 DOJINDO LABORATORIES, ALL Rights Reserved. |

