 |
| トップページ > 「蛍光生物学」の最前線 7-1 |
 |
|||||||||||||||||||||||||||||||||||||||||||||
「蛍光生物学」の最前線 7-1
1.はじめに脳の中をのぞいても肉眼ではただの乳白色の塊でしか見ることはできない。神経科学の勃興期においては、脳を構成する神経細胞の形態を明らかにすることは最も重要な課題であった。ゴルジによる疎らな神経細胞の染色が個々の神経細胞の形態を顕在化させた。加えて、顕微鏡の発達によって脳を構成する細胞群の様相や神経細胞同士の関係が形態学的に示され、脳を構成する神経細胞に関する知見が蓄積されてきた。しかし、ゴルジ法の世界はモノクロであり、ホルマリン固定された組織を対象とする方法のため、脳の持つ機能や変化を記述することは非常に困難であった。 さらに数十年の後、様々な波長を発する蛍光物質や蛍光タンパクの研究が進んだが、それらを生物学的研究に資することで、神経科学に限らず、細胞の形態や機能メカニズムの解析が飛躍的に進んだ。その一番の理由は、蛍光物質や蛍光タンパク質により観察対象を生きたまま可視化できたためである。現在では、様々な生物学的研究分野において蛍光物質は用いられ、生きた細胞の機能を可視化することで細胞の機能が続々と解明されてきている。しかし、我々の様に生きた個体においてこれらの蛍光物質をみるためには大きな障壁が存在する。それは「生体は不透明である」ということである。即ち、蛍光物質を観察する為には光が必要であるが、我々の肉体は可視光を極めて透過しにくい。そんな中、様々な技術の展開と学際的な応用により、多光子励起過程という現象を利用して蛍光物質を励起することで、これまで観ることが出来なかった生体深部の蛍光イメージングが可能になってきた 1, 2)。 2.多光子励起過程 様々な新しい光学顕微鏡法の中で、多光子励起レーザー顕微鏡は多光子励起過程を用いた方法論である。蛍光物質は通常、特定波長の励起光により第一電子励起状態へ遷移し、蛍光を発しながら基底状態に戻る。一方、複数個の光子の同時吸収により起こる多光子励起過程は、量子力学的には実現する確率が極めて低い過程である。 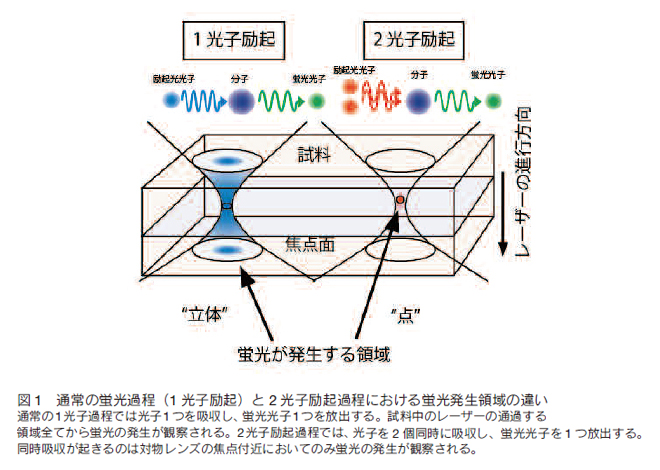
3.生体脳を可視化するA) 生体組織の分光的な窓生体組織の組成の 70% 以上が水である。水は透明であり、ほとんどの光を透過するように思われるが、実際には 400 nm 以下の紫外光と 1200 nm 以上の赤外光に非常に強い吸収をもつ(図 2)。通常の 1 光子励起では励起光も蛍光も基本的に可視光であることから透過率という点で問題は無いように思われるだろう。しかし、より短波長の励起を用いる共焦点顕微鏡の場合には、励起光と蛍光の散乱の問題が顕在化する。生体試料は通常の分子や微粒に起因する散乱に加え、屈折率界面が多いことにより散乱係数がさらに高くなっていると推定される。例えば、固定脳組織の場合、表面からのほんの 100 μm 程度の深さの構造も明瞭に観察することができない。一方、多光子顕微鏡法では励起光は近赤外の領域にあるので、散乱の影響を受けにくい。さらに、多光子顕微鏡で多く用いられる NDD 型の検出器では、蛍光の散乱の問題も低減される。なぜなら、共焦点顕微鏡の共焦点ピンホールが排除するような散乱された蛍光成分も多光子顕微鏡では結像に利用できるためである。このように生体組織深部でのイメージングに適している。結果、長波長励起による組織透過性を確保しつつ、深部からの蛍光を断層像として取得できる最も有効な顕微鏡法として、脳研究に大きく貢献してきている 6-9)。 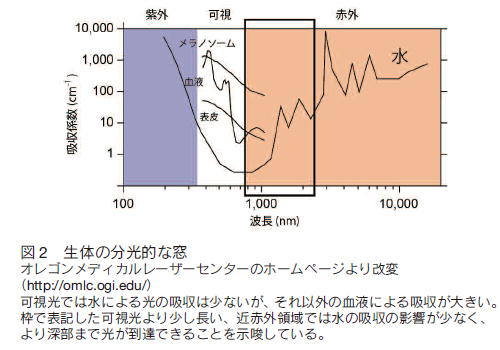 B) in vivo 観察のための外科的手術生きたマウス個体の脳を可視化するにあたって、そのイメージングに対し最も障害になるのが頭蓋骨である。マウスにおいては頭蓋骨の厚さは週齢を経るごとにその厚さを増していき、成獣の場合、おおよそ 100 μm の厚さになる。頭蓋骨は高散乱体であり、多光子顕微鏡に用いるレーザーが長波長であるとはいえ、骨越しにイメージングすることは非常に困難である。それゆえ、現在では生体脳をイメージングする為の手法としてこの頭蓋骨を外科的に処理することでその中にある脳をイメージングする方法が実施されている。外科手術による頭骨処置法には大きく分けて 2 種類あり、一つは頭蓋骨をカバーガラスに置換、もしくはアガロースで封入する Open skull 法である。この手法は高散乱体である頭蓋骨を透明体に置換することで、励起光の到達度および蛍光取得量を向上させる。それゆえに脳深部における精細な画像を取得できる。しかしながら、頭蓋骨を置換する手術はある程度の熟練を必要とする。なぜならば、頭蓋骨を切除することは必然的に出血を回避できないためである。特に脳深部をイメージングする際に脳表面での出血は可視光のヘモグロビンによる吸収が強い為に蛍光取得を大きく損ねる(図 2)。それゆえ、この方法では出血を最低限に抑えたうえで、脳そのものへのダメージを低減することが重要である(図 3)。また、多光子顕微鏡下で電気生理学的手法を組み合わせて機能形態学的な解析をする場合、硬膜を除去する必要がある。マウスにおいて硬膜は非常に薄く、脳実質に障害を与えることなく硬膜を除去することは非常に難易度が高い。また、脳実質が外界と直接触れあうために、炎症に対する処置や、浸液および対物レンズの温度コントロールが長時間のイメージングに重要な意味をもつ。これらの諸注意事項を解決した上であれば、生体マウス大脳皮質の全層にわたって多光子顕微鏡を用いて可視化することが可能である。 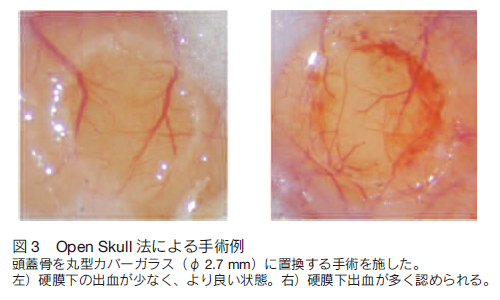 in vivo 多光子顕微鏡法は電気生理学的な解析を同時に実施することで、さらなる詳細な神経細胞の機能解析が可能である。電気生理学的解析には必ずと言ってよいほど電極を刺入する必要がある。その為に、 Open skull 法とは異なる Direct Access 法が採られる。この手法は頭蓋骨をカバーガラスに置換せず、アガロース等のゲルを脳表面に流し込むことで、電気生理用の電極が刺入できるようにしたものである。多くの場合、電極を差し込む為に硬膜を除去してしまうことから、対物レンズの浸液を加温した人工脳脊髄液で潅流する必要がある。また、カバーガラスに置換しつつ、観察部位には影響の少ないと考えられる部位の頭蓋骨に電極刺入用の穴を別に開けることで極力外界からの影響を抑える手法も提唱されている 10)。 C)in vivo 多光子顕微鏡イメージング 観察用の窓を作る手術を頭蓋骨に施した後、多光子顕微鏡下にマウスを安定に保定しなければならない。正立型の顕微鏡では通常のプレパラートによる観察と異なり、マウスの個体を対物レンズ下に固定する必要性があることから、付属の顕微鏡 XY ステージを利用することは難しい。それは、対物レンズの動作距離はメーカーによっても異なるが、マウスの頭が入るほどの距離は確保されていないからである。そのため、ステージ位置を下げた仕様のものを作製するか、スキャナヘッドの高さを特注で変更しなければならない。マウス頭部を固定する為には脳定位固定装置をステージに取り付け、対物下に保定する方法がよく用いられる。 しかしながら、脳定位固定装置はイヤーバーやノーズバーによる締め付けが脳圧を上げているためか、心拍の影響が顕著にでることが経験的に知られている。そこで、頭蓋骨に金属製の固定具を歯科用セメントで取り付け、その固定具をステージに取り付けた専用の器具で挟み込み、マウスの頭を吊り下げる手法がよく用いられている。マウスの頭部を対物下に保定する際に最も注意すべき点は、手術で取り付けたカバーガラスが可能な限り水平になるようにすることである。スライドグラスによる観察とは異なり、カバーガラスや手術部位が大きく傾いた状態では非点収差が発生しイメージングの質に大きな影響を与えるからである。 in vivo イメージング中、問題として起こりやすいのは体温低下や高濃度麻酔による死亡が挙げられるが、体温保持の為のヒーターや呼吸管理、血中酸素濃度の測定をおこなうことで、より長時間の安定なイメージングが期待できる。 4.最後に最近、筆者らは高感度の NDD 検出器の導入や励起光の条件の最適化を行うことで、Open Skull 法を改良した。その結果、生きたマウスの脳において、これまで観察できなかった大脳皮質下にある海馬錐体細胞の観察に成功した(図 4)。現状の in vivo 多光子顕微鏡にはまだ改善の余地が残っていることを強く示唆する。例えば、光学顕微鏡技術としては、生体組織内で生じる収差を補正する「補償光学系」の提案がなされている 12)。また、レーザー技術としては、レーザーチタンサファイアレーザーでは発振できない 1000 nm 以上の長波長を発する高出力のパルスレーザーが開発されてきており、生体組織の分光的な窓のうち、これまで使えていなかった 1000 から 1300 nm の領域を生体観察に用いることができるようになってきている。さらに蛍光物質においても赤色から近赤外にピークを有し、これまで以上に明るい蛍光物質や蛍光タンパク質の開発がなされてきている。これらの技術的な発展により、深部脳のイメージングやより非侵襲の生体脳イメージングが可能になるであろう。 
|
|||||||||||||||||||||||||||||||||||||||||||||
| Copyright(c) 1996-2012 DOJINDO LABORATORIES, ALL Rights Reserved. |


