「蛍光生物学」の最前線 6-2
生物発光・蛍光イメージングを用いたがん細胞とがん微小環境の解析
今村 健志 1,2、疋田 温彦 1,2、本蔵 直樹 1,2、大嶋 佑介 1,2,3
1 愛媛大学大学院医学系研究科 分子病態医学分野
2 科学技術振興機構 戦略的創造研究推進事業
3 愛媛大学 医学部付属病院 先端医療創生センター |
はじめに
これまで、がんは‘均一な細胞の集団’と考えられていた。ところが、近年、がんは‘不均一な細胞の集団’であり、特に、幹細胞様の性質を持ったごく少数のがん幹細胞が、発がんから転移・再発に関与していると考えられるようになってきた 1)。さらに、がんは周囲を血管や間質といった微小環境(がん微小環境)が支えている複雑な組織であるが、このがん微小環境が発がんや転移にも強く関わる可能性がわかってきた。特に、がん幹細胞は、ニッチと呼ばれる特殊な環境によって自己再生能や多分化能の維持、制御された増殖や分化等の特性を付与されると考えられている。以上のことから、これからのがん研究では、がん幹細胞とニッチを中心としたがん-がん微小環境から構成される複雑なネットワークを理解して、その分子メカニズムを解析する必要がある。
このような問題点を解決するために必要なテクノロジーの一つにバイオイメージング技術がある 2, 3)。中でも生物発光技術や蛍光技術を用いた生体光イメージングは、他のイメージング技術と同様に、同一個体を低侵襲で経時的に解析することが可能であるのみならず、他のイメージング技術に比べ、簡便で安全性が高く、高空間分解能の解析が可能である。さらにプローブにさまざまな工夫を凝らすことで多元的解析や機能解析が可能であり、抗体等を付加することで選択性・特異性が高いイメージングが実現できる。本稿では、生物発光や蛍光など光を駆使したがんイメージングについて、特に、がん細胞とがん微小環境の解析に焦点を絞り、我々のデータを紹介しながら解説する。
▲ページのトップへ
1. 生物発光イメージングを利用したがん細胞追跡とシグナル伝達解析
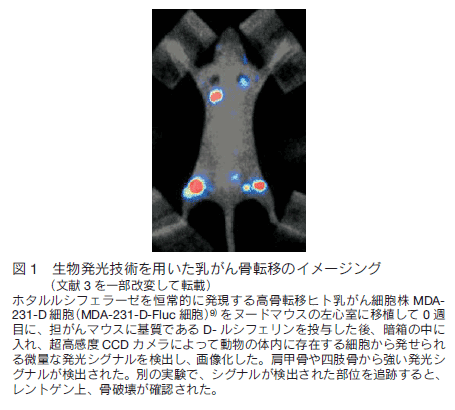
ホタル、ウミシイタケや鉄道虫などは、体内で発光酵素ルシフェラーゼを利用して、基質である D-ルシフェリンやセレンテラジンを酸化反応によって発光体に変換し、光を発生させる。このシステムは、細胞生物学実験において、 ATP 活性測定やレポーターによる転写活性測定に広く用いられてきたが、ルシフェリン等の基質が発する生体透過性に富むルミネッセンスを利用してイメージングに応用できる。具体的には、ホタルルシフェラーゼを恒常的に発現する乳がん細胞をヌードマウスの左心室に注射して、経時的に生物発光イメージングをおこなうと、骨転移が形成される過程が観察できた(図 1)。
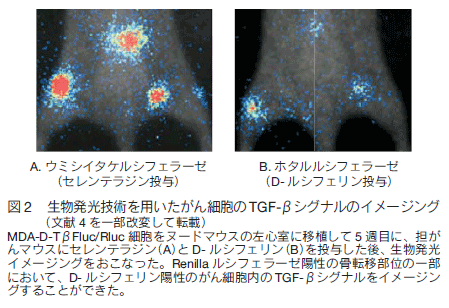
さらに、ルシフェラーゼの発現をシグナル特異的プロモーターで制御するシステムを用いることで、細胞動態のみならず、細胞内シグナル(転写活性)をイメージングすることも可能である。例えば、transforming growth factor(TGF)-βのシグナル応答性プロモーター CAGA 配列の下流にホタルルシフェラーゼ遺伝子を繋いだレポーター遺伝子と CMV プロモーターの下流にウミシイタケルシフェラーゼ遺伝子を繋いだコントロール遺伝子の両者を遺伝子導入した MDA-D-TβFluc/Rluc 細胞を作製し、ヌードマウスの左心室に注射して移植 4 週後にウミシイタケルシフェラーゼの基質のセレンテラジンを注射して生物発光イメージングをおこなうと、脊椎、骨盤や四肢に骨転移している像を観察でき(図 2A)、 D- ルシフェリンを注射してイメージングをおこなうと、がん細胞内の TGF-βシグナルをイメージングすることができた(図 2B)。我々は、本法を用いて、乳がん骨転移部位において、TGF-βと同様に bone morphogenetic protein (BMP)が重要な働きを担い、それらのシグナルを阻害することで骨転移を抑制できることを明らかにした 4)。
また、Bimolecular Fluorescence Complementation (BiFC)法を用いると、タンパク間相互作用やユビキチン化などタンパク質の翻訳後修飾をイメージングすることができる。具体的には、N 末側と C 末側に 2 分割したルシフェラーゼにそれぞれタンパク質を繋いだ融合タンパク質を用いると、2 つのタンパク質が結合する場合にルシフェラーゼが再構成され、その活性が観察できる 5)。
▲ページのトップへ
2. 蛍光イメージングを利用したがん血管新生とプロテアーゼ活性のイメージング
近年、分子生物学や有機化学を駆使した蛍光タンパク質プローブや蛍光有機小分子の作製技術の進歩と共焦点レーザー顕微鏡や 2 光子励起顕微鏡などの蛍光検出器機の性能の向上などにより、蛍光イメージングを利用して、動物が生きた状態で、さまざまな生命現象をイメージングできるようになった。蛍光イメージングは前述の生物発光イメージングに比べ、基質の投与を必要とせず、空間分解能、時間分解能、多元性に優れているが、自家蛍光や散乱などの光学特性の問題から、生体深部観察には不向きであると考えられてきた。しかし、近年、近赤外領域の長波長蛍光有機小分子の蛍光プローブの開発が進み、自家蛍光の低い環境で、より深部まで観察が可能になり、生体での蛍光イメージングの欠点が解決されつつある。
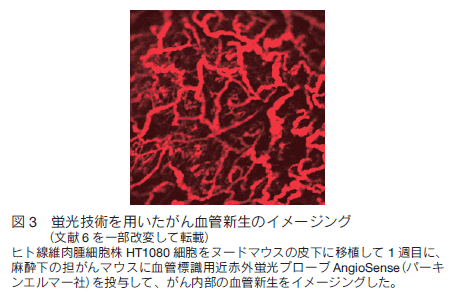
がんは自らの酸素や栄養補給のために血管新生促進因子を分泌して血管増生を促し、さらにその新生血管を介して遠隔臓器に転移する。そのため、血管新生阻害薬が、がん分子標的治療薬として注目されている。蛍光イメージングを用いると、従来の病理組織学的手法では不可能だった同一個体の経時的な血管イメージングをおこなうことが可能で、例えば、血管新生阻害剤投与前後でその評価をおこなうことができる 6)。我々は、血管イメージング用近赤外蛍光有機小分子を用いて、ヒトがん細胞を移植したマウスにおけるがんの血管新生を経時的にイメージングした(図 3)。
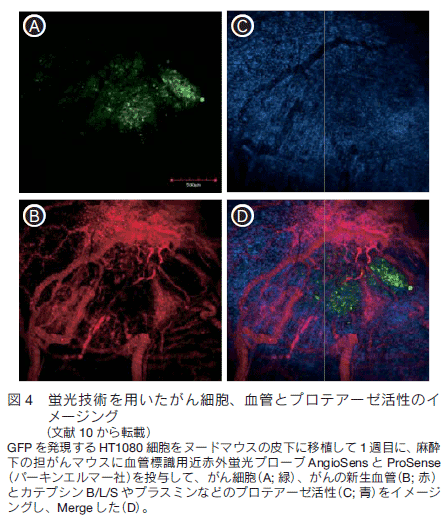
一方、蛍光クエンチング効果を利用したプロテアーゼ活性用近赤外蛍光プローブを用いることで、細胞や動物が生きている状態で、プロテアーゼ活性をイメージングすることができる。さらに、緑色蛍光タンパク質(green fluorescent protein; GFP)を発現するがん細胞や AngioSense などと組み合わせることで、例えば、がん(図 4A)、新生血管(図 4B)とカテプシン B, L, S やプラスミン等のプロテアーゼ活性(図 4C)を同時(図 4D; Merge 画像)に解析することが可能である。がん転移やがん血管新生においては、がん細胞や血管内皮細胞が周囲組織に浸潤する必要があり、その場合には組織を溶解するプロテアーゼが重要な働きを担っている。よって、がん悪性化のメカニズムの解明や分子標的薬剤の開発のために、血管やプロテアーゼ活性をイメージングする手法が大きな力を発揮する。
▲ページのトップへ
おわりに
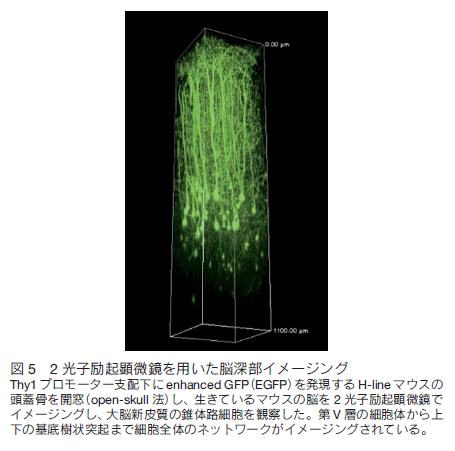
以上、我々のデータを中心に、光技術を駆使したがんイメージング研究のトピックスをまとめた。今後、さらに光プローブと光検出機器の技術革新が加われば、光イメージングはがん研究のみならず広くライフサイエンス分野での活躍が期待される。但し、深部観察に関しては課題も多く、それぞれの実験系に応じた工夫や新たな検出系の開発が必要である。特に 2 光子励起顕微鏡を用いると、サブミクロンレベルの解析が可能であり、近年、さまざまな研究分野において 2 光子励起顕微鏡が活用され、例えば、リンパ組織における免疫細胞の相互作用 7) や骨における破骨細胞前駆細胞の動態 8) などの報告がなされている。我々は、マウスが生きた状態で大脳新皮質の錐体路細胞をイメージングし、表面から約 1 mm の深さで錐体路細胞の第V層細胞体と基底樹状突起を観察することに成功している(図 5)。
▲ページのトップへ
| 著者プロフィール |
|
| 氏名 |
今村 健志 (Takeshi Imamura)
|
| 所属 |
愛媛大学大学院医学系研究科 分子病態医学分野 |
| 住所 |
〒791-0295 愛媛県東温市志津川
|
| E-mail |
timamura-ind@umin.ac.jp |
| コメント |
鹿児島大学医学部卒業後、整形外科の臨床研修を行いましたが、整形外科専門医取得後に心機一転、スウェーデン王国ルードヴィッヒ癌研究所に留学し、基礎研究の道に進みました。
帰国後は、財団法人癌研究会癌研究所(現在の公益財団法人がん研究会がん研究所)で 15 年ほどシグナル伝達とがん・骨代謝の研究を行い、2010 年から現職です。この 10 年ほどは、バイオイメージングを駆使したがん研究に焦点を絞って頑張っています。
研究室HP: http://www.m.ehime-u.ac.jp/school/imaging/
|
| |
| 氏名 |
疋田 温彦 (Atsuhiko Hikita)
|
| 所属 |
愛媛大学大学院医学系研究科 分子病態医学分野 |
| 住所 |
〒791-0295 愛媛県東温市志津川
|
| E-mail |
ahikita@m.ehime-u.ac.jp |
| コメント |
ニッチとは何か、少しずつでも明らかにできればと考えています。
|
| |
| 氏名 |
本蔵 直樹 (Naoki Honkura)
|
| 所属 |
愛媛大学大学院医学系研究科 分子病態医学分野 |
| 住所 |
〒791-0295 愛媛県東温市志津川
|
| E-mail |
honkura@gmail.com |
| コメント |
見ることの偉大さに衝撃を受け、非線形光学を駆使した画像化技術および操作することの素晴らしさから光操作の技術発展に貢献できればと思って研究しています。
|
|
| 氏名 |
大嶋 佑介 (Yusuke Oshima)
|
| 所属 |
愛媛大学大学院医学系研究科 分子病態医学分野
愛媛大学 医学部付属病院先端医療創生センター |
| 住所 |
〒791-0295 愛媛県東温市志津川
|
| E-mail |
y-oshima@m.ehime-u.ac.jp |
| コメント |
青山学院大学大学院博士後期課程修了、在学中は日本学術振興会特別研究員、理化学研究所研修生として、ラマン分光法による生体分子計測の研究に従事。基礎生物学研究所研究員を経て、現職。非線形光学・ラマンによるプローブレスイメージングの技術開発と臨床応用をテーマとして日々研究に取り組んでいます。
|
▲ページのトップへ
|