|
| トップページ > 「蛍光生物学」の最前線 6-1 |
 |
|||||||||||||||||||||
「蛍光生物学」の最前線 6-1
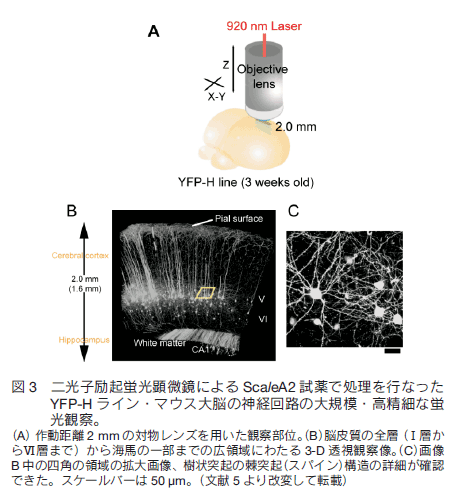
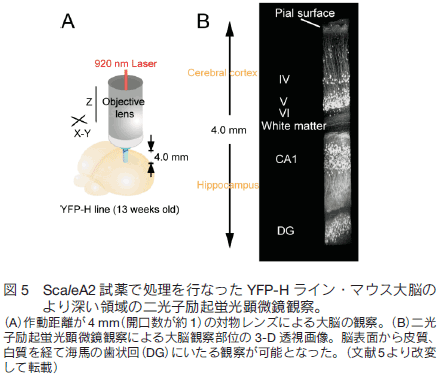
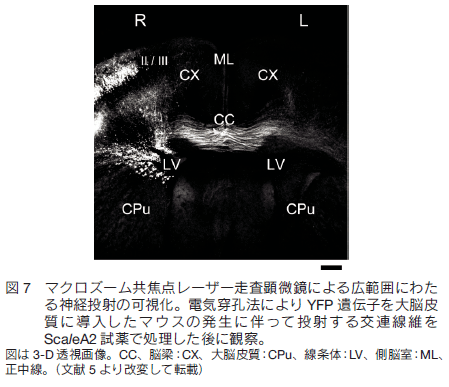
1.はじめに 現代の形質転換技術や遺伝子導入技術を活用すれば、マウスなど実験哺乳類動物の様々な構造を選択的に蛍光タンパク質の蛍光で標識することができる。標識した組織サンプルをホルマリンで固定し、蛍光を指標に構造を可視化し 3 次元的に再構築する技術に対する興味が増大している。特に神経科学の分野で、マウス脳内の神経回路を機能的にマップする試みは世界的規模で行われており、神経細胞同士の連絡(コネクション)を網羅的に調べることから「コネクトミクス(プロジェクト)」と呼ばれている 1-3)。シナプスを含め神経回路の機能的構造を高精細に観察するには、脳組織の切片の蛍光画像を何枚も連続的に取得し、それらを積み上げていくことが必要である。切片の作り方には 2 通りある。機械的に切るか光学的に切るかである。機械的方法を採用すると、脳表面からの深さにかかわらず高精細な蛍光観察が可能であるが、切片作製に大変な労力を伴う、画像からの 3 次元再構築が大変に難しいという問題がつきまとう。一方、光学的方法を採用すると、光が脳組織内部で散乱するため、観察部位が脳表面から深くなるにつれ画像が暗くぼやけるという問題がつきまとう。一般的に、光学的切片を目指す蛍光イメージング観察においては、生体試料の表面から深部に向かってどこまで蛍光を高精細に観察できるかが課題で、観察深度限界を指標に議論される。脳組織を材料にすると、通常の一光子励起顕微鏡で 0.15 mm 、二光子励起顕微鏡でも 0.7 mm 程度が一般的な限界と言われている。マウスの脳の場合、表層の皮質の厚さが約 1 mm ある。皮質とそれよりも脳の深部にある海馬や視床との神経連絡などを観察するには、数 mm まで観察深度限界を広げる必要がある。 2.組織透明化技術 Scale の開発 我々は尿素をベースに組織透明化試薬の開発に着手した。尿素で処理をすると Western Blotting に用いる PVDF 膜などいろいろな材料が水になじみやすくなること、さらに、高濃度の尿素の存在下でも蛍光タンパク質の蛍光の明るさがまったく減弱しないことに注目した。最終的に、尿素を含む水溶性にグリセロールと界面活性剤を添加した ScaleA2 試薬を完成させた 5)。組成は、4M 尿素、10%グリセロール、0.1% Triton X と、極めてシンプルである。これら 3 つの溶質を水で溶解することが重要である。PBS のような緩衝液を溶媒として使ってはならない。特に塩が混入すると、組織透明化プロセスがブロックされることがわかっている。  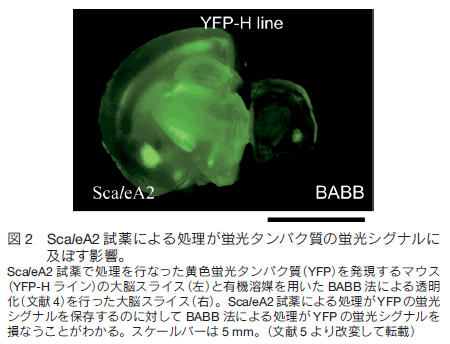 3.脳を切らずに、神経の回路や投射を可視化するYFP-H ラインの脳を使って、神経回路の大規模・高精細な蛍光観察を試みた。マウス全身をホルマリン固定し、取り出した全脳を ScaleA2 溶液に 1 週間浸漬した。二光子励起蛍光顕微鏡を使って、作動距離が 2 mm の対物レンズを脳表面に置いて観察したところ、脳皮質の全層(Ⅰ層からⅥ 層まで)、さらに白質を超えて海馬の一部まで一挙に観察することができた。また、各蛍光画像における空間分解能は高く、樹状突起の棘突起(スパイン)構造の詳細が確認できた(図 3)。二光子励起蛍光顕微鏡を使った理由は、一般的にこの観察方法における観察深度限界が一光子励起蛍光顕微鏡の限界に比べて大きいことにある。しかし、同様の深部(~2 mm)蛍光観察が、通常の一光子励起蛍光顕微鏡を使ってもできることがわかった(図 4)。 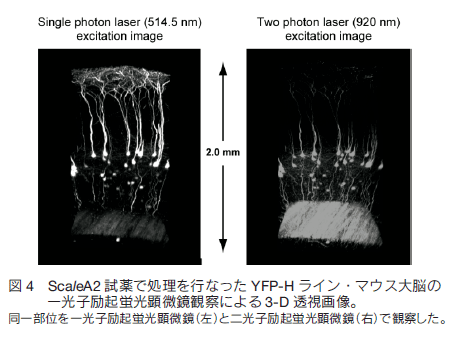 ScaleA2 試薬で透明になった生体試料の観察深度限界は、もはや対物レンズの作動距離に依存する。こうした事実を踏まえて、開口数を高く維持しながら対物レンズの作動距離を長くする開発を光学顕微鏡メーカーに依頼した。観察深度限界を飛躍的に拡大することを目指したのである。たとえば作動距離が 4 mm (開口数が約 1 )の対物レンズが出来てきて、これを使った観察を二光子励起蛍光顕微鏡で行った。YFP-H ラインの全脳に適用し、脳表面から、皮質、白質を経て、さらに海馬の歯状回にいたる神経回路を可視化し 3 次元構築することができた(図 5)。また、こうした観察を水平方向に広げ、タイリングソフトウエアを使ってつなぎ合わせることで、YFP-H ラインの海馬のほぼ全体に渡って神経回路を 3 次元構築することができた(図 6)。 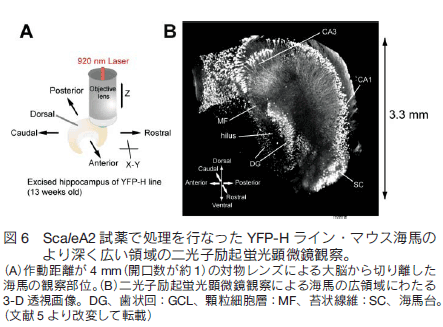
 4. 3 次元空間で、神経幹細胞と血管との相互作用を解析神経幹細胞の可視化のために、従来は BrdU 注入による S 期特異的パルスラベルが一般的に行われてきた。一方我々は、細胞周期の進行を指標にして神経新生の可視化を行っている。特にマウス脳の海馬における神経新生に注目している。すなわち、細胞周期蛍光プローブ Fucci 7 の S/G2/M 期マーカー(緑色)を発現する形質転換マウスを用いると、細胞分裂に向かう神経幹細胞の核を海馬組織内に見出すことができる。さらに、還流固定に際して Texas Red conjugated lectin を使用することで、マウスの全身の血管を赤色の蛍光で標識することができる。上記形質転換マウスに全身血管標識を施し、ホルマリン固定した脳を ScaleA2 試薬で透明化した後、緑と赤の 2 色蛍光観察を行った。すると海馬の歯状回において神経幹細胞の核が血管に寄り添う様子を観察することができた(図 8)。さらに我々が独自に開発したソフトウエア「RINZO」5) を使って、3 次元空間における最短距離の自動測定計算を行ったところ、増殖する神経幹細胞の核が他の神経核に比べて有意に血管に近いことを証明することができた。おそらく、神経新生に必要な栄養が血管から供給されることに関連する現象と考えられる。 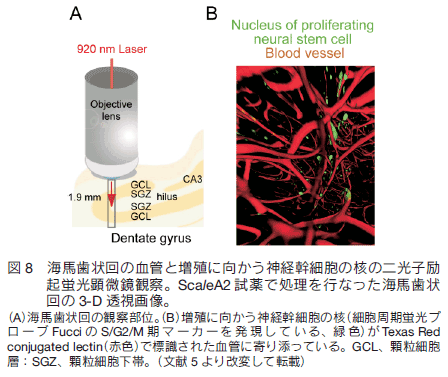 5. 木も森も見る技術蛍光タンパク質でいろいろな生物構造を蛍光標識する技術と連携して、Scale 試薬による生体試料の透明化技術は、大規模かつ高精細な 3 次元構造の再構築プロジェクトに著しく貢献することが期待される。従来の光学顕微鏡や電子顕微鏡による網羅的観察は、1 mm 以内のスケールで詳細に行われる(木を見て森を見ず)。一方、 MRI や PET などによる観察は、個体丸ごとのスケールで粗く行われる(森を見て木を見ず)。 Scale 技術は、これら 2 つの可視化技術の間にあるギャップを埋める役割を果たすと期待される(木も森も見る)。たとえば、最近流行りのチャネル・ロドプシン。この遺伝子をウイルスベクターなどを使ってネズミの脳の特定領域に導入し、光ファイバーで照射して、遺伝子導入された神経を発火させる実験が広く行われている。光照射がもたらす行動を解析するわけであるが、実際にどういう神経がチャネル・ロドプシンを発現しているのかをマップしておく必要がある。幸いにもチャネル・ロドプシンには YFP が付与されているので、動物実験が終了した段階で脳を固定かつ透明化して簡単な蛍光 3 次元再構築(必ずしも高精細である必要はない)を行うことを勧めたい。 6. Scale 技術の幅広く柔軟な発展 Scale 技術は脳以外の器官、組織にも適用可能である。マウス以外の哺乳類実験動物、例えばラット、ブタ、サルの試料にも適用可能である。ヒトの病理標本に適用すれば、いろいろな標識技術と組み合わせて、標本内を隈なく観察して病変を確実に見つけ出す技術に発展することが期待される。
|
|||||||||||||||||||||
| Copyright(c) 1996-2012 DOJINDO LABORATORIES, ALL Rights Reserved. |