|
| トップページ > 「蛍光生物学」の最前線 5-2 |
 |
|||||||||||||||||||||||||||||
「蛍光生物学」の最前線 5-2
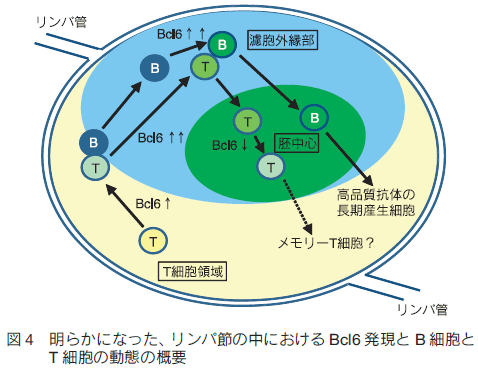
はじめに病原体などに感染すると我々の体内では免疫システムが活性化し、抗体が産生されて抗原が体内から排除される。また、一度目の免疫反応中に活性化したリンパ球の一部が長寿命性を獲得して次の感染に備えているため、二度目以降の抗原侵入時には以前よりも速やかに免疫反応が起きる。これは「免疫記憶」と呼ばれワクチン療法などに応用されているが、その形成メカニズムは未だ不明な点が多い。筆者らの研究グループでは、 B 細胞とその反応を補助する濾胞ヘルパー T 細胞に注目し、抗体産生や免疫記憶形成メカニズムの解明を目指して研究を行ってきた。蛍光レポーターマウスの作製とイメージング、その他の免疫学的手法を組み合わせた解析を行うことで、免疫応答中の B 細胞分化制御因子の発現により B 細胞の移動が制御されその後の B 細胞応答に至ることが明らかになったため1) 、これらを実験手法と共に解説する。 1.免疫反応初期のリンパ球の動き抗原が侵入すると、二次リンパ組織であるリンパ節や脾臓で B 細胞やヘルパー T 細胞などが活性化し胚中心と呼ばれる微小構造が形成される。この中では胚中心反応が進行し、高性能な抗体の産生や免疫記憶の形成が行われる。まず、免疫反応が開始されてから胚中心が形成されるまでの B 細胞とヘルパー T 細胞の動きについて概説する。抗原侵入前、未感作の状態ではナイーブ B 細胞とナイーブ T 細胞はそれぞれ濾胞と T 細胞領域に分かれて存在している(図 1A)。抗原が侵入すると、抗原特異的受容体を持つ細胞がそれぞれの領域内で活性化して濾胞・T 細胞領域の境界に移動し、 B 細胞と T 細胞の相互作用が観察される2,3) (図 1B)。この後、それぞれの細胞はさらに活性化され、濾胞外縁部や濾胞間領域で観察されるようになる4-7) (図 1C)。この際、一部の細胞は濾胞の中心部分にも観察される。最終的には濾胞内に胚中心が形成され、この中には胚中心 B 細胞と濾胞ヘルパー T 細胞が見られる(図 1D)。また、濾胞ヘルパー T 細胞は胚中心だけではなくその周りの濾胞外縁部にも観察される。胚中心 B 細胞と濾胞ヘルパー T 細胞の分化には転写因子である B cell lymphoma 6 (Bcl6)が必要であるが、この胚中心形成過程のいつどこで Bcl6 が発現するのか、また Bcl6 発現により B 細胞の動きが制御されるかどうかは不明であった。 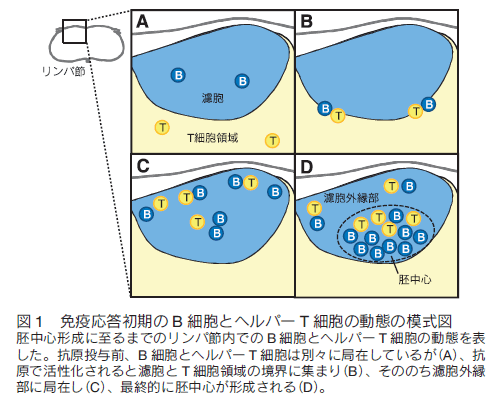 2. Bcl6 タンパク質レポーターマウスの作製 Bcl6 は転写後も発現制御を受けるため、mRNA 発現とタンパク質発現がしばしば一致しない。さらに Bcl6 を検出するための良い抗体も最近まで存在しなかったことから、その詳細な発現動態は不明であった。これを解決するために筆者らは Bcl6 タンパク質のレポーターマウス( Bcl6yfp マウス)を作製した。このマウスは、野生型 Bcl6 の代わりに Bcl6 の N 末端に黄色蛍光タンパク質(YFP)を融合させた YFP-Bcl6 を発現するため、 Bcl6 タンパク質の発現を YFP シグナルにより追跡することが可能である(図 2A)。また、 YFP-Bcl6 アリルをホモで持つ Bcl6yfp/yfp マウスを解析したところ Bcl6 欠損マウスよりマイルドではあるが B 細胞応答に異常がみられた。これは YFP-Bcl6 の機能が野生型 Bcl6 と比べて減弱しているためであると考えられる。このため、 Bcl6yfp/+ マウスを Bcl6 レポーターマウスとして使用し、 Bcl6yfp/yfp マウスを Bcl6 機能減弱マウスとしてその後の解析に使用した。 Bcl6yfp/+ マウスにおける YFP-Bcl6 の発現量は野生型 Bcl6 タンパク質の発現量とほぼ同じであり、顕微鏡での観察に適した蛍光強度が得られなかったため、顕微鏡で YFP-Bcl6 を検出する際は抗 GFP 抗体を用いてシグナルの増幅を行っている。 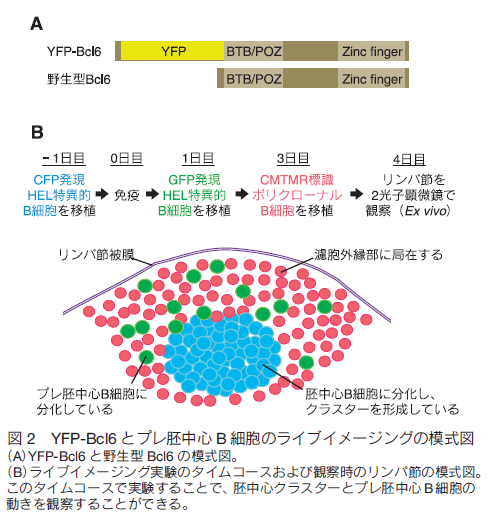
3. Bcl6 タンパク質レポーターマウスによる Bcl6 発現の追跡免疫反応中の B 細胞、ヘルパー T 細胞における Bcl6 発現を解析するため、このマウスと抗原特異的BCRあるいは抗原特異的 TCR を発現するトランスジェニックマウスを交配させ、Bcl6yfp/+ 抗原特異的 B 細胞あるいは Bcl6yfp/+ 抗原特異的ヘルパー T 細胞を得た。これらを B6 マウスに移植・皮下免疫してリンパ節内での反応をフローサイトメーターと組織染色により解析したところ、 B 細胞での Bcl6 発現は胚中心が形成される前のプレ胚中心 B 細胞の段階(図 1Cにあたる)で始まっており、この高い Bcl6 発現は胚中心 B 細胞でも維持されていた。ヘルパー T 細胞での発現はそれよりも早く、T 細胞領域にいる段階で Bcl6 発現が始まり、 B 細胞との相互作用を経て発現の増強が見られた。意外なことに、分化後の濾胞ヘルパー T 細胞では胚中心の成熟に伴って Bcl6 発現の低下がみられた。この Bcl6 低発現濾胞ヘルパー T 細胞では長寿命性の獲得を強く示唆する変化が起きており、メモリー T 細胞への分化過程にある可能性が考えられる。 4. プレ胚中心 B 細胞での Bcl6 発現は胚中心への局在を制御する組織学的な解析を行ったところ、 Bcl6 機能減弱マウスである Bcl6yfp/yfp マウス由来の B 細胞は免疫後に活性化して濾胞外縁部へ局在するものの、胚中心 B 細胞へほとんど分化せず胚中心の形成が著しく阻害されていた。そこで、 B 細胞における Bcl6 発現が細胞移動に与える影響を明らかにするために、野生型 B 細胞と Bcl6yfp/yfp B 細胞の免疫後の濾胞内での挙動を二光子ライブイメージングにより比較した。
4.1 胚中心とプレ胚中心 B 細胞のイメージング 胚中心とその周りの濾胞外縁部の間には膜など物理的な障壁は存在しておらず、胚中心 B 細胞や濾胞 T 細胞などが誘引物質により濾胞中心へ引き寄せられて(あるいは外縁部からはじき出されて)できた集合体であると考えられている。この為、胚中心は胚中心 B 細胞とその周りの濾胞 B 細胞を観察することで区別できる8) 。実験方法の概略図を図 2B に示した。まず、シアン蛍光タンパク質(CFP)を恒常的に発現するβ-actin-CFP マウスと、モデル抗原であるニワトリ卵白リゾチーム(HEL)に対する特異的 BCR を発現する MD4 マウスを交配させて、CFP を発現する MD4 マウスを作出した。このマウスから単離した CFP 発現 HEL 特異的 B 細胞を B6 マウスに移植、免疫すると、免疫後 4 日目には CFP 発現 B 細胞の多くが胚中心 B 細胞となりリンパ節濾胞内に胚中心クラスターが観察される。なお、反応の過程で B 細胞が活発に増殖するため、CFSE の様な生細胞蛍光染色色素の取り込みではなく、蛍光遺伝子を B 細胞に組み込むことで細胞を蛍光標識している。また、観察前日に B6 マウス由来の B 細胞をローダミン系生細胞蛍光色素である CMTMR で標識して移植した。こちらは HEL 抗原特異的 B 細胞がほとんど含まれないため活発な増殖や胚中心 B 細胞への分化は見られず、大部分が CMTMR 標識濾胞 B 細胞として胚中心の周りである濾胞外縁部に観察される。 4.2 プレ胚中心 B 細胞のトラッキングこの実験系を用いて 1 時間のライブイメージングを Ex vivo で行い、プレ胚中心 B 細胞の濾胞内での挙動を観察した。さらに、観察画像データを基に解析ソフト Imaris の Surface 作成機能とトラッキング機能を組み合わせて胚中心表面の 3D レンダリングとプレ胚中心 B 細胞のトラッキングを行い、濾胞外縁部にいたプレ胚中心 B 細胞が胚中心に侵入するかを解析した9) 。図 3 に例を示すように、胚中心 B 細胞クラスターの CFP シグナルを基に胚中心と濾胞外縁部の境界面を経時的に 3D レンダリングし境界面に接触した GFP 発現プレ胚中心 B 細胞の行方を追跡したところ、 Bcl6 機能減弱型の方が濾胞外縁部から胚中心内に移動する確率が低く、胚中心への侵入が抑制されていることが明らかになった。これらのことから、 Bcl6 発現により分化だけでなく B 細胞の移動様式も制御され、胚中心形成に至ることが明らかになった(図 4)。 5.おわりにBcl6 の新規レポーターマウスをフローサイトメトリー法や組織染色、二光子顕微鏡でのライブイメージングを組み合わせて解析することで、胚中心形成時の B 細胞分化と細胞移動の関係が明らかになった。同様のことは他のリンパ球分化でも起きている可能性が考えられる。例えば、濾胞ヘルパー T 細胞では分化後に Bcl6 発現低下が起きていたが、この Bcl6 低発現濾胞ヘルパーT細胞では複数の局在制御因子の発現変化がみられており、局在を濾胞から T 細胞領域や血中へと変えてメモリー T 細胞として二度目以降の反応に備えている可能性が考えられる。今後、これらのイメージングを行うことで、免疫記憶形成メカニズムのさらなる解明に貢献していきたい。
|
|||||||||||||||||||||||||||||
| Copyright(c) 1996-2012 DOJINDO LABORATORIES, ALL Rights Reserved. |