 |
| トップページ > 有機−無機ハイブリッド人工細胞膜「セラソーム」の開発と遺伝子キャリアーとしての応用 |
 |
||||||||||||||||||||||||
有機−無機ハイブリッド人工細胞膜「セラソーム」の開発と遺伝子キャリアーとしての応用
|
||||||||||||||||||||||||
 |
田原 圭志朗 (Keishiro Tahara) 奈良先端科学技術大学院大学 物質創成科学研究科 |
 |
菊池 純一
(Jun-ichi Kikuchi) 奈良先端科学技術大学院大学 物質創成科学研究科 |
【要約】
Since the discovery of lipofection, cationic lipids have been widely used as transfecting agents in gene delivery. However, the cationic lipid-forming liposomes easily undergo DNA-induced fusion to produce larger particles that are not suitable for transfection. Because gene delivery methods using cationic lipids are considered as a valuable alternative to viral transfection, the transfection efficiency has to be improved to benefit fully from their advantages. We have recently developed a ceramic-coated liposome, cerasome, to overcome fusibility of liposome. Cerasome is a viral size-particle with liposomal bilayer and silicate surface. This review describes the concept, characterization and function of the cerasome. Furthermore, we described its remarkable transfection performance as a gene carrier.
キーワード:
有機−無機ハイブリッド、セラソーム、遺伝子導入、非ウイルスベクター
1.はじめに
細胞への遺伝子導入は、生命科学における基幹技術であり、遺伝子治療や再生医療など様々な応用が期待されている1)。細胞への遺伝子導入では、一般にベクターと呼ばれる遺伝子キャリアーが用いられており、ウイルスベクターと非ウイルスベクターの二つに大別される。ウイルスベクターは、ウイルスの高い感染能力を利用するため、非ウイルスベクターと比較して極めて高い導入効率を達成できる。しかしながら、DNA サイズの限界に加え、ウイルスの潜在的な危険性を排除できないという問題がある 2) 。このため、高い発現効率と安全性を兼ね備えた遺伝子導入の実現を目指し、リポソーム、カチオン性ポリマー、デンドリマー、ポリマーミセルなど様々な材料をベースとした非ウイルスベクターの開発が盛んに行われてきた 3-6) 。細胞への遺伝子導入には、細胞への取り込み、エンドソームから細胞質への脱出、核への移行、ベクターからの解離と転写因子による認識など多くの過程を経る必要があるため、非ウイルスベクターにはこれらの障壁を乗り越えるための高次な機能性が要求される。高機能ベクターを開発する際、複数の機能物質あるいはそれらの構成要素を組み合わせて複合機能を発揮させる、いわゆるハイブリッド化の手法が有効であると考えられる。ハイブリッド型ベクターの設計指針として、大きく分けて二つの選択肢が挙げられる。一つは、ベースとなる材料ベクターに様々な機能素子を組み込む手法であり、もう一つは、ベクター自体を他の素材とハイブリッド化させることで新材料を創製する手法である。前者の手法により、 pH、温度、酸化還元、酵素、カルシウムイオン濃度などの細胞内環境や、光や熱などの外部刺激に対する応答性を付与したベクターが開発されており、幾重にも及ぶ細胞障壁をクリアするための機能設計の研究が進められている 7-9) 。一方、後者の手法は、汎用のベクター材料の欠点を克服し、既存の材料にはない新たなバイオ機能を創成する上で重要なアプローチである。カチオン性脂質から調製されるリポソームは最も代表的な非ウイルスベクターの一つであるが 6) 、われわれは後者の立場から、従来のリポソームが抱える脆弱性の問題を克服するために、有機-無機ハイブリッドの概念を取り入れて人工細胞膜「セラソーム」を開発した 10) 。本稿では、セラソームの設計コンセプト、構造、物性および遺伝子ベクターとしての応用について紹介したい。
2. 有機−無機ハイブリッド人工細胞膜 「セラソーム」
細胞膜の主要構成成分であるリン脂質などの生体脂質を水中に分散して形成される脂質小胞体はリポソームと呼ばれ、ドラッグキャリアーあるいは細胞膜モデルとして、医学・薬学・生物学・工学などの分野で幅広く研究がなされてきている 11-13) 。リポソームは、脂質分子間の非共有結合的な自己集合に基づいて形成されるために、膜構造の安定性はそれほど高くない。一方、有機物と無機物の構造特性と機能を融合した有機-無機ハイブリッドの開発が近年盛んに行われている 14-16) 。このような背景のもと、リポソームに広範な材料化学分野で利用できる構造安定性と機能性を付与するため、リポソーム表面をセラミックス様の無機酸化物骨格で覆った有機−無機ハイブリッド人工細胞膜「セラソーム」を開発した。
2.1 セラソームの設計と作製法
有機物の分子集合体のナノ構造特性をより精密に制御するには、単位構造の緻密な分子設計が有効となる。リポソーム表面に無機酸化物骨格を導入するにあたり、サブナノレベルで無機層の厚みを制御するため、頭部にアルコキシシリル基をもつ二本鎖型脂質を設計した。また、われわれが以前開発したペプチド脂質が他の二分子膜形成脂質に比べて会合安定性に優れていることを鑑み 17-19) 、脂質頭部と疎水性二本鎖の間に膜内水素結合帯を形成しうるアミド結合や尿素結合を導入した 20-22) 。セラソーム形成脂質の一例を Fig. 1に示す。
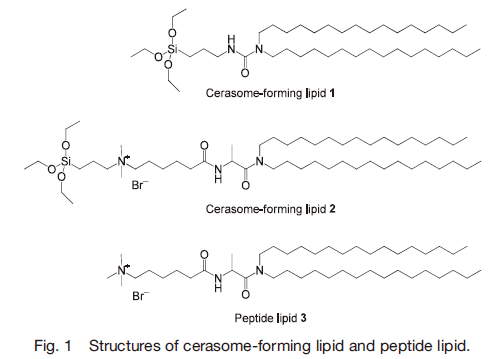
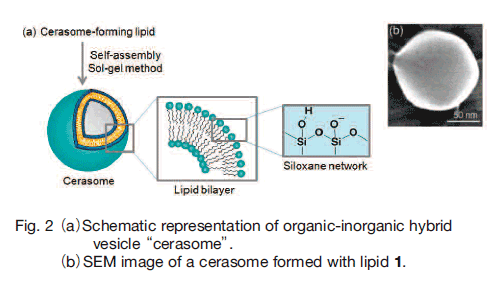
これらのセラソーム形成脂質を水に分散することで自己組織的にセラソームが形成される。まず脂質頭部のアルコキシシリル基の加水分解が進行し、その結果生成する両親媒性分子が自己集合して二分子膜ベシクル構造が形成される。その後、脂質頭部のシラノール基同士が自己縮合を行い、Si-O-Si 結合からなるシロキサンネットワークが膜表面に発達することでセラソームの形成が完了する(Fig. 2a)。
脂質 1 の場合、脂質頭部をエタノール中で加水分解した後に水中に注入するエタノールインジェクション法によりセラソームが得られる(Fig. 2b)。脂質 2 の場合、ボルテックスミキサーによる機械的振とうで水中に分散させると直径 200 nm 程度の多重層セラソームが得られるのに対し、ひきつづき超音波処理を行うことによって直径が 50 nm 程度の一枚膜ベシクル構造に変換される 21) 。さらに作製法を工夫することで、数μm 細胞サイズのジャイアントベシクルも作製することも可能である。このようにセラソームは従来のベシクルと同様に、分散方法によりその粒径を制御することもできる。
2.2 セラソームの物性と機能化
セラソームの最大の特徴は、従来型のリポソームに比べて驚異的な構造安定性を有する点にある。セラソームは水中で少なくとも数ヶ月以上にわたり安定な分散状態を保つことができる。また、セラソームは緩衝剤の添加や生理食塩水中でも安定に存在し、オートクレーブ処理によってもその粒径は変化しない。さらに、セラソームの構造安定性は、界面活性剤に対する耐性実験から定量的に評価できる。ミセル形成能をもつ非イオン性の界面活性剤である TritonX-100 (TX-100) の添加は、リポソームの膜構造を崩壊することが知られている。例えば、代表的なリン脂質であるジミリストイルホスファチジルコリンのリポソームは、脂質に対して数等量の TX-100 を添加するだけでベシクル構造が完全に崩壊する。これに対して、脂質 1 が形成するセラソームは 30 等量以上の TX-100 存在下でもその構造は保持される 20) 。
セラソームは、優れた構造安定性を示す一方で、リポソームと同様に細胞膜モデルとしての特性を保持しており、それは相転移挙動に顕著に反映される。一般に、脂質二分子膜は、脂質の炭化水素の運動が凍結されたいわゆるゲル状態から、炭化水素が融解した液晶状態への相転移を示し、相転移温度は脂質の分子構造に大きく依存する。水素結合帯形成部位を導入したセラソーム形成脂質では、以前われわれが開発したペプチド脂質 17-19) と同様に転移温度は主にアルキル鎖長のみに依存するため、所望の相転移温度を示すセラソームの設計が容易である。例えば、脂質 1 が形成するセラソームの相転移温度は 29℃ であり、脂質 1 の頭部のトリエトキシシリル基をトリメチルアンモニウム基に置換した脂質二分子膜の相転移温度と等しい値が示差走査熱量分析(DSC)から得られている 20) 。さらに、大過剰の界面活性剤存在下においても、セラソームのゲル-液晶相転移挙動は保持されることも明らかになっている。すなわち、セラソームは極めて高い構造安定性を保ちながら、その内部は生体膜としての特徴を示す従来にない機能性粒子であると言える。
セラソームの水中での荷電状態はゼータ電位の pH 依存性から見積もることができる 20, 23) 。例えば、脂質 2 から形成されるセラソームの等電点は 12 付近であり、中性領域ではカチオン性コロイド粒子として振舞うことがわかった。脂質の分子設計によってセラソームの表面電荷を自在に制御することが可能である。
セラソームの高い構造安定性と表面電荷を利用することで、基板上への三次元組織化、いわゆる人工多細胞組織体の構築が可能となる 24) 。例えば、アニオン性セラソームとカチオン性高分子電解質との交互積層により、基板上にセラソームを敷き詰めながら三次元的に積み上げることができる。一方、従来型のリポソームを用いて同様な交互積層を行った場合には、ベシクル構造を保ったまま積層することはできず、リポソームは平面二分子膜に形態変化を起こしてしまう。また、アニオン性セラソームとカチオン性セラソームとの交互積層により、多種類のセラソームから様々な階層構造体を任意に作製することもできる。
セラソームのもう一つの特徴として、表面に多数のシラノール基が存在しているため、様々な官能基や無機酸化物で修飾できることが挙げられる。セラソームを作製する際に、3- アミノプロピルエトキシシランを共存させると、表面にアミノ基を提示したセラソームが調製できる 25) 。また、類似の手法を用いれば、セラソーム表面に光触媒機能をもつ二酸化チタン層を導入できる 26)。
従来のリポソームに比べ構造安定性が著しく向上したセラソームは、リポソームの材料設計上の制約を乗り越え、これまでにない生体機能材料としての応用が期待される。セラソームの利用法の一つとして、セラソームのカプセル化能を利用したドラッグキャリアーとしての応用が考えられる。脂質 2 から形成されるセラソームは界面活性剤の臭化セチルトリメチルアンモニウム(CTAB)あるいは血清存在下においても、水溶性高分子の薬剤モデルを安定に封入することができる27)。このような構造安定性に加え、セラソームのサイズを厳密に制御することで、がん治療のためのドラッグデリバリーシステムに展開できよう。セラソームの表面修飾を利用すれば、標的指向性を付与することも可能である。また、セラソーム表面のシラノール基は、骨や歯の主成分であるヒドロキシアパタイトとの親和性が高いので、生体の有機-無機複合体の損傷部位を治療するためのナノインターフェース型ドラッグキャリアーとしての応用も考えられる。さらに、酵素をセラソームの内水相に封入あるいは、セラソームの表面に固定化することで、ナノサイズのバイオリアクターが作製でき、これを交互積層で基板上に組織化することで多段階の物質変換を連続的に行えるナノリアクターの構成も可能である。
2.3 金属被覆人工細胞膜「メタロソーム」の開発
近年、磁性金属微粒子をバイオ・医療分野へ応用する研究が盛んに行われている。薬物を固定化した磁性ナノ粒子を磁場誘導して腫瘍部位に集積させるドラッグデリバリー、がんの磁気温熱療法(ハイパーサーミア)、磁気共鳴イメージング法(MRI)用造影剤など、磁性ナノ粒子の優れた磁気特性を生かした技術開発が進められているが、脂質二分子膜ベシクルと磁性金属材料の性質を融合することで新たなバイオ機能が創成できると期待される。われわれは、両者のインターフェースとしてセラミックス層を導入することでハイブリッド化が容易になり、リポソームが抱える脆弱性の問題も克服できると考えた。このような考えをもとに、セラソームの表面をナノメーターレベルの金属薄膜でコーティングした人工細胞膜「メタロソーム」を開発した(Fig. 3a) 28,29) 。
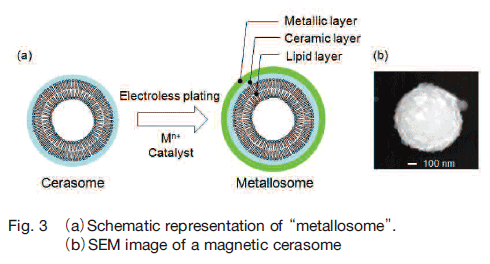
ここでは、セラソームに無電解めっき法 30) を適用してメタロソームを作製した。無電解めっき法とは、その名のとおり電気を用いず、化学的な酸化還元剤を利用することで金属薄膜を形成する手法であり、導電体に限らず様々な物質を金属で被覆できる。脂質 1 あるいは 2 から形成されるセラソームに塩化パラジウム溶液を添加すると、セラソーム表面にパラジウムイオンが結合し、これが触媒となってセラソーム表面にニッケル、銅、金など様々な金属薄膜を形成することができる。また、金属イオンと配位できる長鎖イミダゾール配位子を組み込んだセラソームを用いることで、無電解めっきのプロセスを促進できる。さらに、配位子濃度やめっき時間、温度などを調整することで、クラスターサイズの金属粒子から数十 nm の金属ナノ粒子、数十から数百 nm 厚みの金属シェルまで様々なメタロソームの表面構造が形成されており、セラソーム表面の金属被覆率や金属薄膜層の厚みを制御することもできる。リポソームを用いてメタロソーム作製を検討したところ、めっき操作によりカプセル構造が壊れてしまったことから、シロキサン骨格に起因する高い構造安定性をもつセラソームを用いることで、メタロソームの作製が有効に行えることがわかる 28)。
さらに、鉄、コバルト、ニッケルの磁性合金で無電解めっきを行うことで、磁性金属薄膜で被覆されたマグネティックセラソームを開発している(Fig. 3b) 29。作製したメタロソームはセラソーム由来のカプセル構造を保持しており、また、生体膜の特徴である相転移挙動も示した。マグネチックセラソームは外部磁場によりその凝集・分散をマニュピレーションすることができた。このような磁性金属材料の特性と人工細胞膜カプセルとしての特性を兼ね備えたマグネティックセラソームは、磁場誘導によって腫瘍部位に薬物を集積させるドラッグデリバリーや標的細胞に DNA を集積させる遺伝子導入(マグネットフェクション)など、様々な応用展開が期待される。
3. セラソームの遺伝子導入キャリアーとしての応用
遺伝子輸送においてベクターのサイズ制御は重要な課題である 31) 。カチオン性リポソームは非ウイルスベクターとして頻繁に利用されているが、リポソーム自体は数十 nm 程度の適切なサイズを保持できるものの、核酸との相互作用によって融合や架橋を起こし、サイズが増大してしまうという問題がある。サイズの巨大化は、細胞内への取り込みの基本過程であるエンドサイトーシスの効果を下げ、in vivo の系では抹消血管の透過性を妨げる。一方、サイズが適切であると、EPR (Enhanced Permeability and Retention)効果によりがん組織に遺伝子や薬物を選択的に送達できるという利点がある。従来のリポソームのサイズ制御の問題を克服し、細胞への高効率な遺伝子導入を実現するため、セラソームを遺伝子ベクターとして応用した 21,22 , 32) 。
3.1 セラソーム-DNA 複合体形成
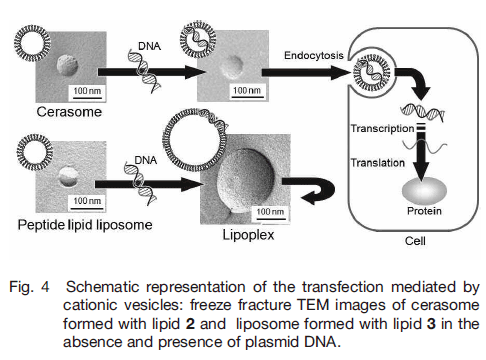
脂質 2 から形成されるセラソームは中性領域でカチオン性コロイド粒子として振舞うため、プラスミド DNA と静電相互作用により複合体(リポプレックス)を形成する。セラソーム形成脂質と DNA リン酸基のモル比を N/P としたとき、N/P 比の増大とともにリポプレックス形成量が増大することが、アガロースゲル電気泳動法により確認できる。
セラソームの構造に及ぼす DNA の影響を電子顕微鏡観察および動的光散乱法 (DLS)によって評価したところ、脂質 2 から形成されるセラソームは、プラスミド DNA の添加後も約 70 nm の粒径を保持していた (Fig.4)。一方、ペプチド脂質 3 から形成されるリポソームは、プラスミド DNA の添加後、粒径の増大が見られた。カチオン性セラソームは表面にシロキサン骨格を有するため、プラスミド DNA 添加に伴う構造変化が抑制されるのに対し、カチオン性リポソームは膜融合に伴いサイズが増大したものと考えられる。このように構造安定性に優れたセラソームは、リポプレックス形成後も膜融合せず、ウイルスサイズのベシクル形態を保持できるというベクターのサイズ制御における利点が見出された 21, 22)。
3.2 セラソームによる遺伝子導入
セラソームによる遺伝子キャリアーとしての機能を評価するため、ヒト子宮頸癌由来の HeLa 細胞株やヒト肝癌由来の HepG2 細胞株に対する遺伝子導入を行った。ルシフェラーゼ活性から遺伝子導入効率を算出したところ、脂質 2 から形成されるカチオン性セラソームは、N/P 比の増大とともに導入効率は増大し、N/P 比 2 で飽和した。興味深いことに、セラソームはペプチド脂質 3 から形成されるカチオン性リポソームに比べて、遺伝子導入効率が 100〜 1000 倍に増大した 21,22) 。カチオン性のペプチド脂質が形成するリポソームは、COS- 7 細胞等への遺伝子導入において有効性が既に認められているが 33) 、それに比べて格段の遺伝子導入効率が得られたことは特筆すべき点である。このような遺伝子導入効率の差異は、第一に DNA 複合体のサイズに起因すると考えられる。実際に、これらの DNA 複合体サイズと遺伝子導入効率の相関は、以前報告された人工グリコウイルス系における相関とよく合致している 34) 。
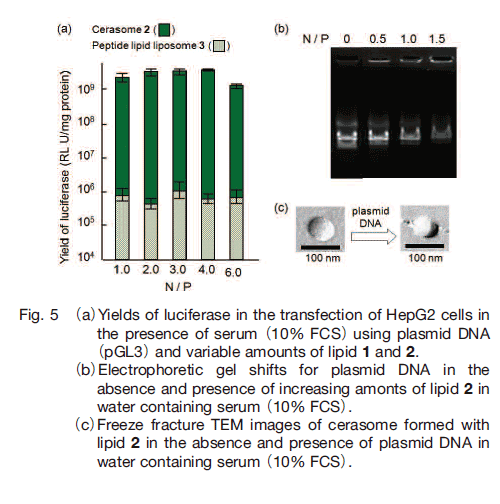
実際の遺伝子導入においてはしばしば血清培地中でのリポプレックス調製が必要になるが、一般に、カチオン性リポソームによる遺伝子導入を血清存在下で行った場合、その遺伝子導入効率は著しく低下する。実際に、10%の血清存在下でペプチド脂質 3 から形成されるリポソームを用いた場合、無血清系と比較して 10分の 1 程度まで遺伝子導入効率が低下した。しかしながら、セラソームを用いた場合、10%の血清存在下においても、無血清系と同等の遺伝子導入効率を示した(Fig. 5a)。実際に、セラソームは血清存在下においてもセラソーム-DNA 複合体が形成することがアガロースゲル電気泳動法により確認されており(Fig. 5b)、プラスミド DNA 存在下においても膜融合することなく、セラソーム本来の粒子サイズが保持されていた(Fig. 5c)。
さらに、MTT アッセイにより細胞毒性を評価したところ、セラソーム-DNA 複合体の添加によっても、 HeLa および HepG2 細胞は 100%近い細胞生存率を保持した。一方、カチオン性リポソーム-DNA 複合体の添加によって、 HeLa および HepG2 細胞の生存率はそれぞれ 63%、54%に低下した。このようなセラソームの低い細胞毒性の要因として、生体膜との融合の抑制や DNA 複合体の凝集抑制などが推察され、セラソームは高効率かつ細胞にやさしい遺伝子キャリアーとして利用できることが見出された。
3.3 セラソームによる siRNA 導入
RNA が遺伝子発現を制御する RNA 干渉(RNAi)が発見されて以来、遺伝子の特異的なサイレンシング技術を用いた細胞の機能解析や病気の治療法など新たな展開が期待されており、効果的な small interfering RNA (siRNA)の導入技術の開発の重要性が高まっている。ここではセラソームの優れた構造安定性を生かして siRNA 導入を検討した。
セラソームはプラスミド DNA 存在下において膜融合を起こさないが、高濃度条件においては、プラスミドDNA をテンプレートとしてセラソームが架橋した集積体が形成される。しかし、プラスミドの代わりに siRNA を用いるとこのような集積体は形成されない。高濃度条件においても siRNA との複合体サイズが増大しないというセラソームの特徴は、細胞への siRNA 導入において非常に有効である。実際に、蛍光タンパク質 DsRed2 を恒常的に発現する HeLa 細胞に対して、脂質 2 から形成されるセラソームを用いて siRNA を導入したところ、幅広い濃度条件で DsRed2 の発現が特異的に阻害された 32) 。一方、ペプチド脂質 3 から形成されるリポソームは、 siRNA 存在下で膜融合によりサイズが増大し、 siRNA 導入実験においても DsRed2 発現の阻害も見られなかった。また、セラソームは10% の血清存在下においても、無血清系と同等の RNAi サイレンシングが達成され、細胞毒性も低いことから、in vivo での応用が期待される。
3.4 セラソームによる神経細胞への遺伝子導入
様々な非ウイルスベクターが開発され、樹立された培養細胞株への高い遺伝子導入効率が達成される一方で、一般に、浮遊系の培養細胞株、初代培養細胞、幹細胞などへの遺伝子導入は困難であると言われている。中でも神経細胞は微小環境の変化に非常に敏感であるため、遺伝子導入後すぐに死滅しやすいという問題がある 35-37) 。神経細胞への遺伝子導入は、神経科学分野での遺伝子の機能解析に必要不可欠な手段であり、医療分野においては神経性疾患や脊髄損傷に対する遺伝子治療への応用が期待されていることから、高効率かつ細胞にやさしい遺伝子導入法の開発が求められている。ここでは遺伝子導入が最も困難な細胞の一つとされる初代培養神経細胞 38,39) をターゲットとして、セラソームの遺伝子ベクターとしての機能を評価した。
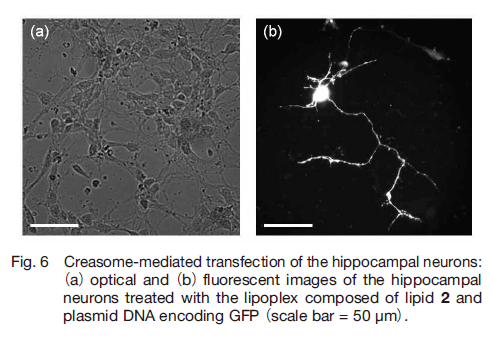
神経細胞は胎生 18 日目のラットから海馬を摘出して培養した。脂質 2 から形成されるカチオン性セラソームの水分散液に、緑色蛍光タンパク質(GFP:green fluorescent protein)をコードするプラスミド DNA を加え、セラソーム- DNA 複合体を調製した。これを用いて神経細胞への遺伝子導入を検討したところ、48 時間後、GFP の発現を蛍光顕微鏡観察で確認した(Fig. 6) 40) 。一方、ペプチド脂質 3 から形成されるカチオン性リポソームを用いたところ、GFP の発現は確認されなかった。上述の細胞株に対する結果と同様に、適切な DNA 複合体のサイズを維持できるセラソームは、神経細胞への遺伝子導入においても有効であることが示された。さらに、セラソームは神経細胞への毒性が低く、神経突起の伸長を阻害しないという興味深い結果が見出されている。神経突起の伸長は、神経ネットワーク形成における重要な過程であり、様々な生体分子が関与することが近年明らかになっている 41-43)。セラソームは、神経細胞の本来の性質・機能を損なわない遺伝子解析ツールとしての応用展開できると期待され、脊髄損傷や脳卒中後の神経再生のための遺伝子治療への応用も期待される。
4. おわりに
本稿では、われわれが開発した有機−無機ハイブリッドベシクル「セラソーム」の設計コンセプト、構造、物性および遺伝子キャリアーとしての応用について紹介してきた。セラソームは高い構造安定性を有しながら、その内部は生体膜モデルとしての特性を持ち合わせており、有機成分と無機成分がそれぞれ理想的な役割を担う有機−無機ナノハイブリッドである。セラソームはそのサイズや膜中の有機層と無機層の厚みをナノレベルで制御できる。有機−無機ハイブリッドの概念を踏まえ、両成分を Si-C 結合で連結した単位脂質構造を設計することで、このような分子集合体のナノ構造特性の厳密な制御が可能となり、従来のリポソームを凌駕する構造安定性を付与することができた。リポソームの構造不安定性を克服したセラソームは、核酸との相互作用による膜融合と複合体サイズの増大を抑制し、細胞にやさしい高効率な遺伝子キャリアーとして応用できることが明らかになった。これまでに数多くの非ウイルスベクターが合成・開発され、化学構造−機能の相関やベクターの設計指針に関する知見が蓄積されつつある。将来の遺伝子デリバリーシステムの確立のために、ベクターに機能性素子を組み込む多機能化に加え、本稿で紹介したハイブリッド化による新材料開発のアプローチを組み合わせることで、高い発現効率と安全性を具備した非ウイルスベクターが開発されることを期待したい。
謝辞
本稿で紹介したセラソームによる遺伝子導入は、京都大学大学院工学研究科の青山安宏教授(現 同志社大学大学院工学研究院教授)、奈良先端科学技術大学院大学バイオサイエンス研究科の稲垣直之准教授との共同研究である。また、メタロソームの開発は日鉱金属株式会社の伊森徹博士との共同研究である。これらの方々に深く感謝申し上げる次第である。
| 著者プロフィール | |
| 氏名 | 田原 圭志朗 (Keishiro Tahara) |
|---|---|
| 所属 | 奈良先端科学技術大学院大学 物質創成科学研究科 助教 |
| 連絡先 | 〒630-0192 奈良県生駒市高山町 8916-5 TEL : 0743-72-6099 E-mail : taharak@ms.naist.jp |
| 出身学校 | 九州大学大学院工学府物質創造工学専攻 |
| 学位 | 博士(工学) |
| 氏名 | 菊池 純一(Jun-ichi Kikuchi) |
| 所属 | 奈良先端科学技術大学院大学 物質創成科学研究科 教授 |
| 連絡先 | 〒630-0192 奈良県生駒市高山町 8916-5 TEL : 0743-72-6090 E-mail : jkikuchi@ms.naist.jp |
| 出身学校 | 九州大学大学院工学研究科合成化学専攻 |
| 学位 | 工学博士 |
| Copyright(c) 1996-2012 DOJINDO LABORATORIES, ALL Rights Reserved. |