 |
| トップページ > エピジェネティクス機構による細胞状態とリプログラミング |
 |
||||||||||||||
エピジェネティクス機構による細胞状態とリプログラミング
|
||||||||||||||
 |
中尾 光善(Mitsuyoshi Nakao) 熊本大学 発生医学研究所 細胞医学分野 |
【要約】
Epigenetic gene regulation is involved in normal development and human diseases with particular emphasis on cancer and metabolic diseases. Basically, variously differentiated somatic cells in our body have identical genome, but each of these cells has distinct morphology and function, probably due to different use of gene information. The term epigenetic is defined as “heritable changes in gene expression that occur without a change in DNA sequence”. Epigenetic regulatory mechanism mainly includes cytosine methylation, protein modification, chromatin formation, and nuclear substructures in the cell. These are involved in determining cell identity during development, regeneration, aging and diseases. To understand the essence of these phenomena, we perform medical science-oriented researches, by studying how genes function via epigenetic regulatory network. Our current work is focused on 1) investigating the molecular mechanism of gene regulation by DNA methylation and methylated DNA binding proteins; 2) studying the role of chromatin proteins and their modifying enzymes in physiology and diseases; 3) identifying the mechanisms involving in chromatin insulators that produce tissue-specific or cell state-specific gene activities; 4) studying nuclear structure, function and dynamics, including PML bodies and nuclear speckles; and 5) testing epigenetic regulatory molecules useful for medical diagnosis and therapy.
キーワード:
エピゲノム、DNAメチル化、クロマチン、細胞核、癌、幹細胞、生活習慣病
1.はじめに
エピジェネティクス機構には、DNAのメチル化、ヒストン等のタンパク質の翻訳後修飾、クロマチンの形成、核内構造体の形成が含まれており、これらで修飾されたゲノムをエピゲノムと呼び、遺伝情報発現に基づく細胞機能を制御している。近年、エピジェネティクス機構が生命現象や様々な疾患の基盤に関わることが明らかになりつつある。本稿では、エピジェネティクス機構の全体像を踏まえて、癌や生活習慣病、幹細胞を用いた再生医学において、細胞恒常性とリプログラミングに関するエピジェネティクスを概説し、我々の研究成果を紹介するとともに、これからの医学・生命科学の進展を目指した契機としたい。
2.エピジェネティクスの分子機構
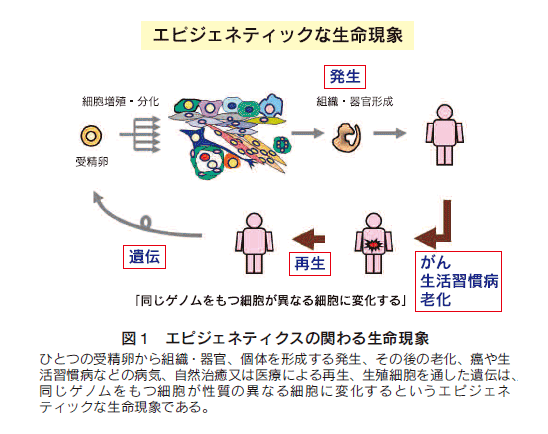
ひとつの受精卵が増殖分化することで、組織・器官そしてひとつの個体を形成する過程が発生であり、その後、個体は成長し、時間経過とともに老化し、時には癌や生活習慣病などの病気を患うこともある。しかし、細胞や組織の異常が起こっても、自然治癒又は医療を受けることで再生されることがある。また、個体は生殖細胞を通して次の世代にゲノムを伝える遺伝現象がある(図1)。これらは、基本的に、同じゲノムをもつ細胞が性質の異なる細胞に変化するというエピジェネティックな生命現象であると理解することができる1,2)。細胞の分化や老化は、その具体例として考えられる。多種多様の細胞の個性はどのように創られるのか。有力な考え方として、その細胞の遺伝子発現のパターンで決められると考えられる。ゲノム上の総遺伝子数を3万個とすると、ひとつの分化細胞では、約1万個の遺伝子が発現し、残りの遺伝子は不活性化されている。つまり、ゲノム上の遺伝子を選択的に活用することによって、細胞個性がエピジェネティックに確立・維持・消去されることを意味している。
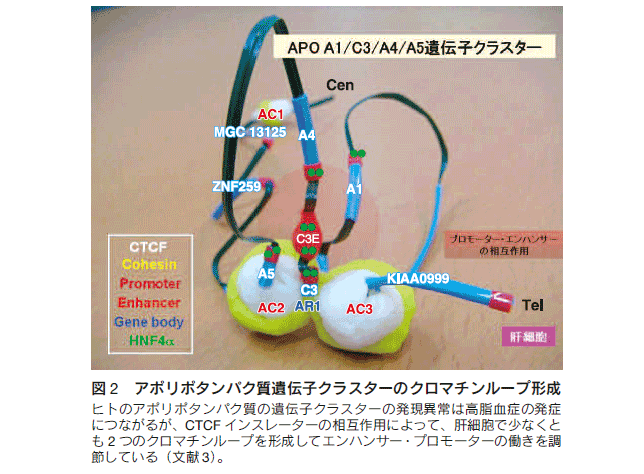
エピジェネティクスの制御システムには、DNAのメチル化、クロマチン、タンパク質の修飾・脱修飾、転写調節因子が遺伝子制御に重要な役割を果たしている。現在までに、DNAメチル化酵素、メチル化DNA結合タンパク質、ヒストン修飾酵素、クロマチン構造因子、クロマチンリモデリング因子、クロマチンインスレーター(クロマチンの境界)等の新しい分子群や機能的な複合体が相次いで発見されている。これらのエピジェネティクス機構によって、遺伝子制御とクロマチン構造の形成がなされるのである。さらに、ゲノム上の個々の遺伝子は、組織特異的に、分化特異的に、状況特異的に発現していることは、遺伝子が独立して制御される仕組みがあることを示している。細胞核内のエピゲノムは直線ではなく、興味深いことに、多数の機能的なループを形成していることを我々は明らかにしている。ヒトのアポリポタンパク質の遺伝子クラスター領域(その発現異常は高脂血症の発症につながる)が、CTCFインスレーターの相互作用によって、少なくとも2つのクロマチンループを形成してエンハンサー・プロモーターの働きを調節していることを報告した(図2)3-5)。エピジェネティクスの制御システムの作動原理を解析して、細胞制御と病態の理解を深めることで、ヒト疾患の新しい診断・治療・予防法の開発を目指している。
3.癌のエピジェネティクス
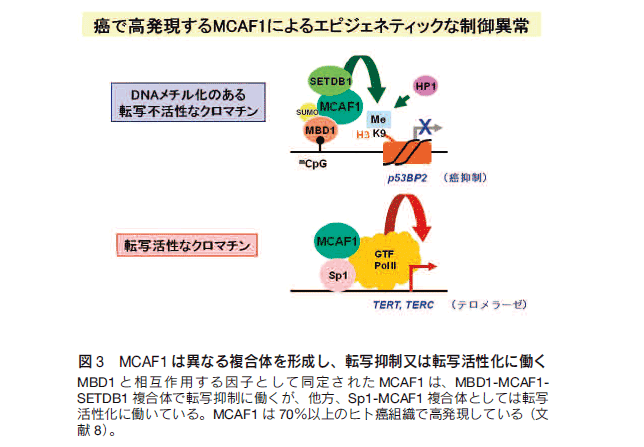
自然発生の癌細胞のほとんどに、DNAメチル化とクロマチンの異常があると言っても過言ではない。癌細胞では、ゲノム全体のDNAメチル化の低下が染色体不安定性を増大するとともに、プロモーター領域の高メチル化によって癌抑制遺伝子の発現が抑制されることが知られている。ゲノム全体の低メチル化と癌抑制遺伝子の高メチル化は、一見、逆の現象のように見えるが、トランスポゾン等のリピート配列に富むゲノム領域と遺伝子のプロモーター領域では、DNAのメチル化の制御機構が異なることを示唆している。また、核構造異常(核異型)は癌細胞に共通した特徴として知られているが、ゲノム全体の低メチル化によるクロマチンの変化を反映するものと推測されている。このように、癌化におけるエピジェネティックな制御異常は、癌細胞に共通の特性のひとつとして理解することができる。高メチル化された遺伝子の不活性化に関わるMBD1とzinc fingerタンパク質 6,7)、癌細胞で高発現して遺伝子制御を変化させるMCAF1 8)、癌細胞の悪性形質に関わる構造的クロマチン因子HMGA1とHMGA2 9-11)などに着目して、癌のエピジェネティックな異常について解析を進めている(図3)。
4.幹細胞のエピジェネティクス
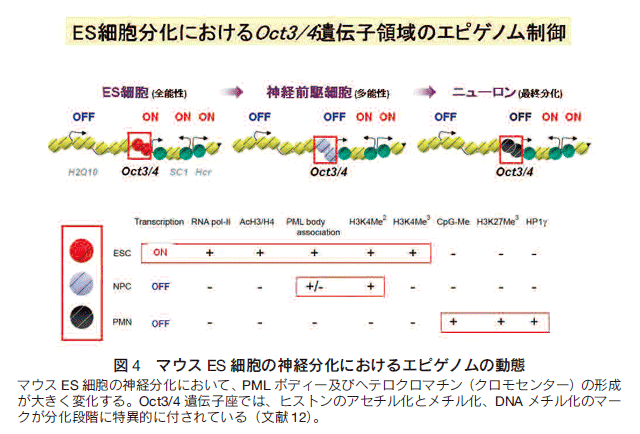
発生過程では、胚性幹細胞(ES細胞)、組織幹細胞、そして分化した細胞が順次に創出される。それぞれの分化段階の細胞のエピゲノムが異なる印付けをされている。通常、ES細胞と組織幹細胞は正常な組織を形成するものである。また、興味深いことは、ES細胞は全能性(pluripotency)をもつために、組織特異性に乏しいが、組織幹細胞は多能性(multipotency)という組織特異性を有している。例えば、マウスES細胞は、神経幹細胞(神経前駆細胞)、そしてニューロンやグリア等の神経系の細胞に分化誘導できる。このような幹細胞分化が、遺伝子制御とエピゲノムで規定されていることを明らかにしている(図4)12)。
ES細胞および組織幹細胞で、その細胞状態は均一ではなく、少なくとも2〜3のmetastableな平衡状態にあることが知られている。ある幹細胞状態が分化に進みやすくなっており、このエピジェネティックな平衡状態は、転写因子やクロマチン修飾のパターンと相関していると推測されている。実際に、エピジェネティクス機構において、クロマチンの修飾または脱修飾に関わる酵素群、特定の修飾または脱修飾を認識する分子群が同定されており、可変的に調節されている。他方、分化した細胞では、エピゲノムは比較的に安定に維持されていると考えられる。
再生医療を実現するために、体細胞から幹細胞にリプログラムする技術として、iPS細胞(induced pluripotent stem cell)の開発がなされた。現在、導入する転写因子や化合物等の組み合わせで、リプログラムの効率化、生じた iPS細胞の癌原性の阻害、安全かつ有効なiPS細胞の選択など、様々な取組が世界中で進行中にある。学術的には、iPS細胞に至るリプログラムというエピジェネティックな経路を解明することは重要な研究に位置づけられており、エピゲノムと細胞核構造の観点から、その制御基盤について解析を進めている。
5.生活習慣病のエピジェネティクス
エピゲノムの状態は、多くの環境因子の影響を受けることが判明し、生活習慣病との関係が注目されてきた。DNAのメチル化やクロマチン修飾は、細胞応答として変化するが、影響を与える因子には、栄養や食事、物質代謝、成育環境と生活習慣、天然化合物、薬剤・化学物質などが挙げられている(図5)。
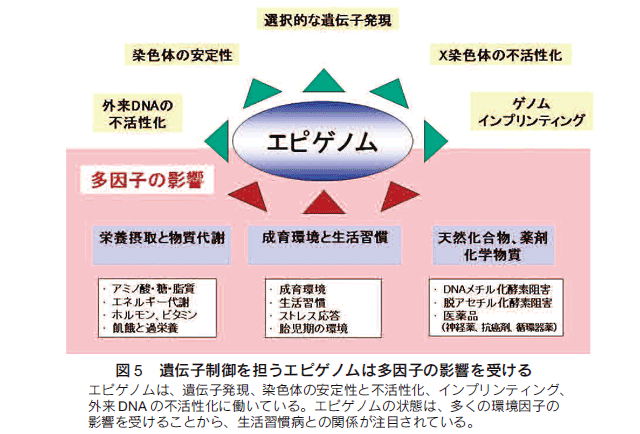
一卵性双生児は、遺伝学的に同一であるために、成育環境が及ぼす個体レベルの影響について重要な示唆を与えている。例えば、X連鎖性副腎白質ジストロフィー(X-linked adrenoleukodystrophy)の同じ遺伝子変異をもつ一卵性双生児が、臨床的に全く異なった症状や経過を示すことが報告された。また、一卵性双生児における統合失調症(schizophrenia)の発症不一致例についても報告がなされている。近年、欧米で大規模スタディーが行われて、一卵性双生児のふたりにおいて、加齢とともに、調べた細胞のDNAメチル化やヒストンの修飾に差異が生じていることが証明された13)。このように、成育環境がエピゲノムに影響することが明らかになっている。
agouti Avy マウスを用いた研究では、母マウスの餌にDNAメチル化に必要なコファクター(葉酸、B12、ベタイン)を添加すると、添加しない場合と比較して、仔マウスの毛色が黄色から黒色に変わることが示された14)。黄色色素をメラノサイトで合成する働きをもつ Avy 遺伝子が高くメチル化されて発現が抑制されていた。これは、食物が個体レベルのエピゲノム型(エピジェノタイプ)に影響することを示唆するものである。
しかしながら、これらの環境因子に対する細胞側の応答機序については、不明な点が極めて多い。ヒストンH3の9番目リジン(H3K9)の脱メチル化酵素である Jhdm2a は、精巣や褐色脂肪組織、骨格筋において高発現している。Jhdm2aを欠損するマウスは通常食供与下で脂質代謝異常を伴う肥満を呈することが、最近報告された15,16)。このマウスでは、骨格筋や褐色脂肪組織において脂肪酸酸化及び呼吸鎖などミトコンドリアでのエネルギー消費に関わる遺伝子の発現が低い。最近、我々は H3K4 脱メチル化酵素LSD1による代謝関連遺伝子群の発現制御機構を見出しており、これらは、特定のクロマチン修飾因子がエネルギー代謝調節に関わる可能性を示唆している。
ヒトの低出生体重児に関するスタディーにおいて、心疾患、2型糖尿病や肥満などの成人病の発症率が高くなるという報告がなされている 17,18)。母胎内で栄養不足の状態にあった低出生体重児は、少ない栄養を効率よくエネルギー源とできるように適応しており、出生後に通常の栄養を受ける環境に置かれた場合には、過栄養の状態に陥りやすいと考えられるモデルである。このモデルは、胎児期の飢餓状態に適応するように、細胞内のエピゲノムや遺伝子制御を獲得するのではないかと解釈されている。低栄養状態がエピゲノムに記憶されるために、代謝メモリーまたはエピジェネティック・メモリーとも呼ばれている。環境因子がエピゲノムに影響を与える仕組み、多因子疾患の発症に関わる責任遺伝子座のエピゲノム制御を通して、多因子疾患(肥満、高脂血症、糖尿病など)の素因と病態解明、そして個体差としての体質のメカニズムが明らかになることを期待している。
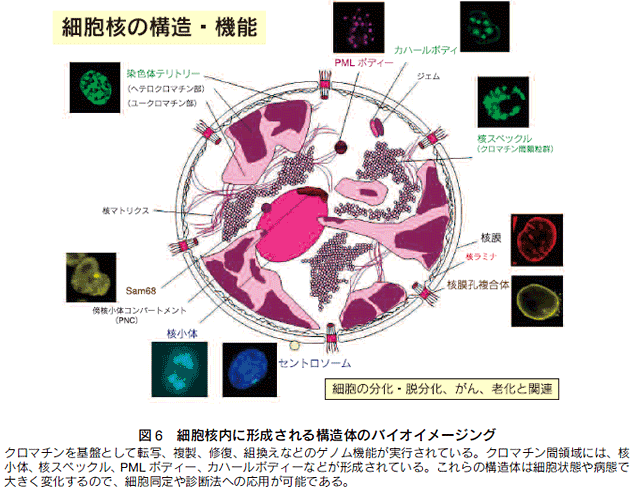
6.細胞核構造のバイオイメージング計測
細胞核は細胞自体の司令塔にあたる役割を果たしており、細胞内外の刺激によるシグナリングを集約して、遺伝子発現として応答している(図6)19)。核と細胞質は核膜で隔てられると共に、核膜孔を通して様々な分子輸送がなされている。クロマチンにおいては、主に転写、複製、修復、組換えなどのゲノム機能が実行されており、他方、クロマチン間領域には、核小体、その他の核内構造体(核スペックル、PMLボディー、カハールボディーなど)が形成されている。興味深いことに、これらの核内構造体には、膜構造はなく、いわゆる分子集合体として形成と離散という動的な平衡状態にあるという点である。分子集合体として分子密度を局所的に高めることで、生化学反応を効率よく進めることが可能になっている。さらに、異なる核内構造体が機能的に連携することで、遺伝子発現からRNAのプロセシングや核外輸送などがスムーズに行われるようである。このように、細胞核の構造機能は密接に相関しているが、例えば、核スペックルやPMLボディーがどのように形成されて機能を果たすのかは不明な点が多い。細胞応答において、核内構造体や分子集合体が時空間的に協調的に作動する仕組みについて解析を進めている 20)。さらに、細胞核構造は、癌、神経筋疾患、感染症、発生異常、早老症などで大きく変化することから、DNA/RNA/タンパク質の可視化および最新のバイオイメージング計測解析を用いて、細胞と細胞核構造、細胞集団としての組織構築の形態を定量評価することで、細胞同定法および組織診断法を開発中にある。
| 筆者紹介 | |
| 名前 | 中尾 光善 (Mitsuyoshi Nakao) |
|---|---|
| 所属 | 熊本大学 発生医学研究所 細胞医学分野 (熊本大学大学院医学教育部) |
| 連絡先 | 〒860-0811 熊本市本荘2-2-1 TEL:096-373-6800 FAX:096-373-6804 E-mail:mnakao@gpo.kumamoto-u.ac.jp URL:http://www.imeg.kumamoto-u.ac.jp |
| 略歴 | 1985年 島根医科大学医学部卒業 1991年 久留米大学大学院医学研究科修了・医学博士 1992年 ベイラー医科大学およびハワードヒューズ医学研究所・研究員 1995年 熊本大学医学部・助手、講師 2002年 発生医学研究センター・教授 2006-2008年 発生医学研究センター長(併任) 2009年 発生医学研究所・教授 2010年 発生医学研究所長(併任) |
| 研究室のコンセプト | ひとと学問を育てる (挑戦する若い方の参加を望みます) |
| 趣味 | 絵画、テニス |
| Copyright(c) 1996-2011 DOJINDO LABORATORIES, ALL Rights Reserved. |