低分子蛍光化合物による筋肉細胞の分化制御
株式会社同仁化学研究所 上薗 貴広
同一個体の細胞が持つ遺伝子は同じであるが、個体の部位や個体への発生・分化において、すべての遺伝子が発現されるわけではない。すなわち、組織・器官によって特異的な遺伝子が、それぞれの発生期において時期特異的に発現し、固有のタンパク質が合成されたり、発現を抑制したりして、細胞の個々の組織・器官への発生・分化が達成される。細胞の分化制御機構を解明しようとする際には、分化誘導物質や分化阻害物質の性質とそれらの機能、作用機序の研究が、極めて重要な意味を持つ。以前から知られている低分子蛍光化合物が、最近、筋肉細胞の分化を制御する機能を持つことが新たに見い出されたので紹介する1)。
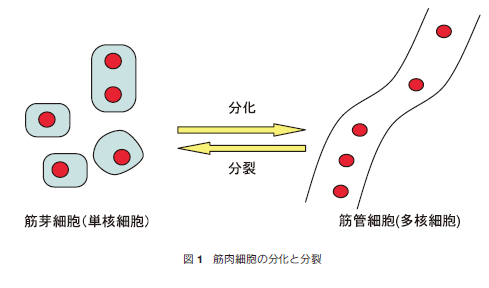
初期の筋肉細胞分化の過程では、未分化な細胞が筋繊維由来の細胞である「筋芽細胞」になる。筋芽細胞はさらに分化を開始し、筋肉細胞特異的なタンパク質が発現される。特に、筋肉細胞の分化で特徴的な現象は細胞融合である。単核細胞である筋芽細胞が融合して、多核細胞である「筋管細胞」へと分化する(図1)。さらに成熟した筋管細胞から、収縮能を持つ筋繊維を形成する段階を経て、筋肉が完成する。シャーレ中で培養した筋芽細胞から筋管細胞への分化は容易であり、筋管細胞から筋繊維への分化は、小胞体ストレスを誘起する薬剤の投与によって誘導される報告がある2)。
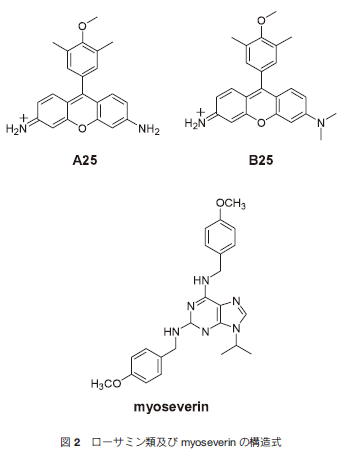
以前、Kimらは筋芽細胞には染色せず、筋管細胞にのみ特異的に染色し、筋肉細胞の分化状態を識別することができるローサミン化合物を報告している3)。カチオン性の芳香環をもつローサミン化合物は、低分子蛍光化合物であり膜電位が負に帯電しているミトコンドリアに引き寄せられ内側へ入る。さらに最近、Kimらは筋芽細胞から筋管細胞への分化を阻害するローサミン化合物(B25化合物)を見つけ出した1)。マウス筋芽細胞C2C12にローサミン化合物(A25-B25化合物類)を添加し、蛍光顕微鏡で観察したところ、B25化合物を添加した筋芽細胞は未分化状態を保持していた。対照的に、B25化合物と類似の構造をもつA25化合物は、長い円筒状の筋管細胞が形成され、ローサミン化合物類を添加していない条件と同じように筋芽細胞の分化が確認された。
また、分化した筋管細胞へB25化合物を添加したところ、筋管細胞が分裂し、単核細胞へ変化していた。A25化合物を添加した筋管細胞は長くまっすぐな構造を保持していた。そこで、筋管細胞の細胞分裂を確認するために、筋肉分化マーカーであるミオシンの染色を行った。B25化合物を添加し、筋管細胞から分裂した単核細胞の約40% が抗ミオシン抗体により染色され、筋管細胞が筋芽細胞へ分裂したことが示唆された。また、B25化合物が分裂を誘起する濃度は数μmol/L以下であった。
B25化合物による筋芽細胞への分裂メカニズムを検証するために、myoseverin(図2)との比較を行った。プリン誘導体であるmyoseverinは、微小管を不安定化し、筋管細胞から単核細胞への分裂を誘導する試薬として知られている4)。筋芽細胞C2C12にそれぞれの化合物を添加し、抗微小管抗体で染色した。myoseverinを添加したC2C12細胞の微小管は不規則な配向に変化していたが、B25化合物を添加したC2C12細胞の微小管はA25化合物を添加した細胞と同じように平行で束状に配列した正常な形状を保っていた。微小管が開裂すると細胞周期は停止するため、myoseverinは細胞周期の停止を誘発する試薬としてもよく知られている。そこで、myoseverinまたは、B25化合物処理をしたC2C12細胞の細胞周期を観察したところ、myoseverinを添加したC2C12細胞はG2/M期で停止していた。更に、神経細胞分化のモデル細胞としてよく知られているラット副腎髄質の褐色細胞腫細胞PC12の分化の際に、myoseverinを添加したところ、神経分化が阻害されていた。つまり、myoseverin処理をした筋管細胞は細胞種や細胞状態に関係なく、微小管開裂を引き起こし分裂していた。それとは対照的に、B25化合物はPC12細胞の増殖や神経細胞への分化に影響を与えなかった。これらの結果から、B25化合物処理による細胞分裂のメカニズムは、myoseverinが微小管を開裂させて誘起する細胞分裂のメカニズムとは異なることが示唆された。
また、B25化合物によって誘起された筋管細胞の分裂に、NF-κB(nuclear factorκB 核内因子κB)の活性化が関与するかどうかを検証した。NF-κBは筋肉の分化に深く関与する因子として知られている。TNF(tumor necrosis factor 腫瘍壊死因子)によって活性化されたNF-κBはヒト筋芽細胞やマウス筋芽細胞C2C12の分化を抑制することが報告されている5)。筋芽細胞C2C12にレンチウイルスを用いて、NF-κB遺伝子を導入し、筋管細胞へ分化させた。この筋管細胞へB25化合物を添加し、活性を測定したところ、NF-κBは活性化されていた。
また、NF-κBの強力な阻害剤であるクルクミンとB25化合物を同時に添加して筋管細胞を処理したところ、分裂は抑制された。この結果から、NF-κBの活性化はB25化合物による筋管細胞分裂に必要であることが示唆された。しかし、TNFはNF-κBを活性化するにもかかわらず、筋管細胞の分裂を誘起しなかったことから、NF-κB経路は細胞分化の制御には関与するが、NF-κB活性化だけでは筋管細胞の分裂を引き起こすには不十分であることが
わかった。
このように、既知の低分子蛍光化合物が蛍光性のみならず、細胞の分化制御に関わるような新たな機能を合わせもつ可能性が出てきた。
今回紹介した論文では、組織観察、マーカー・特異的タンパク質の検出や転写因子の活性により、低分子蛍光化合物による細胞
の分化制御機構の解明を試みている。低分子化合物による分化制
御機構の研究は、再生医療の基礎研究部分になる幹細胞増殖因子や分化誘導因子などによる発生分化のメカニズムに関わると考えている。
参考文献
1) Yun kyung Kim, Hyung-Ho Ha, Jun-Seok Lee, Xuezhi Bi, Young-Hoon Ahn,
Siti Hajar, Jae-Jung Lee and Young-Tea Chang, J. Am. Chem. Soc., 2010, 132, 576-579.
2) Keiko Nakanishi, Naoshi Dohmae and Nobuhiro Morishima, FASEB J., 2007, 21, 2994-3003.
3) Bridget K. Wagner, Hyman A. Carrinski, Young-Hoon Ahn, Yun Kyung Kim, et al., J. Am. Chem. Soc., 2008, 130, 4208-4209.
4) Gustavo R. Rosania, Young-Tae Chang, Omar Perez, Daniel Sutherlin, Helin Dong, David J. Lockhart and Peter G. Schultz, Nature Biotechnology, 2000, 18, 304-308.
5) Peter Magee, Stephen Pearson and Jeremy Allen, Lipidsin Health and
Disease, 2008, 7, 24.
▲ページのトップへ
|



