 |
| トップページ > エイズからみた感染症研究の最前線 |
 |
||||||||||
エイズからみた感染症研究の最前線
1.HIVに対するCTLのはたらきHIVはヒトに感染すると激しく増殖するが、やがてウイルス量の上昇は抑えられる。HIV感染に対して、 ヒト免疫系はインターフェロンやナチュラルキラー細胞等による自然免疫系に続いて獲得免疫系を誘導する。 急性感染期には中和抗体はほとんど認められないが、細胞傷害性T細胞(CTL)応答とともにウイルス量が減少するため、 CTL応答がHIV封じ込めに重要であると考えられている(Fig. 1)。しかしながら、ヒト免疫系ではHIVを完全に排除することはできず、 多くの感染者では慢性持続感染が成立して病態が進行する(Fig. 1)。CTLがどのようにHIVを抑制するか、 HIVはどのようにCTLを中心とする免疫応答から逃避するかを理解することは、重要な課題であるばかりでなく、 今後のワクチン開発に必須であり、世界中で盛んに研究されている。 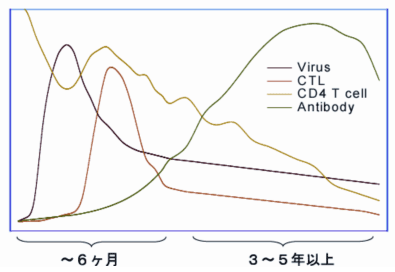
CTLは、HLAクラス 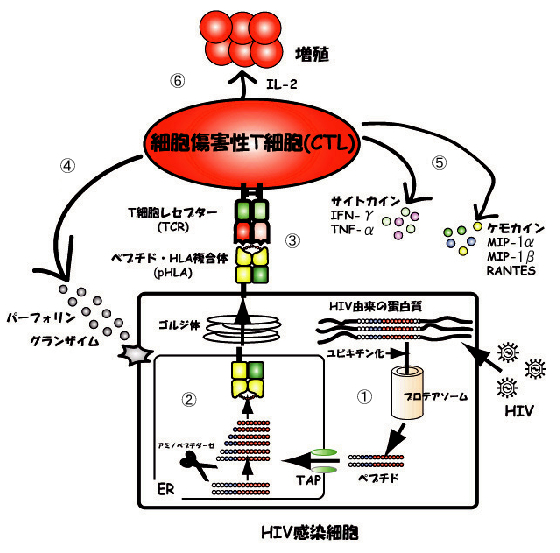
2.HLA遺伝子多型とHIVHIV感染症の病態には個体差がある。同じウイルスに感染したとしても、ヒトによって病態の良し悪しが大きく異なることが知られている。HIVに感染しても病態が長期に渡って進行しない感染者(Long-Term Non Progressor; LTNP)や、HIV複製を低レベルに抑え込み続ける感染者(Elite Controller; EC)が、総HIV感染者の約0.3から1%程度認められている2)。こうしたケースでは、感染したウイルスに何らかの欠損があったという場合も稀に報告されているが、ほとんどは宿主のさまざまな遺伝学的要因(あるいはそれらの複雑な相互作用)に因ると考えられている。こうした検体を用いて、HIV感染症に防御的に働くヒト遺伝子をハプロタイプレベルで包括的に明らかにしようとする試みがアメリカ、ヨーロッパ、アフリカで大規模に進められている2,5)。
興味深いことに、CTL応答を拘束するHLAクラス ここで一点、注意しておきたい。HLA-B*57やB*27アリルと病態進行に統計学的に有意な相関が認められることは、こうしたアリルを持つヒトではHIVに感染しても病態が安定することを保証していない。HLA-B*57アリルを持っていてもLTNPやECになる感染者はごくごく一部である。他の遺伝的あるいは環境要因が関与していると考えられる。一方、日本人にはどちらのアリルも極めて少ない。血友病HIV感染者のLTNPではHLA-B*51アリル頻度が有意に高いとする報告もあるが、最近の感染者においてもこの傾向が認められるか不明である。日本人を対象としたより包括的な解析が待たれる。 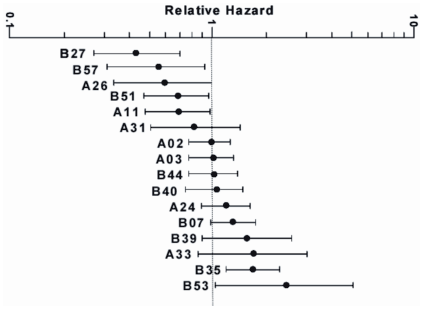
3.CTL淘汰圧とHIV進化
これまで述べてきたようにCTLは非常に強く生体内でHIVを抑制する。それでは、CTLは強い淘汰圧としてHIVの進化に広く影響するのだろうか?CTLが認識する抗原は、その人が持つHLAクラス HIVは変異性が高いウイルスであるが、ウイルス蛋白質の機能や構造、あるいはウイルス複製にとって必須な領域はよく保存されている。このような保存性の高い機能性領域に逃避変異を獲得することは容易ではないだろう。Nefは多数の宿主因子と相互作用して生体内でのHIVの複製を増強させる病原性因子であるが、その一方CTLが頻繁に標的とすることでも知られている。我々は、Nefの最も重要な機能性領域で保存性の高いPxxPモチーフをターゲットとするCTL応答を解析した。その結果、HIVはCTL逃避変異体を選択するが、同時にその変異はNefのウイルス複製増強作用を減弱化させることを見出した10)。また、興味深いことにHIV感染制御と関連するHLA-B*57やHLA-B*27に拘束性のCTLでは、カプシドを構成する蛋白質(p24 Gag)に対して非常に強い応答を示す。CTL応答によって変異体が選択されるが、CTLから逃避しても変異ウイルスの複製が十分に回復しないことが報告された11,12)。CTLがターゲットした領域は、カプシドの複合体構造形成やサイクロフィリンAとの結合などウイルス複製に極めて重要であった12)。さらに、この変異ウイルスが他の宿主に伝染すると、次の宿主がHLA-B*57を持たないときには変異は速やかに野生型に復帰することが分かった9,11)。これらの観察結果は、HIVに対するCTL応答の中には、HIV複製上きわめて重要な役割を担う領域を標的としており、そうしたCTLはHIVに対して非常に強い淘汰圧として働いていることを示している。 このようにHIVは確かに極めて高い変異性を利用してCTLから逃避するが、CTLが標的とする領域を適切に選択することができれば、ウイルス複製を機能的に制御することが可能となるかもしれない。HIVが自身の骨身を削ってでも逃げなければならないほど強いCTL応答を誘導し、その活性を長期にわたって維持できる合理的な免疫誘導法(ワクチン)の開発が待たれる。 参考文献1) A. J. McMichael and Rowland-Jones SL: Cellular immune responses to HIV. Nature , 2001, 410, 980. 2) S.G. Deeks and B. D. Walker, Human immunodeficiency virus controllers: mechanisms of durable virus control in the absence of antiretroviral therapy. Immunity , 2007, 27, 406. 3) P. K. Kiepiela, et al., CD8+ T-cell responses to different HIV proteins have discordant associations with viral load., Nat. Med., 2007, 13, 46. 4) T. Ueno, et al., Functionally impaired HIV-specific CD8 T cells show high affinity TCR-ligand interactions, J. Immunol., 2004, 173, 5451. 5) J. Fellay, et al., A whole genome association study of major determinants for host control of HIV-1, Science, 2007, 317, 944. 6) S. J. O’Brien, et al., HLA and AIDS: a cautionary tale, Trends Mol. Med., 2001, 7, 379. 7) T. Ueno, et al., Altering effects of antigenic variations in HIV-1 on antiviral effectiveness of HIV-specific CTLs, J. Immunol., 2007, 178, 5513. 8) Z. Brumme, et al., Evidence of differential HLA class I-mediated viral evolution in functional and accessory/regulatory genes of HIV-1, PLoS Pathog., 2007, 3, e94. 9) P. J. R. Goulder, D. I. Watkins, HIV and SIV CTL escape: implications for vaccine design, Nat. Rev. Immunol., 2004, 4, 630. 10) T. Ueno, et al., CTL-mediated selective pressure influences dynamic evolution and pathogenic functions of HIV-1 Nef, J. Immunol., 2008, 180, 1107. 11) A. J. Leslie, et al., HIV evolution: CTL escape mutation and reversion after transmission, Nat . Med., 2004, 10, 282. 12) M. A. Brockman, et al., Escape and compensation from early HLA-B57-mediated cytotoxic T-lymphocyte pressure on human immunodeficiency virus type 1 Gag alter capsid interactions with cyclophilin A, J. Virol., 2007, 81, 12608.
|
| Copyright(c) 1996-2008 DOJINDO LABORATORIES,ALL Rights Reserved. |
 分子に提示されたHIV由来ペプチドを認識して、HIV感染細胞を攻撃する(Fig. 2)。HLAクラス
分子に提示されたHIV由来ペプチドを認識して、HIV感染細胞を攻撃する(Fig. 2)。HLAクラス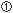 細胞内で発現したHIV由来蛋白質は、ユビキチン化された後、プロテアソームでペプチドに分解される。
細胞内で発現したHIV由来蛋白質は、ユビキチン化された後、プロテアソームでペプチドに分解される。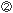 ペプチドは、トランスポーター(TAP)を介して粗面小胞体(ER)内に輸送され、アミノペプチダーゼにより8〜11merの長さにまでトリミングされる。その後、HLAクラス
ペプチドは、トランスポーター(TAP)を介して粗面小胞体(ER)内に輸送され、アミノペプチダーゼにより8〜11merの長さにまでトリミングされる。その後、HLAクラス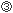 細胞表面に提示されたpHLAは、T細胞レセプター(TCR)を介して、細胞傷害性T細胞(CTL)に認識される。CTLは、
細胞表面に提示されたpHLAは、T細胞レセプター(TCR)を介して、細胞傷害性T細胞(CTL)に認識される。CTLは、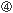 パーフォリン、グランザイムを放出し、HIV感染細胞を殺傷する。
パーフォリン、グランザイムを放出し、HIV感染細胞を殺傷する。 MIP-1α、MIP-1β、RANTESなどのケモカインならびにIFN-γ、TNF-αなどのサイトカインを産生し、HIVの細胞内への侵入阻止ならびにHIVの増殖を抑制する。
MIP-1α、MIP-1β、RANTESなどのケモカインならびにIFN-γ、TNF-αなどのサイトカインを産生し、HIVの細胞内への侵入阻止ならびにHIVの増殖を抑制する。 IL-2を産生し増殖する。
IL-2を産生し増殖する。
