 |
|
||||||||||||
 |
|
独立行政法人農業・生物系特定産業技術研究機構
動物衛生研究所 広田 次郎、清水 眞也
 |
|
||||||||||||
 |
|
イムノアッセイは、抗原-抗体反応を利用した高感度で特異性の高い方法であり、様々な物質を検出、定量するために欠くことのできない分析法として、幅広い分野で多用されている。この中でも特に酵素標識抗体を用いる酵素抗体法は、ラジオイムノアッセイと同程度の感度を有し、取扱いの危険性もないことから、検出系として広く用いられている。今日ではイムノアッセイに用いる、標識されたモノクローナル抗体やポリクローナル抗体が多数販売され、種々の解析に用いられている。抗体に標識する手法は表1に示したような方法が開発されてきたが、実験室レベルにおいては標識二次抗体の使用が一般的であり、一次抗体への標識は行われてこなかった。この理由として、 抗体に酵素や蛍光物質を標識する技術は高度で熟練が必要である、
抗体に酵素や蛍光物質を標識する技術は高度で熟練が必要である、 酵素などを標識する過程で抗体の特異性が著しく減少、あるいは失活することがある、
酵素などを標識する過程で抗体の特異性が著しく減少、あるいは失活することがある、 mgオーダーの抗体が必要である、
mgオーダーの抗体が必要である、 二次抗体に用いる多種類の標識抗体が市販されている、等をあげることができる。特に
二次抗体に用いる多種類の標識抗体が市販されている、等をあげることができる。特に の標識過程における抗体の失活についてはモノクローナル抗体において顕著であり、このため、モノクローナル抗体への直接標識は通常行われていない。
の標識過程における抗体の失活についてはモノクローナル抗体において顕著であり、このため、モノクローナル抗体への直接標識は通常行われていない。
一次抗体への直接標識により、実験手順の簡略化、多重染色や競合試験が可能となり、また、二次抗体による影響を排除することができるため、抗体への簡易な標識法はメリットが大きく、要求性の高い技術である。
(株)同仁化学研究所のPeroxidase Labeling Kit -SH(以下-SH キット)およびPeroxidase Labeling Kit - NH2(以下-NH2キット)は 標識に必要な抗体量が50~200μgである、
標識に必要な抗体量が50~200μgである、 精製および濃縮にFiltration Tubeを用いるのでゲルろ過や透析の必要がない、
精製および濃縮にFiltration Tubeを用いるのでゲルろ過や透析の必要がない、 標識に要する時間は三時間程度と短い、
標識に要する時間は三時間程度と短い、 標識条件が比較的穏和であり抗体が失活しにくい、という特徴を持っているキットである。
標識条件が比較的穏和であり抗体が失活しにくい、という特徴を持っているキットである。
今回、モノクローナル抗体を-SHキット、-NH2キット、グルタールアルデヒド二段階法、および過ヨウ素酸改良法でペルオキシダーゼ(POD)標識し、ELISAにて酵素標識抗体の活性を比較し、各手法の有効性を検討した。
材料および方法
抗体:ブルータングウイルス抗原に対するモノクロ-ナル抗体 (8A3B.6, IgG2a)を腹水より精製したものを用いた。
酵素標識:POD標識は、グルタールアルデヒド二段階法、過ヨウ素酸改良法、(株)同仁化学研究所製 Peroxidase Labeling Kit-SHおよびPeroxidase Labeling Kit - NH2により行った。標識手順はグルタールアルデヒド二段階法5)、過ヨウ素酸改良法7)は文献に従い、-SH キット、-NH2キットは添付マニュアルに従った。
酵素標識抗体の活性比較:各POD標識抗体はタンパク質濃度をあわせて、ELISAを行うことで比較した。タンパク質濃度は280 nm における吸光度(A280)により算出し、各々10μg/ml、5μg/ml、2.5μg/ml、1.25μg/ml、0.625μg/ml、0.313μg/ml、0.156μg/mlの濃度に希釈し、用いた。
ELISA:96wellプレート (MAXISORP, Nunc)に不活化ブルータングウイルス抗原を37℃で60分吸着させ、次いで20%のBlockAce(大日本住友製薬㈱)で37℃で60分ブロッキングした。このプレートに各標識抗体の希釈系列を分注し、37℃で60分反応させた。反応終了後POD基質液(ABTS,Sigma)を分注し、37℃で30分インキュベートを行い、プレートリーダーにて405nmでの吸光度を測定した。なお、プレートの洗浄は各工程ごとに行っ た。
結果および考察
-SH、-NH2キットおよび過ヨウ素酸改良法による各POD標識モノクロ-ナル抗体の吸光度を図に示した。なお、グルタールアルデヒド二段階法によりPOD標識したモノクロ-ナル抗体は、抗原への反応性が全く確認されなかったため、図には表示していない。
図に示されるように、-SH キットによる標識抗体では、低い抗体濃度でも高いOD値を示した。0.625μg/ml以上のタンパク質濃度では測定限界以上に達したため、検出限界以上のOD値は2.0として示した。この結果は、-SH キットに用いられているマレイミド法が、ヒンジ部への特異的な標識であり、また方法上self-couplingが少なく、pH中性域での温和な反応であるために、抗体およびPODの活性がほとんど損なわれなかったためであると考えられた。
次に、-NH2キットによる標識抗体では、同じタンパク質濃度でのOD値が-SHキットによる標識抗体と比べ、約1/2であった。この理由として、-SHキットでは法の関係上、IgG(分子量150,000)は還元型IgG(分子量75,000)となり、この還元型IgG分子にPODが標識される。これに対し、-NH2キットではIgG分子にそのままPODが標識される。このためタンパク質量あたりのPOD分子数は、-SHキットで作成したものの方が-NH2キットで作製したものの2倍近くとなるためであることが考えられた。また-NH2法では、-SH法とは異なり抗体の特定部位に酵素がラベルされるわけではない。このため、抗原認識部位にも標識され、OD値が若干低下することも考えられた。
過ヨウ素酸改良法で標識した抗体では、-SH キットや-NH2キットと比べて著しくOD値が低かった。酵素活性自体は失活していなかったので、この現象は操作の過程でモノクローナル抗体の抗原への結合能が大きく低下したためであると考えられた。ポリクローナル抗体では、グルタールアルデヒド二段階法や過ヨウ素酸改良法により酵素標識した場合でも、抗体の活性は充分使用可能な範囲であることが多い。しかし、抗原を認識する部位が単一であるモノクローナル抗体では、pHの影響などで抗体の活性が著しく低下、あるいは失活することが知られている。今回用いたモノクロ-ナル抗体においても、グルタールアルデヒド二段階法で標識した抗体は抗原との結合性をほぼ失い、過ヨウ素酸改良法においても抗原との結合性は著しく低下していた。モノクロ-ナル抗体の種類により失活の程度は異なると考えられるが、モノクローナル抗体への標識にグルタールアルデヒド二段階法や過ヨウ素酸改良法は適当ではないと考えられる。
-SHキットおよび-NH2キットは、モノクローナル抗体の抗原への結合性が失活することなく、迅速・簡易に標識することができることから、利用価値の高い優れたキットであった。また、このキットで標識した抗体は、付属の保存液に溶解した状態で、4℃にて4ヶ月間保存しても活性がほとんど変化しないため、保存も容易であった。なお、ここには示していないが、FITC標識キットでも今回と同様の手順で、抗原結合能の低下もなく簡便・迅速に蛍光標識可能であった。
表1. 抗体の酵素標識法
|
参考文献
1) S. Avrameas,“Coupling of enzymes to protein with glutaraldehyde. Use of the conjugate for the detection of antigen and antibodies”,Immunochemistry, 1969,6, 43.
2) D. M. Boorsma and G. L. Kalsbeek,“A comparative study of
horseradish peroxidase conjugates prepared with one-step and two-step method”, J. Histochem.Cytochem., 1975, 23, 200
3) D. M. Boorsma and J. G. Streefkerk,“Peroxidase-conjugate chromatography. Isolation of conjugate prepared with glutaraldehyde or periodate using polyacrylamide-agarose gel”,J. Histochem. Cytochem., 1976,24, 481.
4) D. M. Boorsma, J. G. Streefkerk and N. Kors,“Preoxidase and fluorescein isothiocyanate as antibody marker. A quantitative comparison of two peroxidase conjugates prepared with glutaraldehyde or periodate and a fluorescein conjugate”, J. Histochem. Cytochem., 1976, 24, 1017.
5) E. Engvall and P. Perlmann,“Enzyme-linked immunosorbent assay (ELISA). Quantitative assay of immunoglobulin G”, Immunochemistry, 1971, 8, 871.
6) K. Kato, Y. Hamaguchi, H. Fukui and E. Ishikawa,“Enzyme-linked immunoassay I. Novel method of synthesis of the insulin-β-D-galactosidase conjugate and its applicable for insulin assay”, J. Biochem., 1975, 78, 235.
7) P. K. Nakane and A. Kawaoi,“Peroxidase-labelled antibody. New method of conjugation”, J. Histochem. Cytochem., 1974, 22, 1084.
8) P. K. Nakane,“Preparation and standardization of enzyme-labelled conjugates.”, PP.81, in :R. M. Nakamura, W. R. Dito and E. S. Tucker, Ⅲ(eds.) :Immunoassey in the Clinical Laboratory, Alan R. Liss Inc., New York, 1979.
9) M. B. Wilson and P.K. Nakane,“Resent developments in the periodate method of conjugating horseradish peroxidase(HRPO) to antibodies”. pp.215, In : W.Knapp, K. Holuber and G. Wick(eds.) :
Immunofluorescence and related staining techniques, Elsevier/North-Holland Biomedical Press, Amsterdam, 1978.
・簡単、迅速なラベル化キット
Dojindo Labeling Kitsは活性化試薬とフィルトレーションチューブにより抗体等を簡単に標識するためのキットです。前処理-反応-精製までを全て一つのフィルトレーションチューブ上で行うことができ、3時間以内に標識体が得られます。1回の標識操作で50~200μgのサンプルを処理することができます。フィルトレーションチューブを用いた精製はゲルろ過や透析などに比べ標識体の回収率が高く、貴重なサンプルの標識に適しています。キットには保存溶液が付属しており、標識体を安定に保存することができます。
・高分子から低分子まで
Dojindo Labeling Kitsは分子量50,000以上の高分子のラベル化を行うことができます。活性化酵素を標識するPeroxidase Labeling KitsとAlkaline Phosphatase Labeling Kitsに関しては、さらに分子量5,000以下の低分子標識も可能です。
・2タイプの標識方法
標識方法としてはアミノ基標識用のNH2タイプとスルフヒドリル基標識用のSHタイプの2種類のキットがあります。NH2タイプはN-hydroxysuccinimide(NHS)で活性化した試薬を用いており、タンパク質等のNH2基を標識することができます。SHタイプはMaleimide基で活性化しており、還元抗体などSH基を有するサンプルの標識に利用することができます。使用されるサンプルの特性に合わせお選びください。
免疫組織染色・ELISA・ウエスタンブロット用
| 品名 | 容量 | 本体価格(¥) | メーカーコード |
| Peroxidase Labeling Kit - NH2 | 3 samples | 17,000 | LK11 |
| Peroxidase Labeling Kit - SH | 3 samples | 17,000 | LK09 |
Peroxidaseは酵素免疫測定において一般的な検出用酵素で、ELISAやイムノブロッティングなど、多くの手法に用いられ、特に免疫組織化学的手法に適しています。
<実験例:ウエスタンブロット>
リン酸化チロシンBSAをSDS-PAGEで泳動した後、ニトロセルロース膜に転写し、Peroxidase Labeling Kit - NH2で作製したHRP標識抗リン酸化チロシン抗体を用いて検出した。2次抗体を用いた間接法に比べ、より高感度な検出が可能であった。
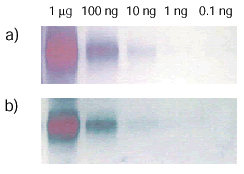 |
リン酸化チロシンBSAのウエスタンブロット(それぞれTMB発色) a)Peroxidase Labeling Kit - NH2を用いて標識したHRP標識抗リン酸化チロシン抗体で検出(直接法) b)抗リン酸化チロシン抗体/HRP標識2次抗体で検出(間接法) |
| 品名 | 容量 | 本体価格(¥) | メーカーコード |
| Alkaline Phosphatase Labeling Kit - NH2 | 3 samples | 21,000 | LK12 |
| Alkaline Phosphatase Labeling Kit - SH | 3 samples | 21,000 | LK13 |
Alkaline Phosphataseはペルオキシダーゼと並び酵素免疫測定に汎用されている酵素です。化学発光を利用した検出法は感度に優れており、特にブロッティングや組織染色に広く利用されています。
| 品名 | 容量 | 本体価格(¥) | メーカーコード |
| Biotin Labeling Kit - NH2 | 3 samples | 12,000 | LK03 |
| Biotin Labeling Kit - SH | 3 samples | 12,000 | LK10 |
ビオチン-アビジン複合体を用いたシステムはEIAなどの免疫学測定や組織染色の分野で広く利用されており、目的に応じ、酵素または蛍光標識されたアビジン、ストレプトアビジンと反応させることが出来ます。
免疫組織染色・フローサイトメトリー用
| 品名 | 容量 | 本体価格(¥) | メーカーコード |
| Fluorescein Labeling Kit - NH2 | 3 samples | 21,000 | LK01 |
汎用性の蛍光色素であるフルオレセインを標識するためのキットです。FITCと同じ励起・蛍光波長で測定可能です。導入されるフルオレセイン数は、クエンチングが起こらないように最適化されています。
λ ex / em = 500 / 525 nm
<実験例:免疫組織染色>
モノクローナル抗ラットI-A抗原抗体(Serotec clone#MRCOX-6)100 μgをFluorescein Labeling Kit - NH2を用いてFluorescein標識し、ラット下顎骨を染色した。
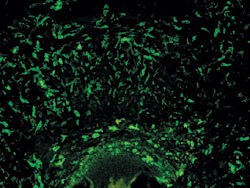
Fluorescein標識抗ラットI-A抗原抗体を用いて染色したラット下顎骨凍結切片の免疫組織染色像
(画像提供:東京医科歯科大学大学院医歯学総合研究科歯随生物学分野 揚光艶先生、川島伸之 先生)
| 品名 | 容量 | 本体価格(¥) | メーカーコード |
| HiLyte FluorTM 555 Labeling Kit - NH2 | 3 samples | 21,000 | LK14 |
| HiLyte FluorTM 647 Labeling Kit - NH2 | 3 samples | 21,000 | LK15 |
標識率がよく、蛍光強度の高い標識体が得られます。励起光による褪色も起こりにくく、他社の蛍光標識キットに比べ安価です。
HiLyte FluorTM 555 : λ ex / em = 555 / 570 nm
HiLyte FluorTM 647 : λ ex / em = 655 / 670 nm
フローサイトメトリー用
| 品名 | 容量 | 本体価格(¥) | メーカーコード |
| Allophycocyanin Labeling Kit - NH2 | 3 samples | 43,000 | LK21 |
| B-Phycoerythrin Labeling Kit - NH2 | 3 samples | 43,000 | LK22 |
| R-Phycoerythrin Labeling Kit - NH2 | 3 samples | 43,000 | LK23 |
| Allophycocyanin Labeling Kit - SH | 3 samples | 38,000 | LK24 |
| B-Phycoerythrin Labeling Kit - SH | 3 samples | 38,000 | LK25 |
| R-Phycoerythrin Labeling Kit - SH | 3 samples | 38,000 | LK26 |
蛍光タンパク(Phycobiliprotein)を標識するためのキットです。低分子の蛍光色素に比べ、1分子あたりの蛍光強度が高く、励起スペクトルの幅が広いため種々の波長で励起出来ます。
Allophycocyanin λ ex / em = 650 / 660 nm
B-Phycoerythrin λ ex / em = 564 / 575 nm
R-Phycoerythrin λ ex / em = 564 / 575 nm