|
|
受田 浩之 (Hiroyuki Ukeda) 高知大学農学部生物資源学科 |
|
|
受田 浩之 (Hiroyuki Ukeda) 高知大学農学部生物資源学科 |
[ Summary ]
Superoxide anion (O2-) is formed by one electron-reduction of molecular oxygen. It is a precursor of highly toxic hydroxyl radical and has a high reactivity with nitric oxide to form peroxynitrite. The detection of unstable O2- is generally based on indirect method using a probe which can trap O2- to result in any chemical change. There are several kinds of probes for O2- such as colorimetric, spin trapping, fluorimetric and chemiluminometric probe. Among them, colorimetric probe is the most convenient one because of no need for special instrument. Instead of its convenience, the conventional colorimetric probes such as cytochrome c and NBT has a drawback in the selectivity. In order to overcome the problem, we examined some water-soluble tetrazolium salts which have been recently synthesized and found that WST-1 shows a satisfactory property as colorimetric probe because of the reactivity with O2- and the selectivity.
In the present article, I describe the reaction mechanism of WST-1 with O2- and application of WST-1 to detect O2- derived from biochemical materials such as animal homogenates, microalgae and yeast and to estimate the scavenging activity of O2- which the enzyme superoxide dismutase and some bioresources including food components have.
キーワード:スーパーオキシドアニオン、WST-1、SOD、抗酸化能
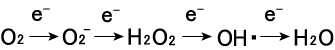 | (1) |
このうち不対電子を有するスーパーオキシドアニオン(O2-)とヒドロキシルラジカル(OH・)は寿命が短く(平均寿命:O 2-は5s、OH・は200 ms)3)、反応性が高い。特に、OH・は活性酸素種の 中でも最も高い反応性を有しており、生体内の様々な物質とほと んど拡散律速で反応する。O2-はOH・と比べれば反応性は低いが、OH・の前駆体であると共に、一酸化窒素(NO)と反応して、NOの持つ生理作用(血管弛緩作用など)を消失させる。従って生体 内で、大量のO2-やOH・が生成する環境が整えば、生体は恒常性 を維持することが困難になり、ヒトの場合、様々な病気を発症す ることとなる。つまり酸素の毒性は、酸素の還元で生成する活性 酸素種の仕業であると言える。
本稿では、好気性生物の生命現象に深く関わる活性酸素種のう
ち、特に酸素の1電子還元で生じるO2-に注目し、その検出法の
概略を述べた後、最近開発された簡易な発色検出法(WST-1法)
について紹介する。さらにその検出法の様々な分野における応用
について、最近の著者の研究を中心に解説していきたい。
短寿命で、かつ分光学的な特徴に乏しいO2-を直接的に検出することは難しい。そこで、短寿命のO2-を種々のプローブと呼ばれる化合物と反応させ、より長寿命で検出しやすい化学種に変換 する間接法が一般的に用いられる。
そのうち、O2-との反応で色の変化へと導く吸光光度法が最も簡 便な方法として広く用いられている。この目的に汎用されている 発色プローブはシトクロムcとニトロブルーテトラゾリウム塩 (NBT)である4)。シトクロムc還元法によるO2-の検出は、酸化型シトクロムがO2-によって還元されると550nmに強い吸収をもつ還元型に変わることを利用した方法である(モル吸光係数2.1 ×104 M-1cm-1)。しかしながらシトクロムcはO2-以外にNADPHレダクターゼなどの還元酵素や様々な還元性物質によって還元される。さらにシアン化物イオンもシトクロムcとの反応性を有す る5)。一方、NBT還元法はNBTがO2-により還元され、水不溶性のブルーホルマザン(吸収極大560nm)を生じることを利用し たものである(モル吸光係数2.54×10 4 M-1cm-1)。水不溶性であることから、長時間の分析では不均一な分散が生じてしまう。ま た、NBTはキサンチンオキシダーゼ(XO)やグルコースオキシ ダーゼなどの酸化酵素の還元型中間体と直接的に反応することか ら6)、シトクロムcと同様に選択性に問題がある。
これに対して、スピントラップ剤を用いた電子スピン共鳴 (ESR)法は特異性の高い方法である。O2-のシグナルを室温にお いて溶液中で直接的に観測することはできないが、スピントラッ プ法を用いることで間接的に測定可能である。現在用いられてい る汎用性の高いスピントラップ剤は5,5-ジメチル-1-ピロリン N-オキシド(DMPO)である。O2-を捕捉したDMPOは特徴的なESR スペクトルを示すので、従来法の中でESR法は最も特異性の高い 方法と言える。DMPOのO2-付加体は半減期が約50秒で、寿命 の短いO2-を安定に分析できる。しかしながらESR法は測定に比 較的大型の装置を必要とすることから、簡便性に欠ける。
最近、ヒドロエチジンを用いたO2-の蛍光検出法が開発されている7)。 ヒドロエチジンはO2-によって蛍光性のエチジウムに酸化されると考えられていたが、実際の生成物はHPLCでエチジウム と異なる保持時間を有することが明らかにされた。生成物の構造 に関して詳細は明らかではないが、その生成物はO2-との反応で特異的に生じることが証明されており、本原理によりO2-の特異的な蛍光検出が可能となる。
上記吸光光度法(シトクロムc)、ESR法(DMPO)と蛍光法
を表皮細胞の発生するO2-の検出に対して比較したところ、それ
らの間に大きな検出感度の差は認められなかった8)
。これらの方法に対して、化学発光プローブを用いる化学発光法は、一般的に、よ
り高感度なO2-の検出が可能である。プローブとして汎用されて
いるのはウミホタルルシフェリン類縁体(MCLA)とルシゲニン
である。但しルシゲニンは表皮細胞にNADHやNADPHなどの
電子供与体が共存している系では、O2-を2次的に発生させ、正
の誤差を与える。一方、MCLAはO2-だけでなく一重項酸素とも
反応性があること、溶存酸素と反応してバックグラウンド発光を
示すこと、さらに遷移金属イオンにより酸化反応が促進されるこ
となど、取り扱いには細心の注意を要する。
3. WST-1とO2-との反応
上述のように様々な方法がO2-の検出法として報告されているが、ハードの簡便さ、O2-に対する特異性、検出感度の高さのすべての面で満足のいく方法は確立されていない。装置的には吸光光 度法が最も簡便性が高いため、著者らは発色プローブとしてO 2-に対する特異性の高い試薬をスクリーニングすることにした。そ の結果、1993年から97年にかけてIshiyamaらが合成した水溶 性テトラゾリウム塩9)がO2-に対する高い反応性と優れた特異性 を有していることを明らかにした4)。現在、そのうちWST-1(Fig.1)が広くO2-の発色プローブとして利用されている。WST- 1は水に対して数十mMオーダーの溶解性を有するテトラゾリウ ム塩である。酸化型は無色であるが、還元を受けると438 nmに極大吸収が現われ、特徴的な黄色を呈する(モル吸光係数1.1× 104 M-1cm-1)。従来の発色プローブであるNBTはその欠点とし て、XOやグルコースオキシダーゼの還元型中間体と反応して、ホ ルマザンを生成するが、WST-1はこれらの酵素の中間体とは相互 作用しない10)。したがってNBTよりもO 2-の検出に適した発色プローブである。
OritaniらはWSTとO2 -の反応を詳細に解析している11)。サイクリックボルタンメトリーによる電気化学的な酸化還元挙動の解 析から、WSTは2段階で還元されることが示されている(Fig.1)。1段階目の還元は1電子還元反応で、テトラゾリニルラジカルを生 成する。本反応の還元電位は-0.20 V(対銀−塩化銀電極)で、この反応はpHに依存しない。2段階目の還元電位は-0.47 V(対銀−塩化銀電極)で、生成物としてホルマザンを与える。この2段 階目の反応はpHに対する依存性が強い。第1段階の還元電位が O2/ O2-の酸化還元対の式量電位よりも正なので、熱力学的に見て もWSTはO2-によって還元される。
WSTとO2-の反応は次の(2)式に従い進行する。WST-1の 酸化還元挙動からこの反応は次の2つの素反応(3)と(4)から 成ると考えられる。このうち(4)の反応は水中では極めて迅速に 進行し、
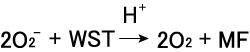 | (2) |
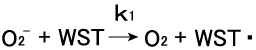 | (3) |
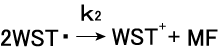 | (4) |
全体の反応の律速段階は(3)の反応である。ストップトフロー法
で詳細に解析された(3)の2次反応速度は3〜4×104のオーダーである。なお(3)の反応は酸素濃度に依存しないことから、逆反
応、すなわちWSTラジカルから新たにO2-が生じる反応は起こ
らないと考えられる。本反応速度は従来のNBT(6〜7×104M-1s-1)と比べると若干小さいが、オーダー的には差はない。また
ホルマザンのモル吸光係数としてはNBTの1/2〜1/3の程度であ
るが、モノテトラゾリウムとしての性質、水に対する溶解性など
から考えて、WST-1はNBTよりもO2-の発色プローブとして優
れていると言える。
4-1 生体試料の発生するO2 -の検出
WST-1のO2-検出能を、種々の生体試料に応用した例がこれま でにいくつか報告されている。Tanらは、刺激を与えた好中球の 生産するO2-の検出にWST-1を適用し、従来法であるフェリシ トクロムc法と比べてWST-1法は、バックグラウンドが低く、吸 光度の変化率が高いこと(約2倍)、またO2-を特異的に消去し得る酵素スーパーオキシドジスムターゼ(SOD)を共存させた際の ホルマザンの生成がほとんど完全に抑制される(98%、フェリシ トクロムcでは88%)ことから、O2-に対する特異性が高いこと を明らかにしている12)。
免疫細胞と同様に、海洋の赤潮プランクトンの中にもO2-を細胞外に放出するものが報告されている。著者らは、 Chattonella antiqua、Chattonella marina、Heterosigma akashiwo、Skeletonema costatum、Gymnodinium mikimotoiについて、WST-1によるO2-の検出を試みると共に、本法の赤潮プランクト ン細胞数計測への応用について検討した13)。はじめに、培地への WST-1の添加がプランクトンの生育に与える影響を調べたとこ ろ、添加の有無で、すべてのプランクトンの生育に差は認められなかった。 次に、プランクトンが増殖したWST-1添加培地の可視吸収スペクトルを測定したところ、Chattonella属、及びH.akashiwoの培養液で増殖に伴い、WST-1ホルマザンに特徴的な438nmの吸収極大が出現した。 さらにこの吸収の増大は、培地にSODを添加することで有意に減少することも明らかとなった。 これらの3種類のプランクトンはO2-を生産することがこれまで に他の方法で確認されていることから、WST-1は赤潮プランクト ンの生産するO2-を検出できることが示唆された。今後、赤潮プ ランクトンの生態解明に対して、本法の利用価値は高いと考えら れる。また検出感度をさらに向上させることができれば、フィー ルドにおける赤潮プランクトンの検出にも適用できると期待され る。
一方、Tsukataniらは酵母を2,3,5,6-テトラメチル-1,4-ベンゾ
キノンと共存させた後(pH
7.0)、そのpHを9.8に上げると、酵母の呼吸活性によって生成していたセミキノンラジカルの自動酸
化に伴い、O2-が生成することをESRを用いて証明している
14)。
ここにWST-1を共存させると、そのO2-検出能によって、間接的に酵母の呼吸活性を測定できる。
この呼吸活性は当然、酵母の生細胞数と正の相関があり、WST-1の吸光度変化により、1.0×105から2.0×107細胞/mlの細胞数測定が可能である。酵母が直接O2-を生成するわけではないが、酵母の呼吸活性によって二次的に
生成したO2-を間接的に捉える方法であることから、本法はO
2-の検出を応用した新しい細胞計測技術と言える。
O2-の生成は様々な酵素反応で認められる。しかしながら、生体
内では、酵素に依存しない化学反応でO2-が生成する場合がある。
その典型的な例が、タンパク質のアミノ基と糖のカルボニル基と
の間で起こるメイラード反応である15)。
酵素がメイラード反応を受けると触媒活性にかかわる官能基が化学修飾され、その活性が低下する。
またメイラード反応生成物が細胞のアポトーシスを誘導することもある16)。
さらに反応と同時に生成するO2-をはじめとする活性酸素種が、生体内の酸化ストレスを亢進させている。
著者らはメイラード反応で生じるO2-のモニタリングにWST-1を適用した17,18)。各種カルボニル化合物をNa-アセチルリジンと37℃で2日間反応させ、試料とした。
この溶液0.4mlに2mMWST-1を含むリン酸塩緩衝液1.0mlを添加し、10分毎に438nmの吸光度を測定すると、カルボニル化合物の種類、濃度に依存してホルマザンの生成に伴う吸光度の増加が認められた。
その吸光度の増加は、反応液にSOD、あるいは同様にO2-の消去能を有する
Tironを共存させると86〜100%阻害されたので、ほとんどがメイラード反応に伴って生成したO2-に依存していることが示唆さ
れた(Fig.2)。同様の実験をシトクロムcで行ったところ、シトクロムcの吸収はSODやTironの共存で、21〜40%しか阻害さ
れなかったことから(Fig.3)、メイラード反応系のO2-の検出においても、WST-1がシトクロムcよりも優れた検出プローブであ
ることが明示された。次にメイラード反応系に直接WST-1を共存
させてO2-の検出を試みた。反応の経過に伴い、438
nmの吸収が増大したが、Tironの共存系では85%まで、その吸光度変化が
抑えられ、共存系でもWST-1はO2-に対して高い特異性を示す
ことが明らかとなり、リアルタイムでのO2-のモニターが可能で
あることが明らかとなった。カルボニル化合物はそれ自体でも自
動酸化に伴いO2-を生成することが報告されているが、同様に
WST-1はカルボニル化合物単独でのO2-の生成も検出できる。シ
トクロムc法との比較から、トレオースやエリスロースなどの関
与するメイラード反応では、従来考えられていたよりも3倍〜4倍
のO2-が生産されていることが明らかとなった(Table 1)。
酸化酵素の中には、XOのように反応に伴い、O
2-を生成するものがある。WST-1はO2-
を簡便に検出できることから、著者らはその反応を指示反応として利用すれば、簡易でかつ高感度な新し
いタイプの酵素分析法を構築できると考えた。そこで、まずモデ
ル系として、代表的なO2-生成酵素であるXOを用いたヒポキサンチンの新しい検出システムを試作した
19)。WST-1と酸素濃度を一定にして、ヒポキサンチン濃度に依存したO
2-の生成と、それに伴うWST-1ホルマザンの生成を438
nmの吸光度変化からモニターする(Fig.4)。
測定にはフローインジェクション分析(FIA)法を用いた。本システムでは臭化シアン活性化SepharoseにXO
とカタラーゼ(XOの安定性を向上させるため)を同時に固定化
し、カラムに充填してリアクターとした。試料(ヒポキサンチン)
はWST-1溶液と予め9対1の比率で混合し、キャリヤー溶液中
に注入した。標準のヒポキサンチン溶液に対する応答を指標に
キャリヤー溶液中のpHと流量、並びに試料と共に注入するWST-
1濃度の最適化を行い、それぞれ10.2、0.4 ml/min、並びに20
mMに設定した。本条件では、2.5 mM〜1.0
mMの範囲でピーク高とヒポキサンチン濃度との間に直線関係が認められた。繰り返
し測定の結果得られた変動係数は1%以下(0.5 mM;
n=10)であり、1時間当たり30検体の分析が可能であった。魚肉のヒポキサ
ンチン含量をHPLC法と比較した結果、両者の間には良好な直線
的相関(r=0.9994; n=16)が認められた(Fig.5)。酵素リアクターは500回の繰り返し測定、並びに5℃での3ヶ月間の保存後も活
性の低下傾向を示さなかった。
次に補酵素NADHの酸化を触媒するNADHオキシダーゼ
(NOD)をO2-生成酵素として利用することとした20)。この目的のためにBacillus
licheniformis由来のNODを用いた。本酵素反応では、NADHの酸化に伴い、WST-1ホルマザンが生成した。さ
らにその生成が酸素濃度に依存し、SOD及びTironの添加で阻害
されたことから、ホルマザンの生成にO2-が関与していることが
明らかとなった。最適pHである9.0でNADHの定量性を調べた
ところ、終濃度0.5〜50mMの範囲で、NADH濃度と438
nmの吸光度の間に直線関係が認められた(Fig.6)。さらに本反応を指示反応とすれば、各種脱水素酵素反応と共役させることで、その基
質の定量法を構築することができる。例として、アルコール脱水
素酵素(ADH)と組み合わせたエタノールの定量系を検討した(Fig.7)。
最適反応条件におけるエタノールの定量範囲は0.067〜16.8mMで、各種アルコール飲料(ビール、焼酎、日本酒、ウイスキー)について本反応系を適用したところ、得られた分析結果は、市販の酵素分析法であるF-Kit法の分析結果と良好に一致する
ことが明らかになった。今後、NODを指示反応として、様々な脱水素酵素の基質定量系を構築していきたいと考えている。
上述のようにWST-1は簡便で比較的特異性の高いO 2-の検出プローブである。この性質を利用すれば、WST-1をO 2-の消去活性の測定にも利用できる。生物はO 2-の毒性から身を守るために、O2-の反応性を低下させる様々な防御系を備えている。その最も代 表的なものが酵素SODである21)。本酵素はO 2-を酸素と過酸化水素に不均化する反応を触媒する(式5)。酸化ストレスに対する 第一防御ラインを担う重要な抗酸化酵素の一つであるが、
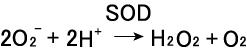 | (5) |
さらに生物の寿命を決定する因子であることがCutlerらによって
指摘され、その活性に関する知見が様々な生命現象の解明に重要
な意義を有すると考えられている。
WST-1を用いたSODの活性測定法の原理をFig.8に示す10)。SODの基質となるO2-の発生には、酵素XOによるキサンチンの酸化反応が利用される。
反応溶液には生成したO2-を検出するためにWST-1を共存させておく。
試料を添加していないときのWST-1の色の変化(ホルマザンの生成量)をコントロールとして、各試料を添加した際のホルマザン生成の抑制率をその試料が示す阻害率として表現する。
通常、各試料が50%の阻害を示す濃度(IC50)を各試料の活性評価に利用する。一方、本活性測定法にお
いて発生したO2-は自発的な不均化反応で酸素と過酸化水素に変化している。
この自発的な不均化反応は酸性領域で速く、生理的pH付近(7〜8)での速度は8.5×105〜8.5×104M-1s-1である。したがってSOD測定は一般にアルカリ領域(例えばpH 10.2)
が好んで使われる。最適化されたアッセイ条件で得られたSODの
阻害曲線をFig.9に示す。前述のようにWST-1はXOの還元型と
相互作用しないことから、SODの阻害曲線が100%に到達する。
またIC50を示すSOD濃度がアッセイpHに大きく依存せず、一定
の値を示す。これらの特徴から本WST-1法は、従来のテトラゾリ
ウム塩を用いたSOD活性評価法の問題点を完全に克服した理想的
な方法であると言える。現在、本測定原理に基づいて、マイクロ
プレートでの多検体測定を可能としたSOD Assay Kit-WSTが同仁化学研究所から市販されるに至っている。
本測定キットを用いてSOD標品のIC50を求めると2.0units/ml以下である。この濃度から考えて、本測定キットは標準SODに対してESR法の2倍以上の検出能を有する。
WST-1法に基づいたSODアッセイは様々な生体試料のSOD
活性測定に利用されている。最近の論文からいくつかの例を紹介
する。SakudoらはSOD活性に与えるプリオンタンパク質の影響
を調べるために、マウスの脳、及び睾丸の細胞ホモジネートの
SOD活性を本WST-1法によって測定した22)。またHakkinenら
は魚(カマス)稚魚に対する紫外線(UV-B)毒性を調べるために、
そのホモジネートのSOD活性をWST-1法を用いて測定している23)。
一方、生物におけるMn-SODの意義を考える上で興味深い研究が本法を用いて展開されている。
従来、Mn-SODは生命活動を維持
する上で必須と考えられていたが、Ikegamiらは最近、臓器特異
的にMn-SODを欠損したモデルマウスを作製し、肝臓のMn-
SODがマウスの生命活動に必須ではないことを明らかにしている
24)。彼らはそのモデルマウスの肝臓がMn-SODを欠損していることを、
WST-1法を用いて証明した。植物に関してもいくつかの報告があ
る。一つは、異なる栽培条件で得られたトマト、ナスの根のホモ
ジネートが有するSOD活性を測定した例である25)。
もう一つは、Germinと呼ばれる熱安定性のタンパク質のキャラクタリゼーショ
ンに関する研究である26)。Germinはコムギの発芽時に特異的に
発現するタンパク質で、過酸化水素を生成するシュウ酸酸化酵素
である。WooらはこのGerminがMnを保持し、SOD活性を有することを、WST-1法を用いて明らかにしている。この結果から、
かれらはGerminが細胞外で発生したO2-の消去作用を担ってい
ることを示唆している。一方、ShimasakiらはWST-1法を用いて、未変性状態のSODを等電点ゲル電気泳動で分離し、ゲルごと
WST-1とインキュベートすることで、その活性を測定できること
を示している27)。彼らはこの方法で、ほとんど活性のロス無く
SODを回収できることを報告している。
SODはO2-を不均化して、その毒性を低減するが、天然には不 均化とは異なる機構でO2-の反応性を低下させるいわゆる抗酸化 物質が存在している。例えば、アスコルビン酸はO2-の不対電子を捕捉して、自らはモノデヒドロアスコルビン酸へと変化する。さ らにその2分子が不均化してアスコルビン酸とデヒドロアスコル ビン酸に変わる。このようなラジカルの捕捉活性もSODの活性測 定と同じ原理で評価できる。このようなO2-の反応性を低下させ る作用をO2-消去活性(superoxide anion-scavenging activity:SOSA)と呼ぶ。
現在、SOSAを有する食品成分は老化や各種生活習慣病の予防 に対して重要な意義を持つと考えられている28) 。そのような活性を示す食品成分として、野菜などの植物素材に含まれるアスコル ビン酸やフラボノイド、ワインやお茶に含まれるポリフェノール 類を挙げることができるが、カゼイン29)や魚肉タンパク質30)由来のペプチドからもその活性が確認されている。今後、様々な食品、及び生物素材から新しいSOSA物質が発見される可能性も高く、機能性食品素材や医薬資源の開発分野で大きな注目を集めている。
そこで著者らはWST-1法を食品の有するSOSA評価に適用し
てみることにした。最初に試料として、これまでの研究でSOSAを示すことが明らかにされている各種嗜好性飲料を用いることに
した31)。それらの試料には様々な還元性物質が含まれていること
から、O2-が介在することなく、各試料が直接WST-1を還元する
程度を、XO溶液の代わりに緩衝液を添加することで測定した。予
想通り、希釈していない各種嗜好性飲料をWST-1と共存させる
と、O2-の関与しない食品試料による直接的なWST-1の還元が起
こることが観察された。この非特異的な妨害反応を抑えるために、
各試料の複数の希釈系列を調製してWST-1に対する非特異的な還
元の程度を調べた。コントロールの吸光度変化に対して、妨害物
質であるWST-1還元性物質に由来する吸光度変化が10%以下で
あればその妨害が無視できるレベルであると考えると、その希釈
倍率は赤ワインで20倍、緑茶で100倍、ココアで30倍、インス
タントコーヒーで30倍であった。次にSOD Assay
Kit-WSTを用いて各食品のSOSAを測定した(Fig.10)。各試料が50%阻害を示すときの希釈倍率は、赤ワインで180〜230倍、緑茶で3000倍、ココアで230倍、インスタントコーヒーで210倍であった。
これらの希釈倍率では各試料で認められたWST-1還元性物質の影
響はコントロールの吸光度変化の3%以下であり、その妨害は全く
問題にならないことが判明した。SOD標品のIC50
を基準にして求めた各食品試料のSOSAをTable.2に示した。ESRで得られた値と比較して、WST-1で得られたSOSA値はワイン、緑茶では
低く、インスタントコーヒーでは高い値を示した。またココアの
値は両者の方法で良好に一致している。両者の方法が異なるアッ
セイpHで行われていることと、全く異なるO2
-の検出プローブを用いていることを考え合わせると、ここで得られた両者の測定値
間には比較的高い一致性があると考えられる。
次に本WST-1法を用いて、高知県産食品についてSOSAの測 定を試みた32)。用いた食品試料とそのエタノール抽出物が示したSOSAを合わせてTable.3に示す。 これらの抽出物に関して、同時にESR法でもSOSAを測定しWST-1法の結果と比較してみた。 両者の測定結果の間には相関係数0.958の高い正の直線的相関が認められた。 このことは嗜好性飲料以外の様々な種類の食品 に対して、本WST-1法がESR法と高い相関を与え、様々な食品 素材のスクリーニングに対して本法が幅広い適用性を有している ことを示す。測定結果に注目すると、2つの茶葉、すなわちギャバ ロン茶と碁石茶が極めて高い活性を示した。同様の条件で測定し た緑茶よりもこれらの茶葉は高い活性を示したことから、今後こ れらの食品を付加価値の高い地域資源として育てていきたい考え ている。
一方、SOD Assay Kit-WSTはマイクロプレートでの多検体同時分析が可能で、かつ測定に要する試料量が極めて少なくてすむ(20 ml)。 従って、SOSAの活性成分を分画し、構造解析を進めて いくには有用である。著者らは、この特徴を利用して、イワシす り身のプロテアーゼ加水分解物の有するSOSAを追跡し、各種ク ロマトグラフィーにより、活性成分の単離を試みている 33)。
他にも植物由来のアントシアニン 34)、並びにマイクロアルジェ由来のフィトケラチン 35)のSOSAがWST-1法を用いて測定されている。
WST-1を用いたO2-の検出を基軸として、その多様な応用例を
紹介してきた。WST-1はこれまでに開発されたO2-の発色プローブとしては、最も選択性が高く、かつ簡便性の高い試薬である。
その特徴が認められて、すでにSODの活性評価法としては、世界的な地位を築きつつある。
今後は本WST-1法で得られたO2-の検出やSOSA測定の成果が新たな生命現象の発見や、新しい機能性食品の創製に貢献していくことを期待したい。
参考文献
1) 今田伊助、佐藤英介、井上正康、化学と生物、 37, 411 (1999).
2) 五味不二也、松尾光芳、老化と環境因子、松尾光芳編、pp. 113-127、学会出版センター、東京、1994.
3) 佐野浩亮、内海英雄、化学と生物、 37, 328 (1999).
4) 受田浩之、Dojin News, 96, 1 (2000).
5) A. Okado-Matsumoto and I. Fridovich, Anal. Biochem., 298, 337 (2001).
6) H. Ukeda, S. Maeda, T. Ishii and M. Sawamura, Anal. Biochem., 251, 206 (1997).
7) H. Zhao, S. Kalivendi, H. Zhang, J. Joseph, K. Nithipatikom, J, Vasquez-Vivar and B. Kalyanaraman, Free Rad. Biol. Med., 34, 1359 (2003).
8) M. A. Barbacanne, J. P. Souchard, B. Darblade, J. P. Iliou, F. Nepveu, B. Pipy, F. Bayard and J. F. Arnal, Free Rad. Biol. Med., 29, 388 (2000).
9) 石山宗孝、Dojin News, 82, 10 (1996).
10) H. Ukeda, D. Kawana, S. Maeda and M. Sawamura, Biosci. Biotech. Biochem., 63, 485 (1999).
11) T. Oritani, N. Fukuhara, T. Okajima, F. Kitamura and T. Ohsaka, Inorg. Chim. Acta, 357, 436 (2004).
12) A. S. Tan and M. V. Berridge, J. Immunol. Methods, 238, 59 (2000).
13) 受田浩之、坪内美樹、深見公雄、沢村正義、投稿準備中.
14) T. Tsukatani, T. Oba, H. Ukeda and K. Matsumoto, Anal. Sci., 19, 659 (2003).
15) H. Ukeda, Y. Hasegawa, Y. Harada and M. Sawamura, Biosci. Biotech. Biochem., 66, 36 (2002).
16) H. Sekido, T. Suzuki, T. Jomori, M. Takeuchi, C. Yabe-Nishimura and S. Yagihashi, Biochem. Biophys. Res. Commun., 320, 241 (2004).
17) H. Ukeda, T. Shimamura, M. Tsubouchi, Y. Harada, Y. Nakai and M. Sawamura, Anal. Sci., 18, 1151 (2002).
18) H. Iwata, H. Ukeda, T. Maruyama, T. Fujino and M. Sawamura, Biochem. Biophys. Res. Commun., 321, 700 (2004).
19) A. K. Sarker, H. Ukeda, D. Kawana and M. Sawamura, Anal. Sci., 15, 1141 (1999).
20) A. K. Sarker, H. Ukeda, D. Kawana and M. Sawamura, Food Res. Int., 34, 393 (2001).
21) 受田浩之、食品酵素化学の最新技術と応用-フードプロテオミクスへの展 望-、井上國世監修、pp. 184-191, シーエムシー出版、東京、2004.
22) A. Sakudo, D. C. Lee, K. Saeki, Y. Nakamura, K. Inoue, Y. Matsumoto, S. Itohara and T. Onodera, Biochem. Biophys. Res. Commun., 308, 660 (2003).
23) J. Hakkinen, E. Vehniainen and A. Oikari, Aquatic Toxicol., 66, 393 (2004).
24) T. Ikegami, Y. Suzuki, T. Shimizu, K. Isono, H. Koseki and T. Shirasawa, Biochem. Biophys. Res. Commun., 296, 729 (2002).
25) K. H. R. Lin, C. C. Weng, H. F. Lo and J. T. Chen, Plant Sci., 167, 355 (2004).
26) E. J. Woo, J. M. Dunwell, P. W. Goodenough, A. C. Marvier and R. W. Pickersgill, Nature Struc. Biol., 7, 1036 (2000).
27) Y. Shimasaki, H. Ohnishi, S. Matsuura and T. Manaba, Biochim. Biophys. Acta, 1571, 245 (2002).
28) T. Finkel and N. J. Holbrook, Nature, 408, 239 (2000).
29) K. Suetsuna and H. Ukeda, J. Nutr. Biochem., 11, 128 (2000).
30) 末綱邦男、受田浩之、日水誌、 65, 1096 (1999).
31) 受田浩之、森山洋憲、川名大介、片山泰幸、中林錦一、沢村正義、食科工、 49, 25 (2002).
32) 森山洋憲、片山泰幸、中林錦一、受田浩之、沢村正義、食科工、 49, 679 (2002).
33) 森山洋憲、片山泰幸、受田浩之、沢村正義、筬島克裕、松井利郎、松本清、 食科工、50, 392 (2003).
34) 森山洋憲、森田善彦、受田浩之、沢村正義、寺原典彦、食科工、 50, 499 (2003).
35) N. Tsuji, N. Hirayanagi, M. Okada, H. Miyasaka, K. Hirata, M.H. Zenk and K. Miyamoto, Biochem. Biophys. Res. Commun., 293, 653 (2002).
| 著者紹介 | |
| 氏 名 | 受田 浩之(Hiroyuki Ukeda) |
| 所 属 | 高知大学農学部生物資源科学科助教授 |
| 連絡先 | 〒783-8502 南国市物部乙200 Tel&Fax: 088-864-5189 E-mail: hukeda@cc.kochi-u.ac.jp |
| 出身校 | 九州大学大学院農学研究科 |
| 学 位 | 農学博士 |
| 専 門 | 食品化学、食品分析学、食品機能学 |
| 趣 味 | スポーツ(野球) |
SOD Assay Kit-WST
<特長>
●100% SOD阻害率を測定することができる。
●ホルマザンの溶解操作が不要で、操作が簡単である。
●一度に多検体の測定が可能である。
SOD Assay
Kit-WSTは、高水溶性ホルマザンを生成するテトラゾリウム塩WST-1を使用しているため、ホルマザンの溶解操作は不要です。
また、WST-1はxanthineoxidase(XO)と直接反応しないため、100% SOD阻害率を測定することができます。
また96穴マイクロプレート対応なので、一度に多検体の測定が可能となっています。
| 品名 | 容量 | 本体価格(¥) | メーカーコード |
| SOD Assay Kit-WST | 500 tests | 19,000 | S311 |