 | 楠 文代 (Fumiyo KUSU) 東京薬科大学 薬学部 |
| 電流検出による酸の計測 Amperometric Determination of Acids |
 | 楠 文代 (Fumiyo KUSU) 東京薬科大学 薬学部 |
Summary
A new method for determining acids was developed based on measurement of reduction prepeak current of 2-methyl-1,4-naphthoquinone (VK3) in ethanol solution. The instrumentation by voltammetry, flow injection analysis (FIA) with electrochemical detection and High-performance liquid chromatography (HPLC) with electrochemical detection was capable of measuring acids. Prepeak height on the voltammogram obtained in ethanol solution containing acid, 3 mM VK3 and 38 mM LiClO4 was found to be linearly related to acid concentration at 8μM to 6 mM. FIA response was linear between 25 to 1500 pmol of acid. FIA was found not only sensitive, but also to be simple and rapid. Acid values of fats and oils, titrable acidity of coffee, and enzyme activity of lipase were determined. Free fatty acids in a soya bean oil were determined by HPLC using an ODS column, the mobile phase of ethanol-acetonitrile (10:90) mixture, and a VK3 ethanol solution containing LiClO4. The present method is practically useful for acid determination of samples in various fields.
一般的な酸の測定としては、ガラス電極を指示電極とする電位差測定によるpH測定法と、アルカリによる中和滴定法が知られている。しかしながら、前者では酸塩基平衡(HA H++A-)におけるH+の平衡濃度すなわち酸性度が、また後者はHAとH+のそれぞれの平衡濃度の和が測定の対象であって、計測の目的に応じて両者が使い分けられている。狭義の意味で酸の定量とは、後者の総酸濃度の測定を指している。中和滴定は多くの分野で利用されており、終点決定には特に指示薬や電位差測定が繁用されている。中和滴定は、強酸の試料、日本薬局方収載医薬品のような比較的高純度の試料では、高精度に定量できる。しかしながら、低濃度の弱酸、複数の酸を含む試料あるいは着色試料では、指示薬誤差を生じることがある。また、微量の試料を測定対象とする場合、中和滴定法が感度の点で必ずしも満足できる方法とは言い難い。また、アルカリ標準液を用いて滴定により求めた試料溶液の酸度を滴定酸度と呼び、実用的な分析法として知られる。この場合はHAとH+の総酸のみならず、試料に含まれる樹脂やタンパク質のような有機物への結合酸、あるいはアルカリによる加水分解を受けるエステル等を含むアルカリ消費物質の総和を表わす量であって、真の酸の濃度を示すものではない。
キノンは水あるいは2-メトキシエタノール中で還元されてハイドロキノンとなるが、酸が共存するとポーラログラムに還元前置波を生じる1)。この還元前置波を用いることで、ポーラログラフィーにより硝酸、硫酸、酢酸などの微量の酸が定量できることが1960年代に示された2, 3)。また1974年高田らは p-ベンゾキノンを用いた電量検出法によりカルボン酸の定量を行った4)。しかしながら、これらの方法は、実用的計測にその後進展しなかった。そこで我々は、キノンの電解を利用した酸の測定を基にして、従来法の中和滴定の難点を回避でき、かつ信頼性、実用性、汎用性の高い微量酸の新規定量法を開発し、その応用を図った。
一般にキノンは光に対して不安定であり、この傾向は、ベンゾキノンで著しい。一方、芳香環数の多いほど還元電位は負電位となり、水溶性に乏しくなる。従って、酸定量法の確立を目的とする本研究では、キノンとしてビタミンK3(2-methyl-1,4-naphthoquinone, VK3)、溶媒としてキノンの溶解度が大きい両性溶媒で、容易に入手できる、エタノールを用いた。ビタミンK3と微量の酸とが共存する系について、グラッシーカーボン電極を用いて電解を行った。Fig.1には、38mM LiClO4を含むエタノール溶液中で得たVK3のみ(曲線a)およびVK3とドコサヘキサエン酸(DHA)共存系(曲線b)のボルタモグラムを示した。曲線aにはキノンからハイドロキノンへの還元反応に基づく明瞭な還元波が見られる。酸が存在する曲線bでは、VK3の還元波よりもさらに正電位側に新しい波が現れ、これを還元前置波と呼んでいる。同様な現象は、ブロモ酢酸、ギ酸、酢酸、ノナン酸、パルミチン酸、オレイン酸、リノール酸、リンゴ酸、クエン酸、クロロゲン酸などの種々の酸の共存時にも見られる。Fig.2にはそれらの酸の数例を示した。
酸の当量濃度がVK3濃度の2倍以下の条件下では、還元前置波の波高(iH)は酸の濃度に比例する(Fig.3)。また還元前置波は強い酸ほど正側の電位に現れた。この様子を、Fig.4に還元前置波の半ピーク電位(EP/2)と水溶液中の酸解離定数Ka(Ka1)の関係として示した。従って高級脂肪酸のような弱酸であっても、還元前置波の波高の計測から微量酸の定量が可能である5, 6)。
酸の測定は、ボルタンメトリーあるいはフロー型電気化学検出を用いて行う。フロー型電気化学検出では、アンペロメトリー検出器を、簡易迅速な自動計測が可能なフローインジェクション分析(FIA)と分離定量が可能な高速液体クロマトグラフィー(HPLC)の2つのシステムの検出部として組み込み、これにより酸を定量した。
ボルタンメトリーでは、Fig.5の装置を用いて、作用電極にグラッシーカーボン電極を、電解質溶液として3.0mM VK3を含む38mM LiClO4のエタノール溶液を用いて、3電極式電位走査法で行った。初回の測定に先立ち、グラッシーカーボン電極表面をアルミナで研磨後、蒸留水およびエタノールで超音波洗浄してから用いた。測定溶液に酸素が溶存した場合、還元波が生じる可能性がある。38mM LiClO4エタノール溶液中で、その Ep/2はVK3の還元波よりもかなり負の電位であるが、-0.3 V vs SCE 付近の還元前置波の波高測定を精度良く行うには、測定溶液中の除酸素が必要である。VK3に代えて易還元性のキノンを用いると除酸素の操作は省略できる。通常のボルタモグラムの測定では、0 V から-0.4 V vs SCE の電位範囲を5mV/sの速度で掃引した。リノール酸のボルタンメトリーによる定量では、8.0×10−6〜6.0×10−3Mの範囲において濃度と電流iHは良い直線性(r=0.992)を示し、1.0×10−4Mの酸濃度で得たiHの相対標準偏差(R.S.D.)は、1.1%(n=10)であった5, 6)。
FIA装置には、Fig.6のように、内径0.5mmテフロンチューブ、ポンプ、サンプルインジェクター(5μl)、アンペロメトリー検出部からなる一流路系の装置を作製し、キャリヤー溶液にはVK3溶液を用いた。低速用ポンプを用いて流速は0.6ml/min とした。アンペロメトリー検出セルは、作用電極にグラッシーカーボン、対極にはステンレススチール、参照電極には銀−塩化銀電極あるいはSCEから構成し、有効セル容量は数μl とした。これにはグラッシーカーボン電極を組み込んだ市販の電気化学検出セルを利用することもできる7, 8)。リノール酸溶液5μl を試料として注入して測定したFIAシグナルの例を、Fig.7に示した。シグナルの再現性は良好であり(R.S.D.=1.4%、n=10)、1時間あたり60検体の測定を可能とした。FIAシグナルと酸量の間には、25〜1500pmolの範囲において良い直線関係(r=0.998)を得た7, 8)。
電気化学検出HPLCシステムでは、市販の高速液体クロマトグラフィー(HPLC)用ポンプ2基を用いて、カラムを用いた分離系とVK3溶液の送液系との2流路系とした。概略をFig.8に示す。高級脂肪酸分離のため、カラムにはODS、溶離液はエタノールとアセトニトリルの混合液、キノン溶液は6mMVK3と76mM LiClO4を含むエタノール−アセトニトリル混合液とした。これらの液はデガッサーを用いて除酸素を行って、送液した。検出部分はFIAと同様の構成である9)。
遊離脂肪酸の含量は、酸価と呼ばれる指標で表わされ、油脂の性質や品質を表すために食品、医薬、工業などの分野で重要視されている。酸価は油脂試料1gを中和するのに要する水酸化カリウムのmg数と定義されており10, 11)、従来の測定法は、フェノールフタレインを指示薬とする水酸化カリウムのエタノール液による中和滴定が用いられてきた。ここではキノンの還元前置波の波高計測から油脂に含まれる微量の遊離脂肪酸を定量し、これより酸価を算出した。
油脂の構成脂肪酸として、植物油中ではパルミチン酸、ステアリン酸、オレイン酸、リノール酸、リノレン酸の高級脂肪酸が、また、魚油については、これらに加えてエイコサペンタエン酸(EPA)やDHAが多く含まれている。従って油脂中の遊離脂肪酸は、ほとんどがこのような高級脂肪酸である。VK3のエタノール溶液にこれらの高級脂肪酸を添加すると、いずれの酸も同一の電位に還元前置波が現れて、単位濃度当たりのピーク高さはほぼ等しい。このため複数の遊離高級脂肪酸が存在しても、ボルタモグラムには一段の還元前置波が得られ、この波高は油脂中の遊離脂肪酸の総濃度に比例する。そこで、ボルタンメトリーおよびFIAにより、油脂の酸価測定を行った。
まず、油脂試料のエタノール溶液をLiClO4を支持電解質としたVK3を含むエタノール溶液に加えて、除酸素後、0Vから−0.4Vまで5mV/s の掃引速度で電位走査してボルタモグラムを測定した。次に、高純度のパルミチン酸あるいはリノール酸を酸の標準液として用いて、電解セル内に添加し、同様にボルタモグラムを測定した。この2つの還元前置波の波高から標準添加法により、油脂の酸価を算出した。
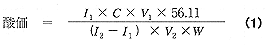
ここで、I1およびI2:試料および酸標準液添加後の還元前置波の電流値(μA)、V1およびV2:セル内の試料溶液および標準酸の添加後の溶液の体積(ml)、C:酸標準液の濃度(mM)、W:油脂試料の採取量(g)である。
FIAによる油脂酸価の測定では、まず、検出電位 -330mV vs. Ag/AgCl、流速 0.6 ml/min において、酸標準液を用いた検量線を作成する。油脂の試料はキャリヤー液と同じ組成のVK3エタノール溶液1ml に溶解して試料溶液とした。VK3エタノール液に混じり合わない油脂の場合、試験管内の両者をミキサーで充分撹拌してエタノール相中に遊離脂肪酸を移行させた後、遠心分離し、その上清を試料溶液とした。FIA装置には5μl の試料溶液を注入して、電流のFIAシグナルを記録し、これより遊離脂肪酸の濃度を求めて、酸価に換算した。
FIAおよびボルタンメトリーにより求めた油脂試料の酸価測定例をTable1に示す。表には、従来法であるフェノールフタレイン指示薬および電位差法による中和滴定より求めた酸価も示した。測定値はいずれもかなり近い値ではあったが、詳細に検討すると、本法と滴定法の値がほぼ一致する例と、指示薬法の場合に多少の指示薬誤差を生じる例があった。
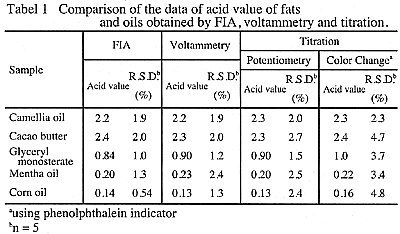
Fig.9に(A)ツバキ油および(B)さんま油を試料として、水酸化カリウムのエタノール溶液で滴定したときの滴定曲線を示した。図中の矢印 a はフェノールフタレイン指示薬法による終点、矢印 b は電位差法よる終点、矢印 c はFIAで求めた遊離脂肪酸の量を水酸化カリウムの消費量として換算した点に相当する。ツバキ油では a、b、cの三点が一致した。さんま油の場合は、bと cは一致したがaの指示薬の変色点は電位差滴定曲線のpH飛躍を過ぎている点であった。このことは、指示薬を用いる従来法では必ずしも適正な当量点を反映していないことがあり、また電位差滴定およびFIAの結果の一致から本法が信頼できる酸価測定法であることを、示すものであろう。精度の点ではFIAが電位差滴定法よりも若干優れていた12)。
本法は従来法よりも高感度であるので、試料の必要量について比較してみると、Table1ような酸価の小さい試料の場合、従来法では1回の測定当たり20gであるが、ボルタメトリーでは 0.5g、FIAでは0.02g程度である。肝油および精製魚油加工品を試料とし、製剤学で安定性を比較的短期に予測するために行われる加速試験として、FIAによる酸価測定を利用した実験を行った。Fig.10 には、油脂を40℃、湿度75%の容器内に保存し、1週間ごとに酸価を測定した結果を示した。この場合には1試料あたり数100mgで測定できたが、もしも従来法であれば200g以上を必要としそれに伴って保存容器も拡大する。このようにFIAを用いると、油脂の安定性を長期に亘って経時的に追跡する場合などには、特に有利である12)。
コーヒーやジュースなどの飲料には種々の有機酸が含まれており、酸の含量が味や品質の確保に重要な指標であるために、製造過程ではこれらの飲料の品質管理に酸の測定を行っている。酸含量を示すのに一般的に、滴定酸度が用いられており、これは中和滴定法によるアルカリ消費量を表している。ここでは飲料の例としてコーヒーについてFIAによる酸定量を紹介する。
コーヒー豆の細粉と蒸留水からコーヒーメーカーを用いて入れたコーヒーを試料として、これを3mM VK3 と38mM LiClO4を含むエタノール溶液で40倍に希釈したものを試料液とした。この液5μlをFIA装置に注入して、FIAシグナルを測定した。コーヒーには多種類の酸が含まれているので、酸の総濃度を表すFIAシグナルは、次式で表現される。
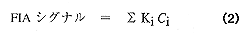
ここで、Kiは試料液中に存在する個々の酸の単位濃度当たりの電流値、Ci は個々の酸の濃度を表す。
従来法の滴定酸度を、試料50mlを用いて0.1N NaOH でpH8.2まで滴定したときのアルカリ消費量より求めて、FIAシグナルと比較したところ、21種類のコーヒー試料について両者の相関係数0.90が得られた。FIAは従来法に比べて、約40万分の1の試料で測定が可能であり、測定時間は約10分の1であった。
Fig.11は、pH 測定、滴定、FIAにより、ハワイコナのコーヒー豆の焙煎時間による酸含有量の変化を調べた結果である。一方、それぞれの焙煎時間のコーヒーについて、ヒトの味覚を利用した酸味についての官能テストで追跡すると、官能テストでは焙煎時間14分で一番強い酸味を感じ、以下15、16、0〜11分の順に酸味が低下し、0〜11分間の酸味は区別がつかなかった。このような酸味の官能テストの序列は、FIA シグナルおよび滴定酸度の示す序列とよく一致していた。pH から酸味を評価するのは困難と思われたが、FIA シグナルは官能テストの結果とも良い相関を示して酸味評価の指標となり得ることが分かった。FIA は、従来法に比して高感度で簡易・迅速な計測法であり、多くの飲料の酸度測定に有用であろう。
遊離高級脂肪酸の分離定量には、それ自身が発色団を持たないので、プレカラムあるいはポストカラム誘導体化を行いUV検出あるいは蛍光検出HPLCを用いることが多い。電気化学検出HPLCが高感度で選択性に優れ、かつキノンを用いる酸の検出においては誘導体化が不必要な点を考慮すると、本法の電気化学検出HPLCを用いると簡便に高級脂肪酸の分離定量できることが特徴である。
ダイズ油約0.1 〜1gを試験管に採り、移動相であるエタノール−アセトニトリル(10:90)液を5ml添加して溶かして試料溶液とし、この液 20μl をHPLC装置に注入して、ダイズ油中の遊離高級脂肪酸の分離定量を行った。このときの得られたクロマトグラムを、Fig.12 に示す。主な遊離高級脂肪酸は、ダイズ油1gあたりリノール酸 0.51mol、オレイン酸 0.26mol、パルミチン酸 0.17mol、ステアリン酸 0.046molであった。試料のダイズ油に同等量の標準リノール酸、オレイン酸、パルミチン酸およびステアリン酸を添加して行った回収実験結果は、90%〜98%の良好な回収率を示した。また、R.S.D.は2.5%以下であった。以上のように、本法は試料に移動相を溶かすという簡単な前処理を必要とするだけで、高感度な分離定量が可能であった。
FIA は、微量の酸を精度良く測定できるので、酵素反応の結果生じた微量の酸の定量にも適用できるので、血清中のリパーゼの活性測定に用いた。
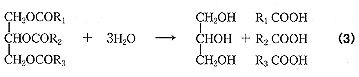
リパーゼは次式に示すように、基質であるトリグリセリドを加水分解し、脂肪酸を生成する。
オリーブ油15μl 、水40μl および0.01 Mリン酸塩緩衝液(pH7)35μlを試験管に採り、血清15μlを加えて、37℃、15分間充分かき混ぜながら酵素反応を行い、生じた脂肪酸をエーテルで抽出し、エーテル留去後の残留物を3 mM VK3と38mM LiClO4を含むエタノール溶液300μl に溶かして、この液を検液とした。また、血清を加えた直後にエーテルを加え、検液と同様に調製した溶液を空試験液とした。検液と空試験液5μl をそれぞれFIA装置に注入し、FIAシグナルから活性値を求めた。リパーゼ活性単位は、試料1lあたり1分間に1μmol の脂肪酸を生成する酵素量を1U/l と表す。
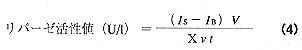
ここで、IS:検液のFIAシグナル(μA)、IB:空試験液のFIAシグナル(μA)、X:酸の標準液(オレイン酸)1M あたりのFIAシグナル(A / M)、v:試料採取量(μl)、V:全検液量(μl)、t:酵素反応時間(min)である。
市販のコントロール血清を用いて本法と、従来法の一つとして臨床分野で使用されるUV−酵素法により、リパーゼの活性値を測定して比較したところ、両者の相関は0.974であった。試料の量と測定時間の点では従来法が優れていたが、本法はR.S.D.3%以下で、精度の点で優れていた14, 15)。
その他の血清中の酵素活性測定では、コリンエステラーゼの測定も可能であった。基質としてアセチルコリンを用いると真性コリンエステラーゼ、またベンゾイルコリンを用いると真性および偽性コリンエステラーゼの活性測定が行えるので、両者の分別測定にも応用できる15)。
以上、キノンの電極還元反応を利用した微量の酸の計測について、我々の研究例を紹介した。本法は、キノンとの反応や電極反応への妨害がある際には不都合であるが、従来の中和滴定に比べて感度、精度、自動化などの点で優れた点が多いので、さらに広範な応用が期待できる。また、本測定の基本が電流計測であるので、酸の定量用のセンサー開発も可能である。センサー開発が進展すればさらに実用化が進むであろう。
参考文献
1)K. Takamura, Y. Hayakawa, J. Electroanal. Chem., 31, 225(1971).
2)K. Takamura, Y. Hayakawa, Anal. Chim. Acta., 43, 273(1968).
3)J. C. Abbott, J. W. Collat, Anal. Chem., 35, 859(1963).
4)高田芳矩,有川喜次郎,分析化学,23, 1522,(1974).
5)F. Kusu, T. Fuse, K. Takamura, J. AOAC Int., 77, 1686(1994).
6)布施哲男,楠 文代,高村喜代子,分析化学,44,29(1995).
7)K. Takamura, T. Fuse, F. Kusu, Anal. Sci., 11, 979(1995).
8)K. Takamura, T. Fuse, F. Kusu, J. Electroanal. Chem., 396, 507(1995).
9)T. Fuse, F. Kusu, K. Takamura, J. Chromatogr. A, 764, 177(1997).
10)Official and Tentative Method of the American Oil Chemists' Society , D. Frirestone(Ed.), American Oil Chemists' Society, Champaign, IL, Method Cd 3d-63(1989).
11)日本公定書協会監修:第十三改正 日本薬局方,廣川書店, p. B-523(1996).
12)T. Fuse, F. Kusu, K. Takamura, J. Pharm. Biomed. Anal., 15, 1515(1997).
13)T. Fuse, F. Kusu, K. Takamura, J. Agric. Food Chem., 45, 2124(1997).
14)布施哲男,楠 文代,高村喜代子,分析化学,44,771(1995).
15)K. Takamura, T. Fuse, F. Kusu, Anal. Sci., 12, 343(1996).
プロフィール
| 氏名 | 楠 文代(Fumiyo KUSU)49 歳 |
| 所属 | 東京薬科大学薬学部第二薬品分析化学教室・教授 〒192-0392 東京都八王子市堀之内1432-1 TEL:0426-76-4549 FAX:0426-76-4570 E-mail:kusu@ps.toyaku.ac.jp |
| 出身大学 | 東京薬科大学薬学部 |
| 学位 | 理学博士 |
| 現在の研究テーマ | 生体関連物質の分析化学,電気分析化学 |
| 趣味 | 華道,雑木林の散策 |