細胞老化と個体の老化・老年病
Cellular Senescence, Ageing and Age-Related Disorders
 |
城村 由和 東京大学医科学研究所 癌防御シグナル分野 助教 |
 |
中西 真 東京大学医科学研究所 癌防御シグナル分野 教授 |
Abstract
Cellular senescence is a state of durable cell cycle arrest with metabolic activities distinct from those of the proliferative state. Since senescence was originally reported to be induced by various genotoxic stressors, such as telomere erosion and oncogenic
signaling, it has been proposed to play a pivotal role in aging-related changes and as an anti-tumorigenic barrier in vivo. We and others have recently uncovered the mechanisms underlying the induction and maintenance of cellular senescence. In this review, we summarize recent observations in these mechanisms and their implications in age and age-related disorders as well as carcinogenesis in vivo.
1. はじめに
今から 50 年以上前に、ウィスター研究所のレオナルド・ヘイフリック博士は、ヒトの正常細胞を試験管の中で培養するとある一定回数の分裂の後に増殖を停止することを見出し、この現象を細胞老化と名付けた 1)。老化した細胞は、試験管内で長期に生存することが可能であるが、如何なる刺激に対しても二度と増殖を再開することはない。この一定の分裂回数は、細胞種により規定されるのではなく、細胞が得られた動物種により規定され、またその回数は動物の寿命と強い正の相関を示すため、細胞老化が個体の加齢性変化や寿命を規定する因子として重要な役割を果たしていることが示唆されていたが、直接あるいは間接的にこの仮説を証明する実験的証拠はほとんどなかった。最近になり、個体内における老化細胞の蓄積が、動脈硬化や 2 型糖尿病などの老年病や 2) 3) 4)、寿命そのものを制御する実験結果が示された 5)。また細胞老化誘導は個体における発がん防御機構の 1 つであることも提唱され、世界中の注目を集めている 6) 7)。本総説では、ごく最近の細胞老化誘導・維持機構についての知見から、個体における役割について紹介する。
2. 細胞老化誘導機構
細胞老化の誘導機構については、がん抑制遺伝子の産物である p53 および pRb ファミリーが重要な役割をはたすことが明らかにされ、細胞老化の誘導機構がいくつか提唱されていた。しかしながら、これらのモデルでは p53 や pRb の活性化が直接細胞老化を誘導するとしているが、正常培養細胞に活性型 p53 や pRb を発現させても細胞老化は誘導できないことから、未同定の新たな老化誘導経路の存在が示唆されていた。これらを明らかにする目的で、細胞老化過程を生細胞の細胞周期解析法(FUCCI 法) 8)を用いた解析を行った。その結果、がん遺伝子活性化ストレスを含めたすべての細胞老化刺激において、多くの細胞が G2 期における一時的な細胞周期の停止ののち、通常は起こるべき細胞分裂をすることなく G1 期に進行した。すなわち、分裂期の回避を生じて 4 倍体の G1 期細胞となり、不可逆的に細胞周期を停止することを見出した(図 1) 9)。老化の過程における細胞分裂制御タンパク質の発現の変化を解析したところ、分裂制御タンパク質発現が G2 期においてほぼ完全に消失することが細胞分裂期の回避の原因となっていることが分かった。
これまで細胞老化誘導に必須と考えられている p53 や pRb の細胞分裂期回避における役割を解析したところ、G2 期における p53 の活性化が分裂期の回避および細胞老化の誘導に必要かつ十分であることが明らかになった。
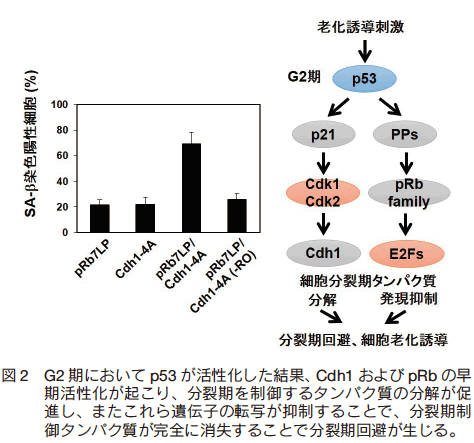
この結果から、 G2 期で活性化された p53 は、 APC/Ccdh1 および pRb ファミリーを協調的に活性化することにより分裂期の回避および細胞老化を誘導する可能性が考えられた。この可能性を検討するため、Cdh1 および pRb の構成的な活性化変異体それぞれ単独の発現、およびその両方の発現を一過性にかつ可逆的に誘導できる細胞株を樹立して解析した。その結果、 p53 を過剰に発現した細胞と同様に、 Cdh1 および pRb の発現を G2 期において一過的に誘導した場合のみ、分裂期の回避および細胞老化の誘導が認められた(図 2)9)。
次に、細胞分裂期回避がヒトの生体においても細胞老化の誘導において重要な役割をはたしているかどうかを検討した。ヒトの母斑細胞(ほくろ)は Ras 遺伝子の下流ではたらくリン酸化酵素 BRAF の変異により生じる老化細胞であることが報告されている 10)。母斑の組織切片における母斑細胞の DNA 含量を測定するため DAPI 染色を行った。その結果、正常な上皮細胞あるいは血管内皮細胞と比較して、母斑細胞は約 2 倍の DNA 含量を示すことが分かった。さらに、 G2 期/M 期のマーカーであるサイクリン B1 や細胞増殖のマーカーである Ki67 による組織免疫染色を行ったところ、母斑細胞においてはどちらも認められなかった。これらの結果から、生体に存在する老化細胞も 4 倍体の G1 期細胞であり、試験管内同様に G2 期での p53 活性化の結果生じた分裂期回避が重要な役割を果たしていると考えられた(図 3)9)。
3.細胞老化維持機構
老化細胞は不可逆的かつ恒久的増殖停止を示すのみならず、様々な特徴的性質を持っている。例えば、老化細胞は特異的に様々な炎症性サイトカインや、増殖因子を分泌している 11)。これを Senescence-Associated Secretory Phenotype(SASP)と呼んでいる。また老化細胞ではオートファジー経路が亢進している 12)。これらの老化細胞特異的性質が、個体における加齢性変化や寿命にどのような役割を果たしているのか不明な点も多いが、SASP が老化細胞周囲の微小環境に影響を与えて慢性炎症場を形成し、高齢個体における発がんや加齢性変化を促進していると考えられている。それでは、老化細胞特異的なこれらの性質はどのように制御されているのであろうか?これまで、細胞老化過程で細胞分裂期回避のため活性化された p53 が不活性化されることが SASP 誘導やオートファジー亢進と連動していると報告されていた 13)。我々は、老化細胞特異的に発現する因子が、老化細胞維持において p53 を負に制御していると考え、この因子の同定を試みた。その結果、Fbxo22 という F-box たんぱく質遺伝子が老化細胞特異的に発現誘導されていることが分かった。Fbxo22 は SCF たんぱく質分解複合体と結合し、 p53 をユビキチン化・分解誘導することが示された 14)。興味深いことに、Fbxo22 は p53 と同時に KDM4A リジン脱メチル化酵素とも結合し、SCF と合わせて大きな複合体を形成していることが分かった。 Fbxo22 の発現を抑制すると、メチル化 p53 が特異的に増加することも示された。面白いことに、Fbxo22 ノックアウトマウスは、様々な臓器・組織においてメチル化 p53 の蓄積が起こり、細胞の増殖が抑制されるため、正常ヘテロマウスに比較して約半分の大きさであった。重要なことに、Fbxo22 ノックアウト細胞では、老化細胞において SASP が顕著に抑制されていた。以上のことから、SASP 誘導には老化刺激による Fbxo22 の発現誘導と、SCFFbxo22 による p53 の分解が重要であると考えられる(図 4)。
4.老化細胞の蓄積と老化・老年病発症
様々な老年病発症に老化細胞蓄積が重要であることが示されている。例えば、加齢に伴う動脈硬化巣や脂肪組織の中に、SA-β-gal 染色で陽性となる老化細胞の蓄積が認められる 2) 3)。さらに最近、BubR1 早老症マウスに p16 プロモーターを用いた老化細胞除去カセット遺伝子を導入するシステムを用いた解析から、 p16 陽性細胞の除去が筋肉量低下や、脂肪萎縮、白内障などの老年病の発症を遅らせることが示された 4)。さらに、 p16 陽性細胞の除去は、正常マウスにおいても様々な老年病の発症を遅らせ、さらに寿命そのものも延長させることが示された 5)。興味深いことに、 p16 陽性細胞の除去は、発がんそのものも強く抑制することが分かり、老化細胞の蓄積が加齢個体において発がんを促進することが、実験的に証明された。さらに、LDH ノックアウトマウスに見られる動脈硬化亢進に、脂肪を蓄積したマクロファージの細胞老化が重要な役割を果たしていることも示された 15)。これらの成果は加齢個体から老化細胞を除去することで、寿命を延長するのみならず様々な老化・老年病の発症を予防することができることを示している。
5.終わりに
近年、個体の加齢性変化や老化・老年病発症、さらには寿命制御にも細胞老化が重要な役割を果たしていることが実験的に示され始めた。今後、老化細胞除去のための様々な技術が開発されることで、人類の健康寿命の延長が可能になるかもしれない。しかしながら、なぜ加齢個体において老化細胞が蓄積するのか?若い個体においてどのような分子機序で老化細胞が除去されるのか?まだ不明な命題も数多く残されている。これらの点を含めて、細胞老化分野におけるさらなる基礎研究の進展が期待される。
| 著者プロフィール | |
| 氏名 | 城村 由和(Yoshikazu Johmura) |
|---|---|
| 所属 | 東京大学医科学研究所 癌防御シグナル分野 助教 |
| 連絡先 | 〒108-8639 東京都港区白金台 4-6-1 TEL: 03-5449-5341 FAX: 03-5449-5342 E-mail: Johmuray@ims.u-tokyo.ac.jp |
| 出身学校 | 名古屋市立大学薬学部 |
| 学位 | 博士(薬学) |
| 専門分野 | 分子細胞生物学 細胞老化 |
| 氏名 | 中西 真(Makoto Nakanishi) |
| 所属 | 東京大学医科学研究所 癌防御シグナル分野 教授 |
| 連絡先 | 〒108-8639 東京都港区白金台 4-6-1 TEL: 03-5449-5341 FAX: 03-5449-5342 E-mail: mkt-naka@ims.u-tokyo.ac.jp |
| 出身学校 | 名古屋市立大学医学部 |
| 学位 | 博士(医学) |
| 専門分野 | 分子細胞生物学 細胞老化、癌防御 |