りん光計測に基づく生体内酸素プローブの開発
Development of in vivo oxygen probes based on phosphorescence measurement
 |
吉原 利忠 群馬大学大学院理工学府 分子科学部門 准教授 |
 |
飛田 成史 群馬大学大学院理工学府 分子科学部門 教授 |
Abstract
Molecular oxygen plays a pivotal role in aerobic organisms as a terminal electron acceptor in the electron transport chain in mitochondria. Oxygen deprivation(hypoxia) in organisms is associated with various hypoxia-related cellular functions and diseases, and thus there is urgent need for accurate techniques to evaluate the intracellular and in vivo oxygen status. This review focuses on optical oxygen imaging method using phosphorescent probes. Principles of oxygen sensing by means of phosphorescence quenching, representative phosphorescent oxygen probes and their applications to intracellular and in vivo oxygen measurements are described, emphasizing the usefulness of iridium complexes as new biological oxygen probes.
1. はじめに
分子の発光を利用した生体関連化学種のセンシング技術は、近年、生物や医学の研究にとって欠かせない重要な技術となっている 1),2)。対象となる分子(あるいはイオン)は、①K+、Ca2+などのカチオン、②ハロゲン化物イオン、リン酸イオンなどのアニオン、③糖、グルコースなどの中性分子、さらに、④タンパク質、DNA などの生体高分子と非常に多岐にわたる。
例えば、金属イオンのセンシングでは、蛍光団を含むレセプターが金属イオンと結合することにより、蛍光団の吸収・発光の強度や波長が変化することを一般に利用している。有機化合物の発光は、通常、励起一重項状態(S1)からの発光、すなわち蛍光であるため、これまでの発光プローブはほとんどが蛍光を検出する蛍光プローブであった(図 1)。
一方、最近、蛍光に代わって励起三重項状態(T1)からの発光であるりん光(図 1 参照)を使った、同様の発光プローブ(りん光プローブ)が開発されつつある 3)。蛍光に代わってりん光を使う利点は、どこにあるのだろうか。りん光は蛍光に比べて、吸収スペクトルと発光スペクトルのピークのエネルギー差(Stokes shift)が大きい。そのため、蛍光顕微鏡を用いた発光画像測定の際にフィルターを使って励起光を除去しやすい、という利点がある。また、りん光は、いわゆるスピン禁制遷移であるため、蛍光に比べて励起状態に留まっている平均の時間(励起寿命)が長い。その結果、りん光プローブを取り込んだ培養細胞などの生体試料を時間幅の短いパルス光で励起すると、自家蛍光は数十ナノ秒以内に減衰して消えてしまうが、りん光は数百ナノ秒あるいは数マイクロ秒以上の間、光り続ける。従って、励起パルスに対して蛍光がほぼ完全に減衰する程度の遅延時間を置いてから発光を測定すれば、自家蛍光を除去してプローブのみの発光を測定感度を上げて観測できる、という大きな利点を有する。
一方、りん光寿命が数マイクロ秒以上の励起分子では、励起寿命の間に拡散によって周囲の酸素分子との衝突が可能となるため、酸素分子にエネルギーを渡して励起分子が失活するりん光消光が起こる(図 1)。その結果、りん光強度が減少するとともに、りん光寿命が短くなる。この酸素によるりん光消光反応を利用すると、生体内の酸素レベルをリアルタイムで検出することが可能になる 4-8)。本報では、このりん光プローブを用いた生体内酸素計測について、現在我々の研究室で行っているイリジウム錯体をりん光性酸素プローブとして用いた細胞や組織内の酸素計測を中心に紹介したい。
2. りん光計測に基づく酸素測定
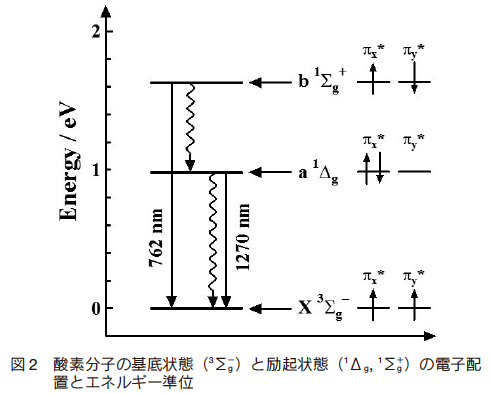
酸素分子は、図 2 に示すように、エネルギー的に低い位置に二つの電子的励起状態を有する。これらの状態は、電子状態を表す記号を用いて、1Σg+、1Δg 状態と表記される。ここで、左上の 1 は、分子内の電子のスピン状態が一重項状態であることを示している。
酸素の励起状態の中でエネルギー的に最も低い 1Δg 状態は、一般に一重項酸素と呼ばれ、いわゆる活性酸素の一種としてよく知られている。1Δg 状態のエネルギー(0.98 eV)は、通常の芳香族有機分子の励起三重項状態のエネルギーに比べてかなり低いため、酸素分子は励起分子と衝突するとそのエネルギーを受け取って、励起分子を失活させる性質をもっている(図 1)。この過程は、一般にエネルギー移動消光と言われる。さらに、酸素分子は電子を受け取りやすい性質をもつため、電子を放出しやすい励起分子と衝突すると、酸素分子への電子移動反応によっても消光を起こし得る。この過程は、電子移動消光と呼ばれる。
酸素によるイリジウム錯体のりん光消光反応の機構は、配位子の構造によって異なる。三重項エネルギーが低く電子を放出しづらい錯体では、主にエネルギー移動によって消光が起こり、三重項エネルギーが高く電子を放出しやすい錯体では、エネルギー移動と電子移動の両過程によって消光が起こる 9)。
溶液中では、脱酸素した状態のりん光寿命 τp0(または、りん光強度 I p 0)と酸素存在下のりん光寿命 τp(または、りん光強度 I p)は、酸素濃度[O2]または酸素分圧 pO2 と、次に示す Stern-Volmer の式に従うことが知られている。
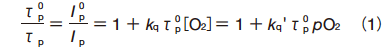
ここで、kq(kq')は消光速度定数と呼ばれ、消光反応の起こりやすさの尺度となる量である。従って、あらかじめ、脱酸素下でのりん光寿命 τ p0 と kq 値を求めておけば、りん光寿命 τ p を測定することにより、励起分子周囲の酸素濃度あるいは酸素分圧を求めることができる 10)。
3.低酸素マーカーとの違い
低酸素状態にある生体組織を簡便に検出する方法として、ピモニダゾール(1-(2-Nitro-1H-imidazol-1-yl)-3-(piperidin-1-yl)-2-propanol)に代表される 2- ニトロイミダゾール誘導体を使った低酸素マーカーが古くから用いられている。ピモニダゾールは、酸素分圧が約 10 mmHg 以下の低酸素組織に取り込まれると、タンパク質のチオール基に結合し固定化されるため、ピモニダゾールが結合した組織を抗ピモニダゾール抗体を用いて免疫染色することで、組織中の酸素濃度勾配を検出することができる。この方法は、対象となる細胞や組織のある時点での酸素濃度勾配を、比較的簡便な測定で画像化できるという利点を有するが、生体内の酸素濃度を定量し、その変化をリアルタイムで追跡することはできない。
一方、りん光プローブを用いた酸素計測法では、細胞や組織に取り込まれたプローブの濃度が変わらなければ、発光強度の増減は酸素濃度の相対的な変化をリアルタイムで与えることになる。しかし、発光の強さは、プローブの濃度や励起光強度に依存するため、観測された発光強度が高いから低酸素状態にある、と判断することは難しいので注意が必要である。酸素濃度の高低を定量的に議論するには、上で述べたりん光寿命の測定が必要になる。
4.代表的なりん光性酸素プローブ
“はじめに”で述べたように、通常の有機分子が与える発光は蛍光に分類され、室温で強いりん光を与える有機分子はほとんど見られない。しかし、分子中に金属イオンを含んだいわゆる金属錯体の中には、脱酸素溶液中で強いりん光を与える化合物がある。その中で、早くから生体内酸素プローブとして注目されてきた錯体として、図 3A,B に示すルテニウム(Ⅱ)錯体 11)とパラジウム(Ⅱ)または白金(Ⅱ)イオンを中心にもつ金属ポルフィリン 12)がある。これらの錯体は、分子構造に多くの改良が重ねられ、培養細胞内あるいは生体組織の血流中の酸素プローブとして用いられている 8)。
一方、我々は有機 EL(Organic electroluminescence)の発光材料として用いられているイリジウム錯体が、溶液中においても強いりん光を与えることに着目し、まず、赤色発光を与える BTP(図 3C)について酸素プローブとしての有用性を検討した 13)。その結果、BTP は担癌マウスの尾静脈に投与すると、数十分以内に血中から癌細胞内に取り込まれ、低酸素状態にある腫瘍を発光イメージングできることが分かった。その後、BTP 誘導体を中心に、イリジウム錯体に基づく様々な生体酸素プローブの開発を行ってきている 7),8)。
5.イリジウム錯体の特徴
イリジウム錯体の特徴として、配位子の構造を合成化学的に修飾しやすいこと、配位子の構造によって、吸収・発光波長、発光寿命等の発光特性を変えることができること、さらに、細胞内取り込み能、細胞内局在等の細胞特性も制御できることが挙げられる。例えば、図 4 に示すように、BTP のアセチルアセトナート(acac)配位子をジピリナート配位子に変えると、モル吸光係数が約 6 倍に増加し、発光波長を組織への透過性の高い近赤外領域まで延長させることができる。また、BTP の acac 配位子にアニオン性またはカチオン性置換基を導入した錯体(図 5)では、吸収・発光特性は保持させながら、細胞特性を変化させることができる。細胞内への取り込み量を ICP-MS(誘導結合プラズマ質量分析法)を使って分析したところ、BTP に比べてカチオン性置換基を有する BTPDM1 では、約 20 倍取り込み効率が増加した 14)。また、BTP と BTPSA の細胞内局在が主に小胞体であるのに対し、BTPNH2、BTPDM1 はライソソームに集積する性質を有することが明らかにされている 14)。さらに、図 6 に示す BTP-Mito では、ミトコンドリアへの集積を促進するといわれているトリフェニルホスホニウムカチオン(TPP)を acac 配位子に導入したところ、実際にミトコンドリアに対する集積性を示し、培養器の酸素分圧を 21% から 2.5% に減じると、発光輝度が上昇するとともに発光の減衰速度が遅くなった。すなわち、りん光寿命が長くなることが確かめられた 15)。
6.イリジウム錯体を使った細胞内酸素濃度計測
りん光性酸素プローブを使って、細胞内の酸素濃度を定量することはできるのだろうか。その答えを得るには、まず、プローブ分子が細胞内で置かれた環境について考慮する必要がある。図 5 に示したようなイリジウム錯体は疎水性が高いため、細胞内に取り込まれると特定のオルガネラ膜中に局在すると予想される。オルガネラ膜中には様々な膜タンパク質が存在するため、タンパク質と相互作用して酸素への感受性が変化する可能性がある。実際、細胞内に取り込まれたイリジウム錯体の酸素存在下でのりん光減衰曲線は、単一指数関数的減衰からはずれる傾向が見られる。これは、一部のイリジウム錯体が膜タンパク質と結合して酸素分子との衝突が妨げられていることを示唆している。以上のような考察から、細胞内の酸素濃度を定量する際に、緩衝溶液中で Stern-Volmer 解析を行って得られた kq 値を使うことはできない。そこで我々は、図 6 の例が示すように、培養細胞内に取り込まれたプローブのりん光寿命が、培養器の酸素分圧に依存して変化することに着目し、培養器の酸素分圧に対してりん光寿命をプロットして calibration を行う方法を提案している 14)。
7.イリジウム錯体を使った in vivo 酸素計測
イリジウム錯体のりん光は、低酸素状態でより強く光る性質をもつため、低酸素状態に陥っているがん腫瘍をより強く光らせて正常組織と識別することができる 14)。図 7A は、SCC-7(マウス扁平上皮がん由来)細胞を移植した担癌マウスの尾静脈に BTPDM1(DMSO/Saline(1:9)溶液)を 25 nmol 投与し、2 時間後に in vivo イメージング装置(Maestro 2)を使って測定した発光イメージング画像である。プローブ投与前の画像では自家蛍光しか見られないが、BTPDM1 投与後に測定した発光画像では、腫瘍部分でプローブがより強く発光していることがわかる。 ICP-MS を使って BTPDM1 を投与してから 2 時間後の体内分布を調べたところ、BTPDM1 は全身に分布し、腫瘍への集積は特に認められなかった。従って、腫瘍部でのより強い発光は、正常組織と腫瘍内の酸素濃度の差に起因すると考えられる。実際、腫瘍部とその対側の正常組織をレーザーダイオード(波長: 488 nm, パルス幅: 20 ns, 繰り返し: 40 kHz)を使って励起し、BTPDM1 のりん光寿命を測定したところ、腫瘍組織と正常組織の平均りん光寿命は、それぞれ3.95 μs、2.04 μsとなり、確かに腫瘍の方が酸素濃度が低いことが分かった。
さらに、SCC-7 の培養細胞を用いて前節で述べた方法で寿命の calibration を行ったところ、腫瘍組織と正常組織の酸素分圧は、それぞれ 6.1 mmHg, 50 mmHg と見積もられ、腫瘍が低酸素状態になっていることが実験的に示された。
イリジウム錯体は細胞内移行性が非常に高いという特徴をもつ。そのため、マウスの血中に投与したイリジウム錯体は、血中から組織の細胞内へ速やかに移行するため、特定の臓器の酸素化状態を個体が生きた状態で検出することが可能である。例えば、麻酔下でイリジウム錯体を投与したマウスを開腹し、腎臓表面にレーザー光を照射してりん光寿命を測定することにより、腎臓の酸素レベルを低侵襲的に調べることができる 16)。
8.おわりに
りん光性酸素プローブを使った生体酸素計測技術は、従来の酸素電極を組織に挿入して電気化学的に酸素を検出する方法に比べると、生体に対する侵襲性が低く、また、寿命測定を行えば酸素濃度を定量することも可能である。特に蛍光寿命イメージング法(FLIM; Fluorescence lifetime imaging microscopy)をりん光に拡張したりん光寿命イメージング法(PLIM; Phosphorescence lifetime imaging microscopy)を用いると、組織中の酸素濃度勾配を細胞レベルの高空間分解能で検出できるため、それぞれの目的に適合した発光プローブの開発が望まれている。
血中の酸素濃度を定量するための発光プローブについては、Pt(Ⅱ)- あるいは Pd(Ⅱ)- ポルフィリンを水溶性デンドリマー化したプローブがすでに実用化されている。一方、細胞内の酸素濃度を定量するプローブについては、プローブの置かれた環境が複雑であることから、酸素濃度定量の精度をいかに向上させるかなど、まだ、いくつかの課題が残されているが、今後、さらに重要性が増していくと予想される。
| 著者プロフィール | |
| 氏名 | 吉原 利忠(Toshitada Yoshihara) |
|---|---|
| 所属 | 群馬大学大学院理工学府 分子科学部門 准教授 |
| 連絡先 | 〒371-0801 桐生市天神町 1-5-1 TEL: 0277-30-1211 FAX: 0277-30-1213 E-mail: yoshihara@gunma-u.ac.jp |
| 出身学校 | 群馬大学大学院工学研究科 |
| 学位 | 博士(工学) |
| 専門分野 | 光化学、光生命科学 |
| 氏名 | 飛田 成史(Seiji Tobita) |
| 所属 | 群馬大学大学院理工学府 分子科学部門 教授 |
| 連絡先 | 〒371-0801 桐生市天神町 1-5-1 TEL: 0277-30-1210 FAX: 0277-30-1213 E-mail: tobita@gunma-u.ac.jp |
| 出身学校 | 東京工業大学大学院理工学研究科 |
| 学位 | 博士(理学) |
| 専門分野 | 光化学、光生命科学 |